NGHIÊN CỨU MỘT SỐ CHỈ SỐ KHÁNG INSULIN VÀ CHỨC NĂNG
TẾ BÀO BETA TRÊN ĐỐI TƯỢNG NỮ ĂN CHAY TRƯỜNG
Nguyễn Hải Thủy, Nguyễn Thị Kim Anh, Nguyễn Hải Quý Trâm,
Lê Thị Phương Anh*, Nguyễn Hải Ngọc Minh
Trường Đại Học Y Dược Huế, *Bệnh Viện Trung Ương Huế
ABTRACT
INSULIN RESISTANCE AND FUNCTION OF BETA CELL IN FEMALE SUBJECTS WITH VEGAN DIET.
Objectives. The aim of this study was evaluate the insulin resistance and function of beta cell in female subjects with vegan diet. Methods: A cross sectional analysis of 144 female subjects with vegan diet. The participants were assessed insulin resistance by Fasting insulinemia, HOMA-IR, QUICKI and Mac Auley index and function beta cell by HOMA % Beta index. Results. The average of Fasting insulin level was 6,9 ±4,3 U/ml, HOMA-IR was 1,67 ±1,62, QUICKI was 0,37 ± 0,04 and McAuley index was 7,5 ± 1,9. The prevalence of insulin resistance basing on IF (≥12µU/ml ) was 7,6%, HOMA-IR ( ≥2,6) was 9,7%, QUICKI (<0,33) was 9% and McAuley ( ≥ 5,8) was 18,8%, Prediction of insulin resistance basing on the cut-off of HOMA-IR and QUICKI levels were happened at 18th year of vegan diet duration. The mean HOMA-% B level was 154,6 ± 345,6% in which HOMA-% B < 116% was 66,7%. There were significantly different HOMA-% B value between the different vegan diet duration, highest in early 15 year (253±559%) and lowest after 15 year (100±51%). Prediction of beta cell dysfunction basing on the cutoff of HOMA-% Beta was at 17th year of vegan diet duration.
Chịu trách nhiệm chính: Nguyễn Hải Thủy
Ngày nhận bài:1.10.2015
Ngày phản biện khoa học:15.10..2015
Ngày duyệt bài: 1.11.2015
I. ĐẶT VẤN ĐỀ
Ăn chay gồm nhiều dạng bao gồm thức ăn không có sữa hoặc không có trứng (thuần túy); hoặc có sữa hoặc có trứng . Chính vì thế khi áp dụng các thể loại này có thể có những kết quả khác nhau về tình trạng chuyển hóa và sức khỏe con người.
Ambroszkiewicz J1 và cộng sự (2004), Chien Jung Hung và cộng sự (2005), Neal D Barnard và cộng sự (2009),Serena Tonstad và cộng sự (2009), Shailendra Kumar Tripathi và cộng sự (2010).Yoko Yokoyama và cộng sự (2014) qua nhiên cứu đều ghi nhận người ăn chay trong thời gian ngắn có lợi, đặc biệt có hiệu quả trên bệnh rối loạn chuyển hóa và tim mạch. Tuy vậy một số kết quả nghiên cứu của Penghui Shang và cộng sự (2011) tại Đài Loan ghi nhận chế độ ăn chay không làm giảm nguy cơ hội chứng chuyển hóa so với người không ăn chay. Nghiên cứu tiến cứu củaTeresa Laskowska-Klita và cộng sự cho rằng trẻ ăn ăn chay có nồng độ vitamin D thấp và có nguy cơ thiếu hụt vitamin D tiền đề của đái tháo đường .
Hoàng Thị Thu Hương và cộng sự (2002) ghi nhận ăn chay trường có thể lại gây hiệu ứng ngược lại thông qua rối loạn lipid máu nhất là tăng triglycerid và sự gia tăng thành phần này là nguồn gốc của sự đề kháng insulin . Nguyễn Hải Thủy và cộng sự (2004) ghi nhận tỷ lệ về tiền ĐTĐ và ĐTĐ của đối tượng ăn trường chay cao hơn gấp 2-3 lần so với người không ăn chay cùng độ tuổi. Phát xuất từ các nghiên cứu trên đây chúng tôi khảo sát tình trạng kháng insulin và chứa năng tế bào beta trên đối tượng ăn chay để làm rỏ vấn đề này.
Mục tiêu: Khảo sát một số chỉ số kháng insulin và chức năng tế bào beta ở đối tượng nữ ăn chay trường.
II. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
- ĐỐI TƯỢNG NGHIÊN CỨU: 144 phụ nữ có chế độ ăn chay trường ít nhất 5 năm trở lên và có tuổi đời 20 trở lên
- PHƯƠNG PHÁP NGHIÊN CỨU: Nghiên cứu cắt ngang mô tả và phân tích. Tiến hành trong tháng 4 năm 2015
Các biến số trong nghiên cứu
- Tuổi đời.
- Thời gian ăn chay : Trong nghiên cứu chia làm 3 nhóm dưới 15, 15-30 và trên 30
- Định lượng nồng độ Insulin máu lúc đói (micro U/ml): Insulin đo bằng phương pháp điện di miễn dịch phát quang hóa học (electrochemiluminesccence immunoassay “ECLIA”) phân tích bằng máy Cobas của hãng Abbott.
- Chỉ số HOMA – IR tính theo công thức: Mô hình HOMA-1 được Matthews DR (1985) đề xuất và được TCYTTG công nhận và áp dụng chỉ số này trong đánh giá kháng insulin.
Công thức tính kháng insulin HOMA =
( Io x Go)/22,5, trong đó : Io là nồng độ insulin máu lúc đói, đơn vị đo là µU/ml. Go là nồng độ glucose máu lúc đói, đơn vị tính là mmol/l.
- Chỉ số QUICKI : Còn gọi là chỉ số kiểm soát độ nhạy chất lượng insulin. Chỉ số QUICKI được tính theo công thức của Kazt và cộng sự (2000) .
Chỉ số QUICKI = 1/Log [insulin (μU/ml) + glucose (mg/dl)].
Đánh giá đề kháng insulin: QUICKI index =1/[logI0(µU/ml) + logG0(mg/dl)].
- Công thức McAuley (McA)
Exp [2.63 – 0.28 ln (insulin in mU/L) – 0.31 ln (triglycerides in mmol/L)] : < 5,8
Đánh giá Kháng insulin khi FI : ≥ 12 µU/ml, HOMA : ≥ 2,6, QUICKI : < 0,33 và McAuley (McA) : < 5,8
- Chức năng tế bào beta: Công thức HOMA-% B = Beta cell function
Đánh giá : Giảm chức năng tế bào beta khi HOMA-% B (+) = < 116%
Xử lý và phân tích số liệu theo phương pháp thống kê y học
III. KẾT QUẢ
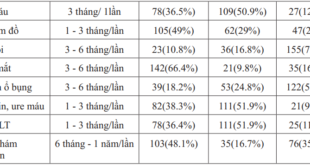
Bảng 1. Tuổi và thời gian ăn chay của 144 đối tượng nghiên cứu

Nhóm trên 60 tuổi chiếm tỷ lệ 36,8% và nhóm dưới 40 tuổi là 35,4%
Thời gian ăn chay trên 30 năm 40,3% và dưới 15 năm là 25,7%
Bảng 2. Đánh giá các chỉ số Kháng insulin

Trong nghiên cứu này chúng tôi chọn điểm cắt (Cutoff) về FI, chỉ số HOMA-IR, chỉ số QUICKI và McA dựa vào sự đồng thuận của các nghiên cứu trước đây của Juan F.Ascaso và cộng sự (2003), Lukshmy M Hettihewwa và cộng sự ( 2006), Hui-Qi Qu và cộng sự ( 2011) và Kanwwal Mohinder Dev Singh Panag và cộng sự ( 2014) chọn Cutoff để đánh giá kháng insulin khi nồng độ FI ≥ 12 µU/ml, HOMA-IR ≥ 2,6, QUICKI < 0,33 và McA< 5,8 kết quả ghi nhận như sau.
Khi dựa vào nồng độ Insulin máu đói (FI) trung bình 6,9±4,3 µU/ml, kháng insulin theo IF ≥12 µU/ml là 7,6%. Đánh giá theo chỉ số HOMA-IR trungbình 1,67±1,62, kháng insulin theo HOMA ≥ 2,6 cũng chỉ là 9,7%.Khảo sát chỉ số QUICKI trung bình 0,37±0,04, kháng insulin theo QUICKI < 0,33 chỉ chiếm 9% trường hợp.Trong 3 phương pháp này tỷ lệ gần ngang nhau.
Tuy nhiên dựa vào công thức McAuley index (McA) trung bình 7,5 ± 1,9, kháng insulin theo McA < 5,8 là 18,2% cao hơn so với FI, HOMA-IR và QUICKI. Để giải thích sự khác biệt này như sau.
Nhiều tác giả cho rằng chỉ số McA nhạy hơn so với FI, HOMA-IR và QUICKI
Khi sử dụng chỉ số McA có 2 thông số sử dụng chính FI và Triglyceride. Trong kháng insulin liên quan chủ yếu đến acid béo tự do (FFA). Theo lý thuyết dưới tác dụng Insulin làm tăng hoạt động lipoprotein lipase (LPL) thoái biến TG thành FFA nhằm cung cấp năng lượng cho cơ quan và có sự chuyển hóa ngược lại FFA chuyển thành TG. Trong đối tượng nữ ăn trường chay trong nghiên cứu này có tỷ lệ tăng TG (1,7 mmol/l) là 43,8% có nghĩa là có sự suy giảm chức năng tế bào beta hay kháng insulin . Sự gia tăng TG là nguyên nhân liên quan đến phương pháp McA .
Nghiên cứu Chien Jung Hung và cộng sự (2005) nghiên cứu trên 98 người khỏe mạnh chia 2 nhóm có và không ăn chay ghi nhận nhóm ăn chay có nồng độ glucose và insulin thấp hơn nhưng insulin tăng nhạy hơn so với nhóm không ăn chay, giải thích chế độ ăn và BMI thấp hơn. Trong khi đó Penghui Shang và cộng sự (2011) nghiên cứu 10 năm với trên 93.209 người ghi nhận chế độ ăn chay không giảm nguy cơ hội chứng chuyển hóa.
Gaffar Sargar Zaman và công sự (2010) ghi nhận tần suất đái tháo đường type 2 ở nhóm ăn chay 3,1% so với 8,2% trong nhóm không ăn chay.
Nico S.Rizzo và cộng sự (2011) trong một nghiên cứu cắt ngang trên 773 người (tuổi trung bình 60 tuổi) ghi nhận trong nhóm tiết thực vegan làm giảm nhiều thành tố hội chứng chuyển hóa ngoài trừ HDL.C khi so sánh với nhóm không ăn chay.
Jui Kun Chang và cộng sự ( 2013) khảo sát trên 391 phụ nữ ăn chay ghi nhận BMI thấp hon, vòng bụng bé hơn, giảm bilan lipid kể cả HDL.C tuy nhiên các tỷ TC/HDl.C và LDL.C/HDL.C vẩn có tỷ lệ thấp so với 315 phụ nữ không ăn chay.
H Kahleoa và cộng sự (2011) nghiên cứu sau 4 tuần chế độ ăn chay hạn chế năng lượng (caloric restricted vegetarian diet) cho 74 bệnh nhân đái tháo đường týp 2 ghi nhận có sự cải thiện sự nhạy của insulin, giảm mỡ bụng và giảm các cytokine viêm .
Tỷ lệ kháng insulin trên đối tượng nghiên cứu của chúng tôi không cao một phần giải thích là sự tổn thương tế bào beta tuy trên đối tượng này là nhiểm độc đường (glucotoxic) do sau nhiều năm với chế độ ăn nhiều carbohydrate so khuyến cáo (≥ 60% tổng năng lượng) làm tế bào tụy tăng hoạt động so với người bình thường, nồng độ cao TG liên quan nhiểm độc lipid tại tụy gây chết tế bào tụy theo lập trình (apotosis) và giảm nồng độ HDL.C.
Bảng 3. Liên quan các chỉ số kháng insulin và thời gian ăn chay

Có sự khác biệt về giá trị các chỉ số kháng insulin với các nhóm có thời gian ăn chay khác nhau nhất là chỉ số McA
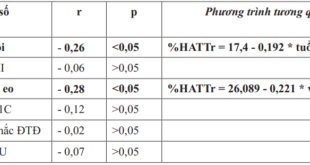
Bảng 4. Tương quan giữa thời gian ăn chay và các chỉ số kháng insulin

Có sự tương quan giữa thời gian ăn chay với chỉ số FI, HOMA-IR, QUICKI và McA.

Biểu đồ 1. Tương quan nghịch giữa chỉ số McA và thời gian ăn chay
(r = – 0,419, p < 0,01)

Biểu đồ 2. Tương quan giữa chỉ số HOMA IR và Thời gian ăn chay
(r=0,242, p < 0,05)

Biểu đồ 3. ROC của chỉ số HOMA-IR ≥ 2,6 với AUC = 0,671

Biểu đồ 4. ROC của chỉ số QUICKI< 0,33 với AUC = 0,664
Sau 22 năm chỉ số HOMA-IR ≥ 2,6

Sau 22 năm chỉ số QUICKI < 0,33

Biểu đồ 5. ROC của chỉ số McA < 5,8 với AUC = 0,743

Bảng 5.Hồi quy đa biến chỉ số HOMA-IR

a. Dependent Variable: HOMA-IR
Với y (HOMA) là biến phụ thuộc, có hàm đa biến như sau
Y (HOMA) = -2.252 – 0,005TG ăn chay + 0.554 glucose + 0,275 insulin + 0,001VB – 0,060 HbA1C – 0,058 TG
Bảng 6.Hồi quy đa biến với chỉ số McA

a. Dependent Variable: McA
Với y (McA) là biến phụ thuộc, có hàm đa biến như sau Y (McA) = 10,764 – 0,014 TG ăn chay – 0.006 glucose – 0,210 insulin – 0,007VB + 0,128 HbA1C – 0,821 TG
- CHỨC NĂNG TIẾT INSULIN CỦA TẾ BÀO BETA
Bảng 7. Đánh giá chức năng tế bào beta

Chức năng tế bào beta đánh giá qua công thức HOMA-% B hoặc HOMA-% S
(sitmulating) trung bình là 154,6 ± 345,6 % với giá trị thấp nhất 14,29 và cao nhất 3080. Chúng tôi chọn Cutoff theo Abu Kholdun Al-Mahmood và cộng sự (2006) tại Malaysia điểm cắt 116,65% dành cho người không béo phì ghi nhận tỷ lệ đối tượng có HOMA-%B < 116 % là 66,7%. Diều này nói lên sự suy giáp chức năng tế bào beta là phổ biến.
Bảng 8. Liên quan giữa chỉ số HOMA-% Beta và thời gian ăn chay

Khi khảo sát liên quan chỉ số HOMA-% B với các nhóm có thời gian ăn chay khác nhau ghi nhân chỉ số HOMA-% B là 253±559 % rất cao so với ngưỡng 116 % B trong 15 năm đầu tiên của thời gian ăn chay, điều này chức năng tế bào beta tăng hoạt động với thành phần CHO tiêu thụ qua khảo sát ≥70% tổng năng lượng trong khẩu phần ăn hàng ngày qua các điều tra trước đó. Sau thời gian trên chỉ số HOMA-% B này có khuynh hướng giảm dần, chứng tỏ tế bào beta bắt đầu suy giảm từ thời gian này phù hợp với Hb1Ac bắt đầu gia tăng trong khoảng thời gian này qua nghiên cứu (với CUTOFF khoảng 18 năm )

Biều đồ 6 : ROC của HOMA%B < 116 ) theo thời gian ăn chay với AUC = 0,564

Biểu đồ 7 : ROC của HOMA%B < 116 theo tuổi với AUC= 0,619
Như chúng ta biết nguyên nhân gây suy giảm chức năng tế bào beta liên quan nhiều yếu tố như nhiểm độc glucose, nhiểm độc lipid, cường insulin trong đó có vai trò của tuổi đời. Kết quả của chúng tôi ghi nhận chức năng tế bào beta với HOMA-%B < 116% xảy ra sau thời gian ăn chay 17 năm và nhưng nếu dựa theo tuổi 31 năm. Tương ứng với dự báo tiền ĐTĐ (HbA1c ≥ 5,7%) theo thời gian ăn chay là 18 năm và theo tuổi là 43 năm trên đối tượng này. Điều này cho thấy vai trò yếu tố thời gian ăn chay càng lâu thì nguy cơ suy giảm chức năng tế bào beta tụy càng tăng.
Kết luận. Qua đánh giá các chỉ số kháng insulin trên đối tượng nữ ăn trường chay cho thấy tình trạng kháng insulin có tỷ lệ thấp và có sự khác biệt giữa chỉ số McA và các chỉ số FI, HOMA-IR và QUICKI. Tuy nhiên chức năng tế bào beta mặc dù gia tăng trong những năm đầu nhưng lại sút giảm sau đó liên quan đến thời gian ăn chay với điểm cắt là 17
năm ngắn hơn so với điểm cắt dựa vào tuổi là 31 năm.
TÀI LIỆU THAM KHẢO
- Hoàng Thị Thu Hương nghiên cứu sự biến đổi một số các chỉ số sinh học liên quan đến tình trạng dinh dưỡng trên người tu hành ăn chế độ chay tại các chùa ở Huế Tạp Chí Y Học Thực Hành .Số 507 -508. (2015)(trang 480 – 491).
- Nguyễn Hải Thủy, Nguyễn Thọ Lịch, Thích Hải Ấn (2015). Khảo sát tăng đường máu ở đối tượng ăn trường chay trên 40 tuổi. Tạp Chí Y Học Thực Hành. Số 507 -508. (2015) (trang 375 – 386).
- Chien Jung Hung, Po Chao Hoang, Yi Hwei Li (2005). Taiwanese vegetarians have higher insulin sensitivity omnivores.
- Neal D Barnard, Heather I Katcher, David JA Jenkins. (2009) Vegetarian and vegan diets in type 2 diabetes management. Nutrition Reviews. Vol 64(5): 255-263.
- Penghui Shang, Zheng Shu, Yanfang Wang, Na Li, Songming Du, Feng Sun, Yinyin Xia, Siyan Zhan.Veganism does not reduce the risk of the metabolic syndrome in a Taiwanese cohort Asia Pac J Clin Nutr 2011;20 (3):404-410
- Naomi K Fukagawa, James W Anderson, Geja Hageman (1990). High carbohydrate, high fiber diets increase peripheral insulin sensitiviy in healthy young and old dults. Am J Clin Nutr 1990; 52-524
- Jack Norris ,Ginny Messina (2013). Type 2 diabetes and the vegan diet. VeganHealthOrg. 2013
- Jack Norris ,Ginny Messina (2013). Disease markers of vegetarians. VeganHealthOrg. 2013
- Kahleova, M Matoulek, H.Malinska. (2010). Vegetarian diet improves insulin resistance and oxidative stress markers more than conventional diet in subjects with type 2 diabetes. Diabetic Medicine (2010). 549-559
- Jui Kun Chiang, Ying Lung Lin, Chi Ling Chen (2013). Reduced risk for Metabolic Syndrome and Insulin Resistance Associated wwith Ovo-Lacto-Vegetarian Behavior in Female Buddhists: A case-control study. Plus one. August 2013. Volume 8. Issue 8.e71799.
- Nico S.Rizzo, Karen Jaceldo Siegl, Joan Sabate (2011). Vegetarian dietary patterns are associated with a lower risk of Metabolic syndrome. Diabetes Care.2011.
- Rauma A, Torronen R, Hanninen O et al. (1995) Anti-oxidant status in long term adherents to a strict uncooked vegan diet. American Journal of Clinical Nutrition 62: 1221–7.
- Reddy S, Sanders T & Obeid O (1994) The influence of maternal vegetarian diet on the essential fatty acid status of the newborn. European Journal of Clinical Nutrition 48: 358–68.
- Riboli E & Lambert R, eds. (2002) Nutrition and Lifestyle: Opportunities for Cancer Prevention. IARC Sci. Publ. No. 156. International Agency for Research on Cancer, Lyon.
- Riboli E & Norat T (2003) Epidemiologic evidence of the protective effect of fruit and vegetables on cancer risk. American Journal of Clinical Nutrition 78 (3 ): 559S–69S.
- Richardson N, Shepherd R & Elliman N (1993) Current attitudes and future influences on meat consumption in the UK. Appetite 12: 41–51.
- Roberts I, West R, Ogilvy D et al. (1979) Malnutrition in infants receiving cult diets: a form of child abuse. British Medical Journal 1:296–8.
- Robinson F (2001) The nutritional contribution of meat to the British diet: recent trends and analysis. Nutrition Bulletin 26 (4): 283–95.
- Rottka H (1990) Health and vegetarian lifestyles. In: NutritionalAdaption to New Lifestyles, (J Somogyi, K Kostin eds), pp. 176–94.Oxford University Press, Oxford.
- Sabate J, Ratzin-Turner R & Brown J (2001) Vegetarian diets: descriptions and trends. In: Vegetarian Nutrition, (J Sabate ed.), pp.3–18. CRC Press, Boca Raton.
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam