RỐI LOẠN LIPID MÁU DO THUỐC
Nguyễn Hải Thủy
DOI: 10.47122/vjde.2021.47.8
TÓM TẮT
Rối loạn lipid máu thứ phát do sử dụng thuốc điều trị thường gặp nhưng thường bị bỏ sót. Thật vậy một số loại thuốc và nhóm thuốc đã được báo cáo là ảnh hưởng đến một số thành phần lipid máu. Các yếu tố nguy cơ bao gồm bệnh nhân tăng lipid máu ban đầu và có nguy cơ cao về tim mạch cao. Điều này cần được xem xét khi đánh giá những bệnh nhân có tăng nồng độ cholesterol toàn phần (TC), cholesterol của lipoprotein tỷ trọng thấp (LDL-C), cholesterol ngoài lipoprotein tỷ trọng cao (Non- HDL-C), triglyceride (TG) và giảm nồng độ cholesterol của lipoprotein mật độ cao (HDL- C). Thuốc tim mạch, thuốc chống loạn thần, thuốc chống co giật, hormone và một số loại thuốc ức chế miễn dịch chỉ là một số loại thuốc thường được biết đến có tác động bất lợi đến nồng độ lipid. Trong một số trường hợp, đây là hiệu ứng nhóm và trong những trường hợp khác, nó có thể phụ thuộc vào liều lượng và loại thuốc cụ thể. Tuy nhiên, điều này chuyển thành nguy cơ bệnh tim mạch xơ vữa động mạch (BTMXV) như thế nào vẫn chưa được biết rõ, vì không có đủ bằng chứng về tác động của những thay đổi chuyển hóa này đối với nguy cơ chung của BTMXV. Phân tích lợi ích- nguy cơ của mỗi phương pháp điều trị liên quan đến tác dụng phụ trên thành phần lipid cần được thực hiện dựa trên các yếu tố của từng bệnh nhân. Nói chung, nếu quan sát thấy những thay đổi bất lợi trong thành phần lipid trong khi điều trị, có thể khuyến cáo thay thế bằng một liệu pháp thay thế tương đương. Nếu không có liệu pháp tương đương và phải bắt đầu điều trị, thì việc theo dõi nồng độ lipid huyết thanh là rất quan trọng.
SUMMARY
Drug – Induced Dyslipidemia
Nguyen Hai Thuy
Hue University of Medicine and Pharmacy
Trường Đại học Y Dược Huế
Dyslipidemia due to medications is common but often overlooked. Several medications and medication classes have been reported to affect the lipid profile. Risk factors include elevated lipid levels at baseline and high cardiovascular risk patients. This should be considered when evaluating patients with elevated levels of total cholesterol (TC), low-density lipoproteins cholesterol (LDL-C), non-high-density lipoprotein cholesterol (Non-HDL-C), triglycerides (TG) and reductions in high- density lipoprotein cholesterol (HDL-C). Cardiovascular medications, antipsychotics, anticonvulsants, hormones and certain immunosuppressives are just some of the more commonly known medications to have a negative impact on lipid levels. In some cases, this is a class effect and in others it might depend on dose and specific drug. However, how this translates to atherosclerotic cardiovascular disease (ASCVD) risk remains unknown, as there is insufficient evidence on the impact of these metabolic changes on overall risk of ASCVD. A thorough risk-benefit analysis of each treatment associated with an adverse effect on the lipid profile should be done based on individual patient factors. In general, if negative changes in the lipid profile are observed during therapy, replacement with an equivalent alternative therapy can be recommended. If no equivalent therapy is available and treatment must be initiated, then monitoring of serum lipid levels is vital.
Keywords: Dyslipidemia, total cholesterol, low-density lipoproteins cholesterol , triglycerides, high-density lipoprotein cholesterol atherosclerotic cardiovascular disease
Chịu trách nhiệm chính: Nguyễn Hải Thủy
Ngày nhận bài: 6/1/2021
Ngày phản biện khoa học: 06/02/2021
Ngày duyệt bài: 29/04/2021
Email: [email protected]
Điện thoại: 0903574457
ĐẶT VẤN ĐỀ
Rối loạn lipid máu là một trong những nguyên nhân chính gây bệnh tim mạch xơ vữa (BTMXV). Bên cạnh rối loạn lipid máu nguyên phát và thứ phát do các bệnh lý nội khoa. Rối loạn lipid máu thứ phát do sử dụng thuốc điều trị thường gặp nhưng thường bị bỏ sót. Các nguyên nhân của rối loạn lipid máu thứ phát rất quan trọng nhằm xác định việc điều trị nguyên nhân cơ bản có thể làm giảm rối loạn lipid máu và cuối cùng làm giảm nhu cầu điều trị bằng thuốc hoặc nhu cầu điều trị bằng thuốc kết hợp.
Một nguyên nhân thứ phát của rối loạn lipid hoặc lipoprotein là do các loại thuốc được sử dụng cho các chỉ định điều trị khác. Nồng độ thành phần lipid trong máu có thể bị ảnh hưởng tăng hay giảm bởi một số loại thuốc. Thuốc có thể ảnh hưởng đến nồng độ lipid trực tiếp hoặc gián tiếp thông qua tác động lên trọng lượng hoặc chuyển hóa glucose. Điều này cần được xem xét khi đánh giá những bệnh nhân có tăng nồng độ cholesterol toàn phần (TC), cholesterol của lipoprotein tỷ trọng thấp (LDL-C), cholesterol ngoài lipoprotein tỷ trọng cao (Non- HDL-C), triglyceride (TG) và giảm cholesterol của lipoprotein tỷ trọng cao (HDL-C).
Nhiều báo cáo ghi nhận một số các loại thuốc gây tăng TG máu nghiêm trọng dẫn đến viêm tụy cấp .Trong khi có rất ít dữ liệu mô tả cơ chế chính xác của viêm tụy cấp do thuốc,
người ta biết rằng tăng TG máu nghiêm trọng (TG > 1000 mg / dl) có thể gây viêm tụy cấp. Do đó, trong trường hợp không có nguyên nhân khác, nguyên nhân do thuốc nên được đánh giá khi có viêm tụy cấp và tăng TG máu nghiêm trọng. Một số loại thuốc và nhóm thuốc đã được báo cáo là ảnh hưởng đến cấu trúc lipid. Trong một số trường hợp, đây là hiệu ứng nhóm và một số trường hợp các tác nhân thuộc cùng một nhóm có thể có tác dụng khác nhau đáng kể đối với mức lipid (ví dụ: thuốc chẹn beta) và các thuốc đồng thời được biết là gây ra bất thường lipid nên được đánh giá để ngừng hoặc giảm liều trước khi bắt đầu dùng thuốc hạ lipid lâu dài. Làm thế nào điều này chuyển thành nguy cơ bệnh tim mạch xơ vữa động mạch (BTMXV) vẫn chưa được biết, vì không có đủ bằng chứng về tác động của những thay đổi chuyển hóa này đối với nguy cơ chung của BTMXV.
1. NHÓM THUỐC TIM MACH
1.1. Thuốc điều trị tăng huyết áp
Có rất nhiều tài liệu cũng như các nghiên cứu liên quan đến tác động của thuốc hạ huyết áp đối với chuyển hóa lipoprotein và vẫn còn nhiều tranh luận tác động về lâu dài thực sự, nếu có, của những thay đổi này trong đó nhóm thuốc lợi tiểu và thuốc chẹn β có nhiều dữ liệu nhất để hỗ trợ các tác động bất lợi của thuốc hạ HA đối với thành phần lipid.
Bảng 1. Thuốc tim mạch ảnh hưởng lên nồng độ lipid máu.
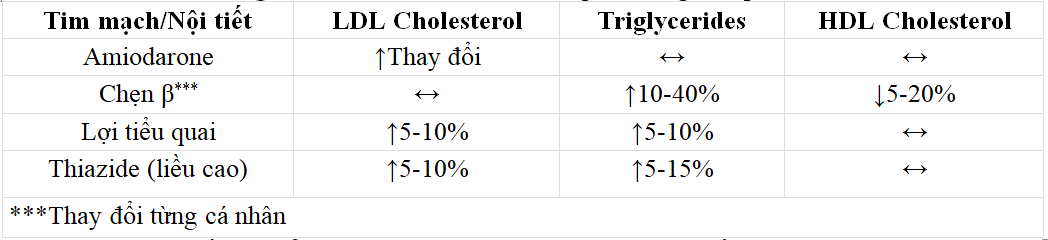
1.1.1. Nhóm thuốc lợi tiểu
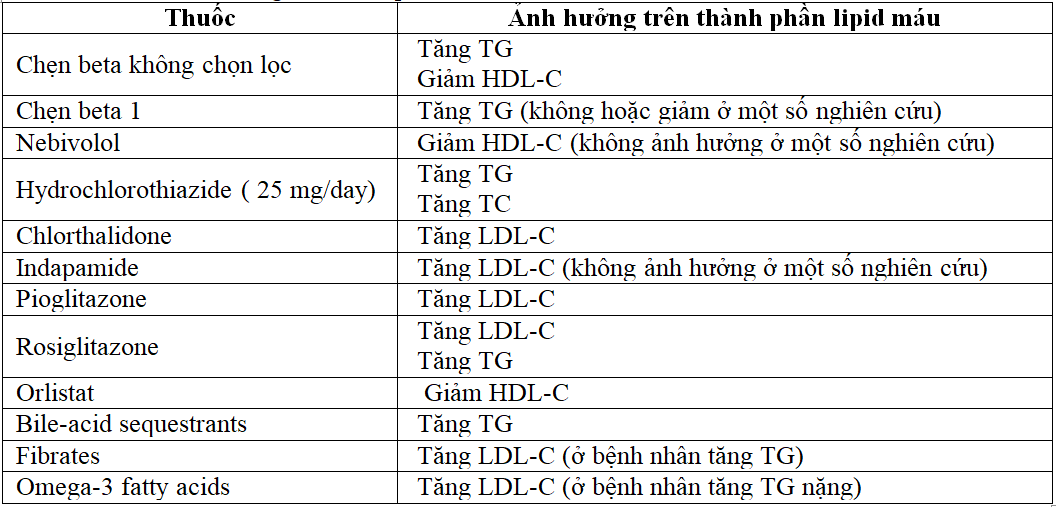
Nhóm Thiazide và thuốc lợi tiểu quai có liên quan đến việc tăng cholesterol huyết tương trong các nghiên cứu trên bệnh nhân THA. Trường Tim mạch Hoa Kỳ/Hiệp hội Tim mạch Hoa Kỳ đã khuyến cáo nhóm lợi tiểu Thiazide là một trong bốn nhóm thuốc cụ thể được coi là liệu pháp ban đầu cho bệnh THA. Theo các khuyến nghị này và việc sử dụng rộng rãi thuốc lợi tiểu, điều quan trọng là phải xem xét lại rối loạn chuyển hóa bất lợi. Sử dụng thuốc lợi tiểu Thiazide liều cao (≥ 50 mg / ngày) có thể ảnh hưởng xấu đến nồng độ lipoprotein, như đã thấy trong các nghiên cứu nhỏ và một số nhà nghiên cứu đã gợi ý rằng do đó, thuốc lợi tiểu có thể làm trầm trọng thêm bệnh mạch vành (BMV). Nồng độ cholesterol toàn phần có thể tăng 4% và nồng độ LDL-C tăng 10%. Nồng độ HDL.C không bị ảnh hưởng, trong khi nồng độ TG tăng lên 5-15% .
Sử dụng Hydrochlorothiazide liều thấp (12,5 – 25 mg/ngày) đã được chứng minh là không ảnh hưởng đến lipid huyết tương ở nam và nữ. Liều lượng dường như là một yếu tố dẫn đến ảnh hưởng nồng độ cholesterol; tuy nhiên, có những dữ liệu mâu thuẫn về việc liệu tác động lên mức lipid chủ yếu do dùng liều cao hơn gây ra.
Tác dụng lâu dài sau một năm vẫn chưa được xác định vì nhiều nghiên cứu gần đây cho thấy tác động là ngắn hạn và mức lipid huyết thanh trở lại mức ban đầu. Ngoài ra, thuốc lợi tiểu thiazide đã được chứng minh là làm giảm nguy cơ biến cố tim mạch mặc dù tác dụng này lên nồng độ các thành phần lipid máu.
Thuốc lợi tiểu quai tương tự cũng làm tăng nồng độ LDL-C và TG với một số nghiên cứu cho thấy những thay đổi ở mức độ tương đương và một số cho thấy tác dụng kém hơn so thuốc lợi tiểu thiazide. Tuy nhiên, tác dụng có vẻ cấp và không được mong đợi trong khoảng thời gian dài hơn thời gian tác dụng của Furosemide (6 đến 8 giờ). Một khả năng khác là các hormone được kích thích để đáp ứng với việc giảm thể tích nội mạch là nguyên nhân gây ra một số thay đổi về nồng độ lipid và lipoprotein. Tác dụng của đơn trị liệu với nhóm thuốc lợi tiểu tiết kiệm kali trên nồng độ lipid phần lớn chưa được rỏ, nhưng sự kết hợp của thuốc lợi tiểu tiết kiệm kali và một Thiazide cho thấy những thay đổi tương tự như đơn trị liệu với thuốc lợi tiểu thiazide, cho thấy không có tác động nào từ thuốc lợi tiểu tiết kiệm kali.
Cơ chế rối loạn lipid máu do thuốc lợi tiểu vẫn chưa rõ. Một giả thuyết cho rằng giảm độ nhạy insulin có thể gây ra sự gia tăng sản xuất cholesterol ở gan. Cơ chế của sự gia tăng TG vẫn chưa được rõ. Gần đây người ta cho rằng chúng có thể điều chỉnh sự biệt hóa tế bào mỡ dẫn đến sự tích tụ TG trong huyết tương ở những bệnh nhân nhạy cảm với đa hình di truyền (genetic polymorphism) cụ thể trong gen NELL1.Người ta cũng cho rằng có sự khác biệt về giới tính, vì thuốc lợi tiểu đã được chứng minh là tạo ra thời hạn ngắn về tăng TC và LDL-C ở phụ nữ sau mãn kinh lớn hơn so với nam giới. Phụ nữ tiền mãn kinh có thể có tác dụng bảo vệ khỏi các estrogen và đã chứng minh không có sự thay đổi về nồng độ lipid. Các estrogen đã được giả thuyết là làm tăng số lượng các vị trí liên kết LDL ở gan và kích thích gan hấp thu Chylomicron tàn dư .
1.1.2. Nhóm thuốc ức chế β
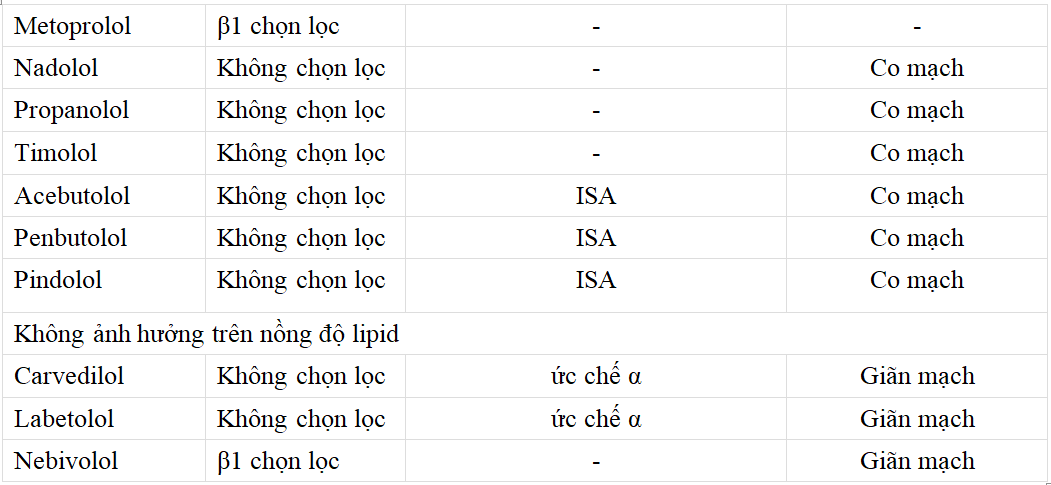
Các tác dụng phụ trên chuyển hóa của thuốc chẹn β phụ thuộc vào liều lượng và từng loại thuốc cụ thể. Trong khi các chất ức chế β có tác dụng không đáng kể trên TC hoặc LDL-C trong huyết thanh, chúng có thể làm tăng nồng độ TG từ 10-40% và giảm nồng độ HDL-C khoảng 5- 20% .Bằng chứng về thời gian tác dụng vẫn còn mâu thuẫn với các nghiên cứu trích dẫn. Các tác dụng kéo dài dưới 1 năm và các nghiên cứu khác báo cáo mức độ tăng lên sau vài năm điều trị. Sự thay đổi nồng độ lipoprotein do thuốc chẹn β dường như không phải là hiệu ứng nhóm, và các tác nhân có hoạt tính giao cảm nội tại (ISA), β1- chọn lọc, hoặc tác dụng giãn mạch (Bảng 2) có liên quan đến tác dụng ít rõ hơn.

Bảng 3. Cơ chế Rối Loạn Lipid máu do nhóm ức chế β

Thuốc chẹn β không chọn lọc gây co mạch ngoại vi thông qua thụ thể β ngoại vi, làm tăng đề kháng insulin, giảm nồng độ HDL-C và tăng TG . Trong khi đó, các tác nhân có tác dụng chọn lọc tim và / hoặc có hoạt động ngăn chặn thụ thể alpha-1-adrenoreceptor dường như không làm tăng đề kháng insulin. Các cơ chế tiềm ẩn khác của sự thay đổi lipid do thuốc chẹn β gây ra là do tăng cân liên quan đến thuốc chẹn β, giảm chuyển hóa lipid do giảm enzym lipoprotein lipase (LPL) ở cơ và rối loạn chức năng nội mô do co mạch ngoại vi (Bảng 3) .
Tác dụng có lợi của Carvedilol so với Metoprolol và Atenolol đối với các chỉ số lipid đã được chứng minh trong một số nghiên cứu . Carvedilol có hoạt tính chẹn thụ thể α-1- adrenoreceptor chọn lọc, gây giãn mạch và giảm đề kháng insulin. Nhưng không rỏ liệu những tác dụng chuyển hóa có lợi này của Carvedilol có được ghi nhận với các thuốc chẹn
beta khác có đặc tính giãn mạch hay không, bao gồm cả Nebivolol. Ngược lại, các chất ức chế α chọn lọc (prazosin) có tác dụng có lợi trên thành phần lipid và đã được chứng minh là làm tăng nồng độ HDL-C và giảm TG.
Thuốc lợi tiểu Thiazide và thuốc chẹn β là những thuốc quan trọng đối với các chỉ định điều trị bệnh tim mạch khác. Thuốc chẹn β có hiệu quả trong việc giảm tỷ lệ mắc và tỷ lệ tử vong do tim mạch trong suy tim sung huyết, BMV và thuốc lợi tiểu rất quan trọng để kiểm soát triệu chứng của nhiều bệnh đi kèm Tim mạch . Mặc dù điều quan trọng là phải đánh giá mức độ tăng lipid do các tác nhân này gây ra, với các chỉ định thuyết phục khác, vẫn cần thận trọng khi tiếp tục dùng chúng trong khi tiếp tục theo dõi nồng độ lipid huyết thanh.
1.2. Thuốc tim mạch khác
1.2.1. Amiodarone
Amiodarone, một loại thuốc chống loạn nhịp tim tác dụng mạnh, làm tăng nồng độ cholesterol trong huyết tương, được báo cáo trong một số các trường hợp. Amiodarone làm tăng nồng độ LDL-C do giảm biểu hiện của gen của thụ thể LDL.
Ngoài ra, Amiodarone gây suy giáp có thể gây ra những thay đổi trong chuyển hóa lipid vì suy giáp là một trong những nguyên nhân phổ biến nhất của tăng lipid máu thứ phát. Lượng Iode chứa trong Amiodarone khoảng 40% và có thể gây ra cường giáp hoặc suy giáp.
Nghiên cứu chứng minh rằng điều trị Amiodarone lâu dài làm tăng cholesterol huyết tương phụ thuộc vào liều lượng, một phần do thiếu hụt hormone tuyến giáp và giảm số lượng các thụ thể LDL.
Bảng 4. Rối loạn lipid máu với nhóm thuốc dự phòng và bảo vệ bệnh tim mạch (Konstantinos Tziomalos và cộng sự. The Open Cardiovascular Medicine Journal, 2011, 5, 85-89 )
2. THUỐC ĐIỀU TRỊ BỆNH ĐÁI THÁO ĐƯỜNG
Nhóm ức chế đồng vận chuyển Natri- Glucose 2 (SGLT2)
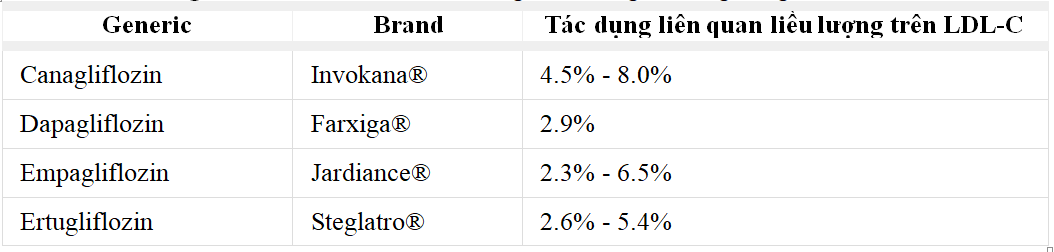
Các nhóm ức chế SGLT2 làm giảm glucose trong máu và HbA1c thông qua việc ức chế SGLT2 ở ống lượn gần, do đó ngăn chặn tái hấp thu glucose và tăng bài tiết glucose ở thận. Hiện có bốn loại ức chế SGLT2 và được chấp thuận để điều trị bệnh đái tháo đường típ 2 (Bảng 4).
Ngoài tác dụng hạ glucose, các chất ức chế SGLT2 đã được chứng minh là có tác động tích cực đến các thông số chuyển hóa khác, bao gồm cả trọng lượng cơ thể và huyết áp. Mặc dù dữ liệu hỗn hợp và các tác nhân riêng lẻ dường như ảnh hưởng đến thành phần lipid ở một mức độ khác nhau, những tác nhân này đã cho thấy làm tăng nồng độ LDL-C đồng thời làm tăng
HDL-C với các tác động khác nhau (giảm hoặc không ảnh hưởng) trên TG (Bảng 4) .
Trong khi việc giảm trọng lượng có thể giải thích những tác động có lợi được thấy trên HDL-C và TG, vẫn chưa rõ cơ chế đằng sau của sự gia tăng LDL-C theo liều lượng .
Một khả năng là chất ức chế SGLT2 gây ra sự chuyển sử dụng từ Carbohydrate sang sử dụng lipid gây ra sự gia tăng nồng độ axit béo trong gan để tạo ra ceton và nồng độ cholesterol tại gan. Tác động của vấn đề này đến sức khỏe tim mạch là không chắc chắn.
Cho đến nay, Canagliflozin và Empagliflozin đã chứng minh sự cải thiện kết quả Tim mạch (tổng hợp về tử vong do Tim mạch, nhồi máu cơ tim không tử vong hoặc đột quỵ không tử vong) và giảm số lần nhập viện do suy tim ở những đối tượng có nguy cơ tim mạch cao.
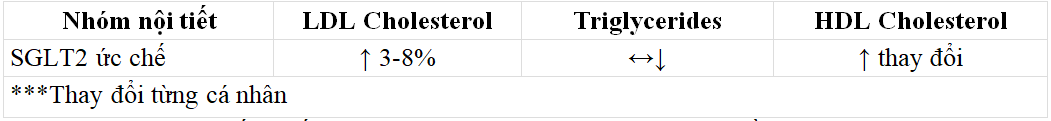
Bảng 5. Ức chế SGLT2 và tác dụng của chúng tên tăng nồng độ LDL.C.
3. HORMON STEROID Estrogen và Progestin
Estrogen dạng đường uống đã được chứng minh là chất điều hòa quan trọng của quá trình chuyển hóa lipid. Phụ nữ mãn kinh được bảo vệ bệnh mạch vành, tăng huyết áp, ĐTĐ và rối loạn lipid máu. Điều này dường như là do các estrogen có tác dụng bảo vệ, vì các estrogen không được sử dụng sẽ ảnh hưởng có lợi đến thành phần lipid. Chúng làm giảm nồng độ TC (2-10%) và LDL-C (7-20%) và tăng nồng độ HDL-C (5-20%) liên quan đến liều lượng. Các nghiên cứu cũng cho thấy sự giảm nồng độ Lipoprotein (a), là một yếu tố nguy cơ độc lập đối với bệnh mạch vành, với cả liệu pháp estrogen và progestin. Tuy nhiên, chúng cũng làm tăng nồng độ TG lên đến 40% và có thể làm tăng nguy cơ viêm tụy ở phụ nữ bị tăng triglycerid máu quá mức.Ethinyl-estradiol có tác dụng rõ rệt hơn trên lipoprotein so với estradiol tự nhiên. Liệu pháp estrogen đường uống làm tăng nồng độ TG trong huyết tương bằng cách tăng sản xuất lipoprotein tỷ trọng rất thấp (VLDL), làm giảm nồng độ của enzyme lipoprotein lipase (LPL) và lipase gan, dẫn đến giảm sự thanh thải TG, và có khả năng thông qua sự thay đổi trong kháng insulin. Nồng độ TG thay đổi theo thời gian ở những phụ nữ đang áp dụng chế độ hormon theo chu kỳ và người ta cho rằng sự gia tăng được tăng cường ở những phụ nữ đã có tăng TG máu từ trước. Tuy nhiên sự gia tăng TG thường không được quan sát thấy khi sử dụng Estrogen qua da, vì việc sử dụng qua da được cho là làm giảm tác dụng vượt qua đầu tiên của gan và giảm tác động lên tổng hợp protein ở gan.
Progestin đối kháng với những thay đổi lipid do estrogen gây ra, và có thể có tác động xấu đến nồng độ TC và HDL-C. Nồng độ lipid máu phụ thuộc vào tác dụng androgen của progestin. Progestin có nhiều tác dụng androgen hơn, chẳng hạn như levonorgestrel, được cho là có tác động lớn hơn đến nồng độ lipid so với những loại có ít tác dụng androgen hơn. Mới hơn, progestin “thế hệ thứ ba” (desogestrel, Pregodene) với độ đặc hiệu cao hơn đã được phát triển để giảm nguy cơ này và đã chứng minh tác dụng có lợi trên nồng độ LDL-C và HDL-C nhưng chúng cũng có thể làm tăng TG.
Vẫn chưa đủ bằng chứng cho thấy các tác nhân thế hệ thứ ba làm giảm nguy cơ mắc bệnh tim mạch xơ vữa. Ngoài ra, trong những năm gần đây, liều Ethinyl estradiol đã được giảm từ 50 xuống chỉ còn 20-30 mcg trong các công thức hiện tại, để giảm những thay đổi bất lợi về chuyển hóa. Do đó, tác dụng của thuốc tránh thai khác nhau tùy theo hàm lượng Estrogen và Progestin của chúng và cụ thể hơn là hiệu lực của estrogen và khả năng tạo androgen (adrogenicity) của progestin.
Các thuốc điều hòa thụ thể estrogen có chọn lọc (SERMs), bao gồm Raloxifene và Tamoxifen, dường như ít ảnh hưởng đến thành phần lipid hơn, nhưng vẫn có thể làm tăng nồng độ TG. Đã có một số báo cáo trường hợp trong tài liệu mô tả tăng triglycerid máu do Tamoxifen gây ra viêm tụy cấp. Hiệp hội Tim mạch Hoa Kỳ khuyến cáo rằng các chế phẩm có chứa estrogen thấp hơn hoặc các hình thức tránh thai khác nên được xem xét ở những phụ nữ bị tăng triglycerid máu trong khi điều trị.
Phụ nữ mãn kinh bị tăng Triglycerid máu cần điều trị bằng hormon được khuyến cáo chuyển sang các chế phẩm qua đường da. Không rõ liệu việc sử dụng qua da có ảnh hưởng đến kết quả tim mạch hay không. Ngoài ra, nên sử dụng thuốc tránh thai với liều lượng thấp estrogen ở phụ nữ bị rối loạn lipid máu có kiểm soát, vì các nghiên cứu về thuốc tránh thai liều thấp ba lần không dẫn đến thay đổi đáng kể hoặc chỉ tăng nhẹ ở mức TC, LDL-C và TG. Các biện pháp tránh thai có thể được xem xét cho những phụ nữ có mức LDL-C không kiểm soát được hoặc có nhiều yếu tố nguy cơ tim mạch, bao gồm sử dụng progestin không chứa androgen hoặc kháng androgen vì chúng có ảnh hưởng tối thiểu đến thành phần lipid máu.
Ở phụ nữ sau mãn kinh, liệu pháp hormone với estrogen đơn độc hoặc estrogen kết hợp với progestin được sử dụng để điều trị chứng bốc hỏa và các triệu chứng mãn kinh khác. Tương tự như các nghiên cứu đánh giá thuốc tránh thai, estrogen đường uống cũng đã được chứng minh là làm gia tăng nồng độ HDL-C và TG, và giảm LDL-C. Các chế độ điều trị thay thế hormone kết hợp có tác động tương tự đối với nồng độ TC và LDL-C như estrogen. Các nghiên cứu đã chỉ ra rằng estrogen sử dụng có lợi hơn trên HDL-C so với kết hợp estrogen và progestin nhưng cả hai đều làm giảm LDL-C và tăng TG tương tự ở phụ nữ sau mãn kinh. Có bằng chứng mâu thuẫn nếu liệu pháp thay thế hormone có liên quan đến tác dụng bảo vệ tim mạch ở phụ nữ sau mãn kinh và hơn thế nữa dữ liệu gần đây từ một đánh giá hệ thống đã chứng minh rằng estrogen chỉ làm tăng nguy cơ đột quỵ (RR 1,34; KTC 95% 1,07 đến 1,68) và huyết khối tĩnh mạch (RR 1,32; KTC 95% 1 đến 1,74), và không có sự khác biệt đáng kể so với Giả dược có nguy cơ biến cố mạch vành. Liệu pháp hormone kết hợp so với giả dược cho thấy sự gia tăng đáng kể các biến cố mạch vành (RR 1,89; KTC 95% 1,15 đến 3,1), đột quỵ (RR 1,38; 95% CI 1,08-1,75), và huyết khối tĩnh mạch (RR 4,28; 95% FI 2,49 đến 7,34) .
Dữ liệu cũng chỉ ra rằng tác động của liệu pháp hormone đối với kết quả tim mạch bị ảnh hưởng bởi tuổi tác và thời gian kể từ khi bắt đầu mãn kinh và estrogen có thể làm chậm giai đoạn đầu của chứng xơ vữa động mạch và có tác dụng thuận lợi hơn ở những phụ nữ bắt đầu mãn kinh gần đây. Dữ liệu dài hạn cho thấy liệu pháp hormone có thể có tác động có hại đối với nguy cơ bệnh tim mạch ở phụ nữ lớn tuổi và kết quả ở phụ nữ trẻ vẫn chưa thể kết luận. Tại thời điểm này, điều trị với mục đích phòng ngừa bệnh tim mạch vành hoặc phòng bệnh mãn tính không được khuyến khích. Đối với phụ nữ sau mãn kinh, nên dùng liệu pháp ngắn hạn với liều thấp nhất có hiệu quả. Đối với những người bị tăng TG máu, sử dụng estrogen qua da có thể là một lựa chọn thay thế ưu tiên cho đường uống.
Bảng 6. Hormon steroid và steroid đồng hóa
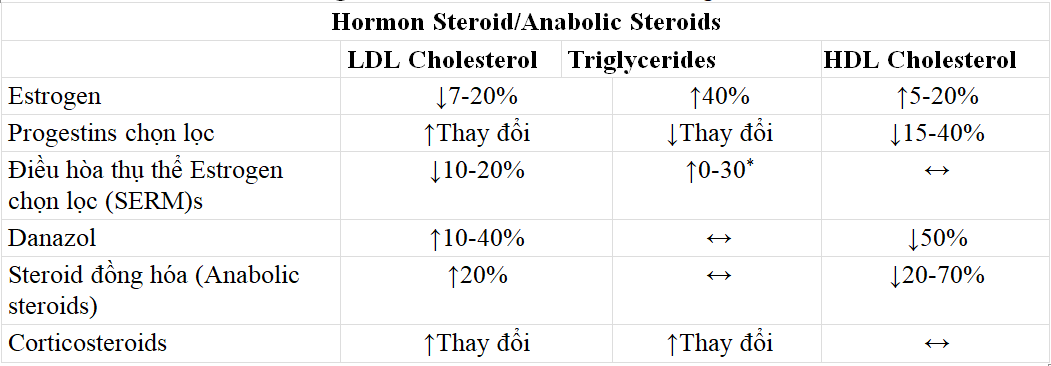
*Raloxifene không tăng Triglyceride, ghi nhận tăng 30% với Tamoxifen
4. NHÓM STEROID
4.1. Danazol
Danazol một androgen tương tự như testosterone. Đây là một loại steroid tổng hợp được chỉ định cho bệnh lạc nội mạc tử cung và bệnh xơ nang vú cũng như để dự phòng ở những bệnh nhân bị phù mạch di truyền (hereditary angioedema ). Một đánh giá về dữ liệu điều trị lạc nội mạc tử cung cho thấy điều trị bằng Danazol có thể làm giảm nhanh HDL- C đến 50% và tăng LDL-C từ 10-40% Tuy nhiên, các nồng độ này trở lại nồng độ cơ bản sau khi ngừng điều trị và chỉ có một mối lo ngại khi điều trị kéo dài từ 12 tháng trở lên hoặc ở những bệnh nhân có nguy cơ cao của bệnh tim mạch Tác dụng này đã nhất quán trong các tài liệu là cơ chế có thể là do tác động của nó lên lipase gan, thụ thể LDL và hoạt động của lecithin cholesterol acyl transferase (LCAT) . Dữ liệu cũng hỗ trợ sự thay đổi nồng độ lipoprotein ở phụ nữ được điều trị lạc nội mạc tử cung, nhưng có thể không có tác dụng trong việc điều trị phù mạch di truyền . Một số giải thích có thể cho sự khác biệt này là liều điều trị phù mạch di truyền thấp hơn liều được sử dụng để điều trị lạc nội mạc tử cung, thời gian liệu pháp điều trị dài hơn và thường suốt đời so với 2-6 tháng đối với lạc nội mạc tử cung và nam giới cũng được điều trị phù mạch di truyền. Một thử nghiệm ngẫu nhiên đã đánh giá Danazol trên nồng độ HDL-C ở những người tình nguyện khỏe mạnh và bệnh nhân bị phù mạch di truyền. Bệnh nhân bị bệnh tim mạch hoặc các yếu tố nguy cơ bệnh tim mạch đã được loại trừ trong nghiên cứu tình nguyện viên khỏe mạnh. Sử dụng ngắn hạn ở những người khỏe mạnh (n = 15) cho thấy nồng độ HDL-C giảm 23%; tuy nhiên, chúng trở về bình thường sau 4 tuần . Không thấy có tác dụng lên LDL-C hoặc TG. Sử dụng lâu dài ở bệnh nhân phù mạch di truyền dường như không làm giảm HDL-C so với nhóm chứng.Nghiên cứu này cũng cố về sự khác biệt trong quần thể nghiên cứu cũng như thời gian và liều lượng Danazol khác nhau ảnh hưởng đến tác động của Danazol đối với thành phần lipid. Tuy nhiên, các nghiên cứu khác đã cho thấy các kết quả trái ngược nhau và cũng chứng
minh sự giảm HDL-C (cũng như apolipoprotein Apo AI; thành phần chính của hạt HDL) và tăng LDL.C khi sử dụng lâu dài để ngăn ngừa phù mạch di truyền, tác động tiêu cực này không được chứng minh là làm tăng nguy cơ xơ vữa động mạch.
4.2. Androgen
Tương tự, các nghiên cứu trên vận động viên thể hình và tập tạ bằng cách sử dụng steroid đồng hóa đã cho thấy việc giảm nồng độ HDL-C từ 20-70% kèm theo giảm nồng độ apo AI, cũng như tăng nồng độ LDL-C khoảng 20% . Steriod tăng đồng hóa (Anabolic steroid) ở các vận động viên thể lực trước đây có liên quan đến các biến cố tim mạch, một phần có thể là do tác dụng phụ của lipid liên quan đến việc sử dụng chúng. Một nghiên cứu nhỏ đã xác nhận rằng việc tự sử dụng steroid đồng hóa tạo ra các tác động bất lợi lên thành phần lipid và lipoprotein, bao gồm giảm nồng độ HDL-C trong huyết thanh và nồng độ Apo-A1. LDL-C có thể tăng lên thông qua cảm ứng enzyme hepatic triglyceride lipase ở gan và dị hóa VLDL. Thông qua quá trình này, nồng độ HDL-C trong huyết thanh cũng giảm xuống.
Một tài liệu gần đây hơn đã mô tả 49 báo cáo về 1.467 vận động viên sử dụng steroid đồng hóa-androgen chứng thực mối liên kết và báo cáo rằng những thay đổi này có thể xảy ra trong vòng 9 tuần kể từ khi dùng thuốc và các tác dụng dường như có thể đảo ngược và bình thường hóa trong vòng 5 tháng sau khi ngừng sử dụng. bằng chứng dựa trên các nghiên cứu nhỏ, quan sát hoặc các báo cáo trường hợp đơn lẻ và có thể phản ánh sự sai lệch đáng kể về công bố.
Tuy nhiên, việc sử dụng steroid đồng hóa- androgen cũng có liên quan đến tăng huyết áp, phì đại thất trái, nhồi máu cơ tim cấp và đột tử và nhận thức về những tác dụng phụ tiềm ẩn này có thể có lợi cho các vận động viên và tăng khả năng nhận biết những người trẻ khỏe mạnh có bất thường tim mạch .
Liệu pháp ức chế androgen (Androgen deprivation therapy ) là liệu pháp hormone được sử dụng để điều trị ung thư tuyến tiền liệt và có liên quan đến nhiều tác dụng không mong muốn về chuyển hóa, bao gồm cả sự thay đổi lipid. Điều này có thể được thực hiện bằng cách phẫu thuật thiến hoặc điều trị nội khoa với chất chủ vận hormone giải phóng gonadotropin (GnRH) (còn được gọi là chất chủ vận hormone giải phóng hormone luteinizing (LHRH)). Những tác nhân này có thể gây ra những thay đổi về mức độ lipid, bao gồm tăng TC, TG và HDL-C.Các nghiên cứu đã chỉ ra những thay đổi khác nhau về LDL-C; với một số cho thấy sự gia tăng và những người khác không có thay đổi đáng kể. Các nghiên cứu nhỏ đã chứng minh sự gia tăng TGs lên đến 25% và HDL-C tăng lên đến 11%. Hơn nữa, một nghiên cứu dài hạn hơn 1 năm đã quan sát thấy những thay đổi này không kéo dài sau 6 tháng. Mặc dù Liệu pháp loại bỏ androgen có thể làm tăng nguy cơ thay đổi lipid cũng như béo phì và kháng insulin, các nghiên cứu cũng đã đánh giá tác động của ADT đối với bệnh CV và quan sát Các nghiên cứu đã gợi ý mối liên hệ giữa ADT và nguy cơ mắc bệnh CV cao hơn. Một giải thích cho mối liên quan này là Liệu pháp loại bỏ androgen can thiệp vào đặc tính bảo vệ tim mạch của testosterone và do đó, làm tăng nguy cơ xảy ra các tác dụng phụ. Năm 2010, FDA đã phát hành một thông tin liên lạc về an toàn thuốc thông báo về sự gia tăng nguy cơ mắc bệnh tiểu đường và một số bệnh CV (đau tim, đột tử do tim, đột quỵ) ở nam giới dùng thuốc chủ vận GnRH để điều trị ung thư tuyến tiền liệt dựa trên đánh giá của họ về một số nghiên cứu đã được công bố .Tuy nhiên, điều này chủ yếu dựa trên các nghiên cứu quan sát nhỏ và RCT vẫn mâu thuẫn về mối quan hệ này, như đã thấy trong một phân tích tổng hợp gần đây về các thử nghiệm ngẫu nhiên.
Các sản phẩm thay thế testosterone được chấp thuận cho những nam giới có nồng độ testosterone thấp do các bệnh lý khác nhau gây ra. Tuy nhiên, việc sử dụng liệu pháp testosterone đang gia tăng, bao gồm cả đối với những nam giới có nồng độ testosterone thấp chỉ đơn giản là do lão hóa. Các nghiên cứu gần đây đã chỉ ra rằng nguy cơ NMCT và các biến cố liên quan đến TM khác có thể tăng lên khi sử dụng liệu pháp testosterone và liệu pháp testosterone đó nên tránh ở một số bệnh nhân có nguy cơ cao. Tuy nhiên, hầu hết dữ liệu vẫn mang tính chất quan sát và nhiều báo cáo kết quả mâu thuẫn. Cần có thêm nghiên cứu để làm rõ mối liên quan này . Nếu điều trị bằng testosterone làm tăng sự phát triển của bệnh tim mạch xơ vữa một cơ chế tiềm ẩn là thông qua tác dụng phụ lên lipid huyết thanh và nồng độ apolipoprotein. Tuy nhiên, các nghiên cứu cho đến nay đã không chứng minh được ảnh hưởng đáng kể đến thành phần lipid hoặc lipoprotein, có thể làm giảm nhẹ HDL-C xảy ra do những thay đổi trong thành phần lipoprotein HDL.
5. HORMONE TĂNG TRƯỞNG
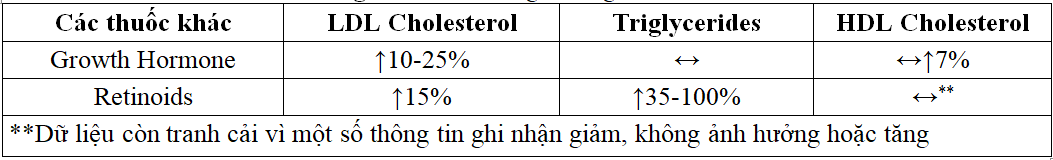
Người lớn bị thiếu hụt hormone tăng trưởng thường có bất thường về lipid, giảm độ nhạy insulin và tăng tỷ lệ mắc bệnh và tử vong do tim mạch. Điều trị bằng hormone tăng trưởng tái tổ hợp ở người, hoặc somatropin, cho người lớn bị thiếu hụt hormone tăng trưởng đã góp phần làm thay đổi thành phần lipid bao gồm giảm nồng độ TC và LDL-C từ 10-25% .Dường như không có ảnh hưởng đáng kể đến mức TG và dữ liệu mâu thuẫn về những thay đổi trong HDL-C, với hầu hết các nghiên cứu chứng minh sự gia tăng HDL-C trong huyết thanh Ngược lại, các nghiên cứu cho thấy không có ảnh hưởng đến HDL-C, cũng như giảm khoảng 20% đã được báo cáo. Một số dữ liệu cho thấy phản ứng của cá nhân đối với hormone tăng trưởng về chuyển hóa lipid bị ảnh hưởng một phần bởi tính đa hình di truyền trong các gen liên quan đến chuyển hóa lipid.
Một số nghiên cứu gần đây báo cáo tác động của 15 năm thay thế hormone tăng trưởng ở
156 người lớn bị thiếu hụt hormone tăng trưởng. Sau khi điều trị kéo dài, nồng độ TC và LDL-C trong huyết thanh đã giảm; với sự gia tăng tương ứng trong HDL-C (p <0,001 cho tất cả các mức cơ bản so với mức cơ bản). Không có thay đổi đáng kể về nồng độ TG huyết thanh. Nghiên cứu quan sát kéo dài này chứng minh rằng điều trị thiếu hụt hormone tăng trưởng ở người lớn dẫn đến những cải thiện bền vững trong thành phần lipid huyết thanh. Điều này có thể là do sự cải thiện trong thành phần cơ thể hoặc ảnh hưởng trực tiếp đến chuyển hóa lipid. Các nghiên cứu cho thấy rằng hormone tăng trưởng có thể làm tăng sự biểu hiện của các thụ thể LDL, cải thiện sự dị hóa của LDL, tăng tốc độ luân chuyển LDL và tăng tốc độ luân chuyển apo B-100. Tuy nhiên, bằng chứng cho thấy những cải thiện này dẫn đến giảm tỷ lệ tử vong do BTMXV vẫn chưa được biết.
Bảng 7. Hormon tăng trưởng và Retinoid
6. RETINOIDS
Retinoids là chất tương tự tổng hợp của Vitamin A có hiệu quả trong việc điều trị bệnh vẩy nến, mụn trứng cá nặng và các rối loạn da liên quan khác do quá trình sừng hóa bất thường. Isotretinoin dạng uống lần đầu tiên được báo cáo là gây tăng TG máu; rất có thể do giảm độ thanh thải của các phần tử VLDL, cản trở quá trình phân giải lipid qua trung gian lipoprotein lipase. Retinoids cũng đã được chứng minh là làm tăng nồng độ apo C-III trong huyết tương bằng cách tăng hoạt động phiên mã của apo C-III ở người. gen thông qua thụ thể retinoid X (RXR), cuối cùng góp phần vào sự phát triển của tăng TG máu. Isotretinoin đã được dùng để điều trị hiệu quả cho mụn trứng cá nốt nặng không đáp ứng với liệu pháp thông thường, bao gồm cả kháng sinh toàn thân. Tuy nhiên, nó đã được báo cáo là gây ra nhiều tác dụng ngoại ý với một số hậu quả nghiêm trọng tiềm ẩn, bao gồm cả báo cáo trường hợp viêm tụy.
Bệnh nhân có nồng độ TG tăng cao đáng kể có nhiều khả năng bị viêm tụy và do đó, những bệnh nhân có tăng TG máu từ trước nên tránh sử dụng hoặc điều trị bằng retinoid hết sức thận trọng cho đến khi mức TG có thể được kiểm soát tốt hơn.
Ngoài ra, nên thu thập lipid ban đầu ở tất cả bệnh nhân và kiểm tra nồng độ TG ít nhất một lần sau bốn tuần điều trị. Những bệnh nhân có nguy cơ cao bị tăng TG máu nên được theo dõi thường xuyên hơn. Các nghiên cứu với isotretinoin đã chứng minh sự gia tăng VLDL- C, TG, LDL-C và TC với sự giảm nhẹ HDL-C . Một nghiên cứu đã đánh giá nguy cơ tiếp theo trong bệnh tim mạch xơ vữa ở 104 nam
giới và phụ nữ sử dụng isotretinoin đối với mụn trứng cá nặng bằng cách sử dụng tỷ lệ TC/HDL-C. Kết quả cho thấy ở những người khỏe mạnh, những thay đổi trong chuyển hóa lipid không ảnh hưởng đáng kể đến nguy cơ tổng thể của bệnh tim mạch xơ vữa
7. CHỐNG CHỐNG LOẠN THẦN (ANTIPSYCHOTICS)
Các thuốc chống loạn thần có thể có hiệu quả cao trong việc kiểm soát các bệnh tâm thần. Tuy nhiên, một số tác dụng phụ này cũng liên quan đến các tác dụng ngoại ý về chuyển hóa có thể làm tăng nguy cơ mắc bệnh tim mạch xơ vữa. Một tác dụng ngoại ý như vậy bao gồm rối loạn lipid máu, chủ yếu tăng nồng độ TG.
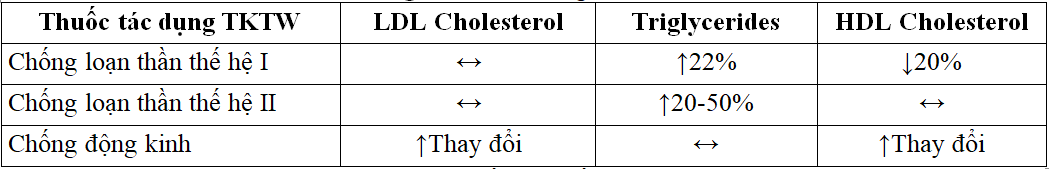
Phenothiazin, là thuốc chống loạn thần thế hệ đầu tiên hoặc thuốc chống loạn thần ‘điển hình’, được phát hiện làm tăng nồng độ TG và TC trong huyết thanh ngay sau khi được phê duyệt, với tác động lớn hơn đến nồng độ TG. Các nghiên cứu đã cho thấy sự gia tăng lên đến 22% sau một năm điều trị bằng chlorpromazine. Các nghiên cứu khác đã quan sát thấy các tác dụng tương tự với trifluronated phenothiazines và haloperidol. Các tác dụng phụ hạn chế chính của thuốc chống loạn thần thế hệ đầu là các triệu chứng ngoại tháp và các rối loạn vận động khác do các thụ thể dopamine D2 có ái lực cao của chúng. Tuy nhiên, khả năng những loại thuốc này cũng góp phần vào bất thường lipoprotein nên được xem xét ở những bệnh nhân bị rối loạn lipid máu hoặc nguy cơ mắc bệnh tim mạch cao
Thế hệ thứ hai, hoặc thuốc chống loạn thần ‘không điển hình’ sau đó đã được phát triển để giảm tỷ lệ tái phát và các tác dụng phụ. So với thuốc chống loạn thần thế hệ đầu tiên, chúng có ái lực thấp hơn với các thụ thể D2 và thay vào đó hoạt động cụ thể là trên serotonin và norepinephrine. Chúng đã trở thành phương pháp điều trị đầu tiên do giảm nguy cơ xuất hiện các triệu chứng ngoại tháp. Tuy nhiên, các tác dụng phụ về chuyển hóa bao gồm tăng nồng độ TG huyết thanh cũng như tăng nhẹ TC, cũng đã được chứng minh khi sử dụng thuốc chống loạn thần thế hệ thứ hai. Một số nghiên cứu cho rằng đây là kết quả của việc tăng mức leptin; một hormone tế bào mỡ tương ứng với sự giảm tổng hợp axit béo và TG và tăng quá trình oxy hóa lipid. Có nhiều cơ chế khác có thể gây ra tăng lipid máu do thuốc và cơ chế chính xác chưa được hiểu đầy đủ. Clozapine, một loại thuốc chống loạn thần thế hệ thứ hai, là tác nhân đầu tiên được chứng minh là làm tăng nồng độ TG huyết thanh. Một nghiên cứu hồi cứu đã xem xét các bệnh nhân dùng clozapine và phát hiện ra rằng nam giới dùng clozapine có mức tăng TG trung bình 48,13% và nữ giới là 35,38% và có một mức đáng kể tương tác giữa thuốc và giới tính theo thời gian (p <0,05) .Ngoài ra, tăng cân là một tác dụng phụ thường gặp của việc sử dụng thuốc chống loạn thần không điển hình, cũng có thể dẫn đến tăng cả mức leptin và TG. Tác động ngăn chặn thụ thể 5-HT2c và / hoặc đối kháng histamine của những thuốc này là một nguyên nhân có thể tăng cân liên quan. Một nghiên cứu đã chứng minh sự gia tăng đáng kể về trọng lượng và nồng độ TG và leptin trong huyết thanh với olanzapine và clozapine, với những thay đổi tối thiểu và vừa phải ở những người sử dụng Risperidone và Quetiapine, tương ứng. Tuy nhiên, đây là một nghiên cứu nhỏ (n = 56) . Điều này phù hợp với các bằng chứng tổng thể và dường như clozapine và olanzapine có ảnh hưởng lớn nhất đến nguy cơ tăng lipid máu, sau đó là Quietapine. Risperidone, Ziprasidone và Ripiprazole có nguy cơ tăng lipid máu tương đối thấp khi sử dụng chúng.
Vì việc tiếp cận với chăm sóc tổng quát và phòng ngừa vẫn còn là một hạn chế đối với quần thể bệnh nhân tâm thần phân liệt, những tác dụng phụ này có thể là mối quan tâm lớn đối với một dân số đã có nhiều nguy cơ mắc các biến chứng tim mạch.
Do đó, kiểm tra nồng độ lipid ban đầu và sàng lọc trong thời gian điều trị có thể cần thiết ở những bệnh nhân đang điều trị bằng thuốc chống loạn thần không điển hình. Nếu một bệnh nhân phát triển nồng độ TG hoặc rối loạn lipid máu cao, họ nên được điều trị bằng liệu pháp hạ lipid máu hoặc nếu có thể, chuyển sang một chất ít gây khó chịu hơn.
8. THUỐC CHỐNG ĐỘNG KINH
Những thay đổi về nồng độ lipid huyết thanh đã được báo cáo khi sử dụng nhiều loại thuốc chống động kinh khác nhau với sự thay đổi và không thống nhất trong y văn. Một số nghiên cứu quan sát đã báo cáo nồng độ LDL- C và HDL-C tăng cao trong khi những nghiên cứu khác không cho thấy tác dụng đáng kể. Nồng độ TG không bị ảnh hưởng bởi việc điều trị bằng thuốc chống động kinh. Vì hầu hết các loại thuốc chống động kinh gây ra các enzym cytochrom P450 (CYP) ở gan, người ta cho rằng sự cạnh tranh giữa thuốc và cholesterol đối với enzym xảy ra dẫn đến giảm sự phân hủy cholesterol thành axit mật và tăng TC. Sự mâu thuẫn này đã được ghi nhận trong nghiên cứu ở cả người lớn và trẻ em bị động kinh và có vẻ như có sự khác biệt dựa trên loại thuốc chống động kinh được sử dụng. Ngoài ra, ảnh hưởng của liệu pháp đối với sự phát triển của xơ vữa động mạch vẫn còn đang tranh cãi.
Bệnh động kinh thường cần điều trị suốt đời và việc sử dụng lâu dài một số loại thuốc chống động kinh (AED) có liên quan đến tác dụng phụ chuyển hóa do rối loạn chức năng của thành mạch. Đặc biệt, Carbamazepine và Phenobarbital đã được chứng minh là gây ra những thay đổi trong cấu trúc lipid. Ở trẻ em và thanh thiếu niên bị động kinh, Carbamazepine đã chứng minh sự gia tăng TC và LDL-C, trong khi một số nghiên cứu cá nhân cũng cho thấy sự gia tăng HDL-C cũng như mức TG. Điều trị chứng động kinh ở trẻ em bằng Phenobarbital cũng đã cho thấy tăng TC, LDL-C và HDL-C, cũng như nồng độ TG thấp hơn. Axit valproic dường như có ít ảnh hưởng, hoặc thậm chí có tác động nhẹ lên thành phần lipid.
Bảng 8. Thuốc chống loạn thần
Bảng 9. Thuốc ức chế miễn dịch

9. Thuốc ức chế Miễn dịch Corticosteroid
Hội chưng tăng Glucocorticoid mạn tính đã xác nhận là nguyên nhân thứ phát của rối loạn lipid máu, nhưng mức độ bất thường về lipid trong các bệnh cảnh lâm sàng là rất khác nhau và các nghiên cứu vẫn còn mâu thuẫn và không thống nhất. Nghiên cứu quan sát về điều trị steroid ở bệnh nhân hen phế quản, viêm khớp dạng thấp, hoặc rối loạn mô liên kết cho thấy sự gia tăng nồng độ TC, LDL-C và TG huyết thanh.. Đây là tất cả các bệnh có thể cần điều trị lâu dài bằng corticosteroid. Tuy nhiên, một cuộc khảo sát lớn cho thấy không có mối liên quan nào với thành phần lipid bất lợi và việc sử dụng glucocorticoid.
Một nghiên cứu cho thấy phụ nữ tiền mãn kinh sử dụng corticosteroid trong thời gian trung bình 3,1 năm có sự gia tăng đáng kể trong TC và giảm HDL-C. Ngược lại, một nghiên cứu ở bệnh nhân nữ bị hen phế quản ghi nhận sự gia tăng đáng kể TG huyết thanh nhưng không có thay đổi về TC.
Cơ chế tiềm ẩn của tác động lên thành phần lipid là đa yếu tố. Một giả thuyết cho sự gia tăng TG này là do sự phân bố lại chất mỡ trong cơ thể gây ra bởi điều trị bằng glucocorticosteroid cho phần thân trên và khuôn mặt với sự mất chất mỡ ở các chi dẫn đến các tế bào có ít thụ thể glucocorticoid hơn ngoài sự kích thích của cả quá trình phân giải lipid và tạo mỡ.
Điều này dẫn đến ảnh hưởng đến việc vận chuyển glucose trong các tế bào có ít thụ thể hơn, dẫn đến sự tích tụ glucose và TG thứ phát do tăng nồng độ insulin.
Đề kháng insulin cũng đóng một vai trò trong các bất thường về lipid. Tại gan, glucocorticoid gây tăng đường huyết, tăng sản xuất VLDL, tăng cường tạo lipid ở gan và ức chế quá trình β-oxy hóa acid béo. Hơn nữa, chúng làm tăng tổng hợp và bài tiết apolipoprotein AI.
Những thay đổi trong chuyển hóa lipid do điều trị bằng corticosteroid cũng đã được đánh giá ở phụ nữ mắc bệnh lupus ban đỏ hệ thống (SLE). Bệnh nhân bị SLE có thể tăng nguy cơ mắc bệnh xơ vữa động mạch vành, có thể tăng lên do sự thay đổi nồng độ lipid huyết thanh khi dùng corticosteroid.
Khi so sánh với những phụ nữ bị SLE không được điều trị bằng prednisone, bệnh nhân dùng prednisone có mức TG, TC và LDL- C cao hơn. Có vẻ như phụ nữ có thể dễ bị những thay đổi này hơn nam giới, và trong nhiều bệnh mãn tính, việc sử dụng corticosteroid là không thể tránh khỏi.
Cần thận trọng khi giáo dục bệnh nhân về những nguy cơ và lợi ích liên quan đến việc điều trị lâu dài với corticosteroid và hỗ trợ những thay đổi trong lối sống giúp ngăn ngừa bệnh tim mạch do xơ vữa.
Cyclosporine và Tacrolimus Cyclosporine và Tacrolimus là các chất ức chế miễn dịch được sử dụng như liệu pháp chính cho những người ghép tạng.
Một số bất thường về chuyển hóa có liên quan đến việc sử dụng cả hai loại thuốc này, bao gồm không dung nạp glucose, loãng xương và tăng nồng độ TC và LDL-C và apo B-100. Tác động lên nồng độ HDL-C không nhất quán, nhưng các thử nghiệm cũng đã chứng minh tăng HDL-C.
Tăng lipid máu có thể xảy ra lên đến 60% ở bệnh nhân sau ghép tạng. Điều này là do sự kết hợp của nhiều yếu tố, bao gồm béo phì sau ghép điều trị bằng thuốc (bao gồm steroid và các chất ức chế miễn dịch khác) và bệnh ĐTĐ.
Những tác dụng của thuốc này với cyclosporine lớn hơn nhiều so với Tacrolimus, có tác dụng tối thiểu trên TC và LDL-C, và tác dụng nhỏ hơn trên nồng độ TG so với cyclosporine. cấy ghép tim. Sau 12 tháng điều trị, TC huyết thanh, LDL-C, HDL-C và TG cao hơn đáng kể ở nhóm dùng Cyclosporin so với tacrolimus và nhiều bệnh nhân hơn được điều trị nội khoa do tăng lipid (71% so với 41%; p = 0,01).
Tác động của Cyclosporin đối với nồng độ lipid dường như phụ thuộc vào liều lượng và nồng độ tương quan với sự gia tăng TC và LDL-C, cũng như giảm mức HDL-C.
Cơ chế mà cyclosporin gây ra tăng lipid máu chưa rõ ràng, cũng như tác động ở người bị nhầm lẫn bởi nhiều yếu tố khác ở bệnh nhân cấy ghép.
Do tình trạng phức tạp của bệnh nhân cấy ghép và tăng nguy cơ mắc BTMXV, nên chú ý đến các tác dụng phụ này và các yếu tố nguy cơ khác. Nồng độ thuốc trong huyết thanh nên được theo dõi trong khi điều trị vì sự gia tăng nồng độ thuốc có liên quan đến các tác dụng phụ xấu.
Ngoài ra, nếu thích hợp, có thể xem xét chuyển đổi từ Cyclosporin sang Tacrolimus nếu tăng lipid máu sau ghép tạng và một số nghiên cứu đã chứng minh điều này.
Mặc dù bệnh nhân có thể được lợi khi điều trị bằng chất ức chế HMG-CoA reductase, sử dụng đồng thời Cyclosporin và HMG -CoA reductase ức chế đã được chứng minh là làm tăng nguy cơ bệnh cơ và tiêu cơ vân do tương tác thuốc-thuốc tiềm ẩn thông qua việc ức chế chuyển hóa qua trung gian CYP3A của Simvastatin và ức chế cyclosporin đối với protein vận chuyển anion hữu cơ (OATP1B1) qua gan qua trung gian hấp thu Simvastatin. Vì pravastatin và fluvastatin không được chuyển hóa đáng kể bởi enzym CYP, chúng có thể là lựa chọn thuận lợi ở nhóm bệnh nhân này do giảm nguy cơ tương tác thuốc-thuốc. Tuy nhiên, vẫn nên giảm liều Pravastatin và Fluvastatin do ức chế Cyclosporin của sự hấp thu qua trung gian OATP1B1 ở gan. Hơn nữa, Fluvastatin đã được chứng minh là làm giảm các biến cố tim mạch và giảm nồng độ LDL-C ở những người ghép tạng được điều trị ức chế miễn dịch bằng Cyclosporin.
10. THUỐC ĐIỀU TRỊ VIRUS
Chất ức chế protease (Protease Inhibitors)
Nhóm ức chế protease (PI) là thuốc kháng retrovirus mạnh được sử dụng kết hợp với các liệu pháp khác như là một phần của phác đồ kháng virus để điều trị virus suy giảm miễn dịch ở người (HIV).
Tăng lipid máu được cho là do tăng sản xuất VLDL và lipoprotein tỷ trọng trung gian (IDL) có khả năng gây rối loạn chức năng nội mạc mạch máu và xơ vữa động mạch. Các enzym cần thiết để loại bỏ lipoprotein giàu triglycerid cũng bị giảm ở bệnh nhân HIV.
Điều này bao gồm enzyme lipoprotein lipase và lipase gan. Nhóm ức chế protease liên quan đến kháng insulin và biểu hiện bất thường của gen apolipoprotein C-III cũng có thể gây ra rối loạn lipid máu.
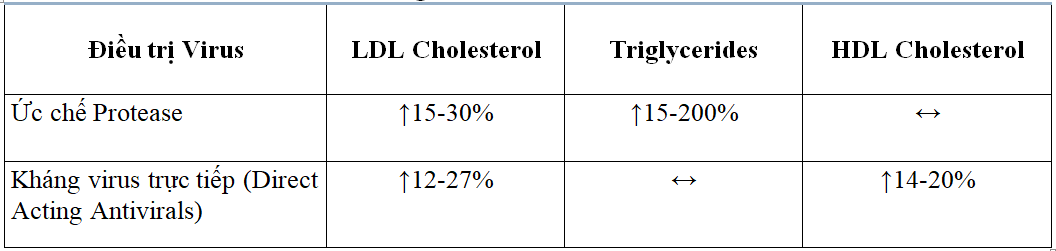
Các nghiên cứu đánh giá Nhóm ức chế protease đã cho thấy sự gia tăng TC cũng như triglycerid mà ít hoặc không ảnh hưởng đến HDL-C và tăng nồng độ LDL-C không nhất quán. Không có đủ bằng chứng liên quan trực tiếp giữa rối loạn lipid máu và nguy cơ bệnh mạch vành ở người nhiễm HIV.
Sự gia tăng chính là các lipoprotein chứa triglycerid hỗ trợ cơ chế giải phóng các axit béo tự do và dẫn đến tăng tổng hợp VLDL gây ra những thay đổi này. Trong khi tất cả các nhóm ức chế protease đều có thể thay đổi mức lipid, Ritonavir dường như có tác dụng lớn nhất và cũng đã được báo cáo là gây ra các trường hợp tăng lipid máu rất cao.
Trong một nghiên cứu mù đôi, ngẫu nhiên kéo dài 4 tuần, Ritonavir có liên quan đến việc tăng ít nhất gấp đôi nồng độ TG huyết thanh ở 24 (61%) bệnh nhân so với chỉ 4 (19%) bệnh nhân dùng giả dược (p = 0,003) và bảy đối tượng có mức TG vượt quá 1000 mg/dl.
Bệnh nhân có nồng độ TG huyết thanh cao có nguy cơ bị viêm tụy cao hơn, điều này đã được báo cáo sau khi điều trị bằng thuốc ức chế protease.
Do đó, các biến chứng lâu dài của tăng lipid trong bệnh cảnh HIV nên được thực hiện được xem xét ở những bệnh nhân được điều trị bằng thuốc ức chế protease. Hướng dẫn điều trị hạ lipid máu được hỗ trợ và nỗ lực sửa đổi các yếu tố nguy cơ tim mạch khác nên được bắt đầu ở bệnh nhân. Hướng dẫn từ Hiệp hội Y học HIV và Hiệp hội Bệnh truyền nhiễm Hoa Kỳ (IDSA) / Nhóm Thử nghiệm Lâm sàng Hỗ trợ Người lớn khuyến nghị pravastatin hoặc atorvastatin như liệu pháp ban đầu cho LDL.C tăng cao để tránh tương tác thuốc-thuốc tiềm ẩn với thuốc ức chế protease qua trung gian hệ thống enzym CYP450.
Gemfibrozil hoặc Fenofibrate được khuyến cáo khi nồng độ TG ≥ 500 mg / dl. Ở những bệnh nhân có nguy cơ cao hơn, chuyển sang chế độ điều trị không có PI là một cách khác lựa chọn.
Nhóm chống virus tác động trực tiếp (Direct acting antivirals)
Các phác đồ điều trị thuốc kháng virus tác động trực tiếp đã thay đổi đáng kể việc điều trị viêm gan C mãn tính kể từ khi được phê duyệt Sofosbuvir (2014).
Các thuốc kháng virus tác động trực tiếp đã cho thấy hiệu quả hơn so với tiêu chuẩn chăm sóc trước đây (phương pháp điều trị dựa trên interferon như pegylated interferon và ribavirin) trong việc tạo ra đáp ứng virus học bền vững (sustained virologic response) ≥90% và có ít tác dụng phụ hơn.
Hiện có bốn nhóm thuốc kháng virus tác động trực tiếp, được xác định theo cơ chế hoạt động và mục tiêu điều trị của chúng (chất ức chế NS3/4A, chất ức chế protease [PIs], thuốc ức chế NS5B và thuốc ức chế NS5A).
Các phác đồ được khuyến nghị ngày nay bao gồm nhiều loại thuốc kháng vi-rút nhắm vào các vị trí khác nhau để cải thiện hiệu quả và giảm tỷ lệ kháng thuốc.
Trong khi bản thân vi rút viêm gan C có thể ảnh hưởng đến chuyển hóa lipid, điều trị bằng chế độ thuốc kháng virus tác động trực tiếp có liên quan đến việc tăng nồng độ LDL-C, TC và HDL-C trong thời gian ngắn và không ảnh hưởng đến TG’s. Tác dụng này có thể là kết quả của việc hủy bỏ tác dụng ức chế sự nhân lên của virus HCV hoặc từ hoạt tính dược lý trực tiếp của chính thuốc kháng virus tác động trực tiếp.
Mức độ ảnh hưởng dường như thay đổi tùy theo chế độ thuốc kháng virus tác động trực tiếp với sự gia tăng LDL-C lên đến 27% đã được ghi nhận.
Tuy nhiên cần thêm nhiều nghiên cứu để làm sáng tỏ cơ chế tác động chính xác và phác đồ nào có tác động nhiều nhất.
Vì thời gian điều trị được xác định và ngắn hạn (12-24 tuần), nên không chắc rằng những thay đổi này sẽ tác động xấu đến sức khỏe tim mạch về lâu dài.
Tuy nhiên, điều quan trọng là phải thừa nhận rằng nhiều tác nhân trong số này có tương tác dược động học giữa thuốc và thuốc với statin. Các bác sĩ lâm sàng có thể chọn tạm thời điều trị bằng statin, điều này cũng có thể góp phần làm thay đổi thành phần lipid máu trong thời gian điều trị.
Bảng 10. Thuốc điều trị Virus
11. INTERFERONS
Interferon có liên quan đến một loạt các biến chứng toàn thân bao gồm thay đổi tâm thần kinh, mệt mỏi và ức chế tủy xương. Mặc dù các tác dụng phụ lên chuyển hóa ít xảy ra hơn, nhưng α interferon được biết là ức chế enzyme lipoprotein lipase (LPL), kích thích tạo lipid ở gan và có liên quan đến sự gia tăng nồng độ TG.
Một nghiên cứu thuần tập về bệnh nhân viêm gan C mãn tính được điều trị bằng các dạng khác nhau của α interferon được đánh giá về những thay đổi ở TG và TC. Nhìn chung, nồng độ TG huyết thanh tăng trung bình khoảng 40% sau 12 tuần và trở lại mức ban đầu sau 24 tuần sau khi ngừng điều trị.
Tuy nhiên, hiệu quả trên từng bệnh nhân là khác nhau và 41 bệnh nhân (27%) trải qua TGs tăng hơn gấp đôi so với ban đầu. Không có thay đổi đáng kể nào trong TC được ghi nhận. Các biến chứng lâu dài của điều này chưa được đánh giá và không có bệnh nhân nào trong nghiên cứu bị viêm tụy cấp.
Có vẻ như bất kỳ hậu quả lâm sàng đáng kể nào từ sự gia tăng TG này là cực kỳ hiếm. Dường như không có sự khác biệt về mức độ thay đổi dựa trên dạng α interferon cụ thể đã được sử dụng, bao gồm cả dạng PEGylated tác dụng kéo dài.(long-acting PEGylated).
Vì bối cảnh điều trị viêm gan C mãn tính chuyển sang phác đồ không có interferon với kháng virus tác dụng trực tiếp, điều này có thể không liên quan ở những bệnh nhân này.
Tuy nhiên, tác dụng này trên TG đã được thấy trong việc điều trị bằng Interferon đối với các bệnh khác, bao gồm bệnh bạch cầu nguyên bào tủy mãn tính và các bệnh ung thư khác.
Gần đây nhiều nghiên cứu đã làm sáng tỏ với Interleukin-10 đóng một vai trò quan trọng trong mối liên hệ giữa viêm và chuyển hóa lipoprotein và điều đó bệnh nhân bị ung thư hoặc các bệnh tự miễn khác liên quan đến nồng độ Interleukin-10 tăng cao có thể có HDL-C giảm rõ rệt, LDL-C thấp và TG tăng cao.
Bệnh nhân được điều trị bằng interferon để điều trị ung thư có thể được xem xét dùng thuốc
chống rối loạn lipid máu để kiểm soát tăng TG máu thứ phát.
12. MỘT SỐ THUỐC KHÁC ẢNH HƯỞNG ĐẾN NỒNG ĐỘ LIPOPROTEIN
Nhiều loại thuốc khác đã được báo cáo là ảnh hưởng đến nồng độ thành phần lipid và / hoặc lipoprotein (Bảng 11).
Sự thay đổi lipid từ các loại thuốc này dựa trên dữ liệu còn hạn chế, được báo cáo không nhất quán và có thể do các khía cạnh liên quan đến bệnh khác. Do đó, không thể chứng minh đầy đủ các tác động lên mức lipid huyết thanh.
KẾT LUẬN
Xuất phát từ một số thuốc có thể ảnh hưởng đến thành phần lipid máu một cách tích cực hoặc tiêu cực. Các yếu tố nguy cơ bao gồm tăng lipid máu ở mức ban đầu và bệnh nhân có nguy cơ tim mạch cao.
Xác định các loại thuốc tiềm năng là nguyên nhân của những thay đổi này và theo dõi thành phần lipid trong khi điều trị có thể mang lại giá trị cho việc chăm sóc bệnh nhân.
Tuy nhiên, tác động lâu dài của các loại thuốc này đối với tỷ lệ tử vong và bệnh tật do bệnh tim mạch do xơ vữa vẫn chưa được biết rõ và có ít bằng chứng về tác động tổng thể của những thay đổi do thuốc này gây ra.
Phân tích lợi ích- nguy cơ một cách thận trọng của mỗi phương pháp điều trị nên được thực hiện dựa trên các yếu tố của bệnh nhân. Nói chung, nếu quan sát thấy những thay đổi tiêu cực trong thành phần lipid trong khi điều trị, có thể khuyến cáo thay thế bằng một liệu pháp thay thế tương đương.
Nếu không có liệu pháp tương đương và phải bắt đầu điều trị, thì việc theo dõi nồng độ thành phần lipid huyết thanh rất quan trọng. Việc sử dụng các khuyến cáo để quản lý rối loạn lipid máu trong nhân dân nói chung có thể được tham khảo và trong các trường hợp nghiêm trọng; Việc sử dụng thuốc nghi ngờ cần phải được đánh giá lại.
Bảng 11. Các thuốc ảnh hưởng lên thành phần lipid và /hoặc Lipoproteins
Bảng 12. Tóm tắt Rối loạn lipid máu ( LDL.C và TG) thứ phát do thuốc Terry A. Jacobson và CS . Journal of clinical lipidology. 2014.

TÀI LIỆU THAM KHẢO
- Feingold KR, Grunfeld C. Approach to the Patient with Dyslipidemia. In: De Groot LJ, Chrousos G, Dungan K, et al., eds. Endotext. South Dartmouth (MA): MDText.com, Inc.;
- Patni N, Li X, Adams-Huet B, Garg A. The prevalence and etiology of extreme hypertriglyceridemia in children: Data from a tertiary children’s hospital. J Clin Lipidol. 2018;12(2):305-310.
- Del-Aguila JL, Beitelshees AL, Cooper- Dehoff RM, et al. Genome-wide association analyses suggest NELL1 influences adverse metabolic response to HCTZ in African Americans. The pharmacogenomics journal. 2014;14(1):35-40.
- Ripley TL, Saseen JJ. beta-blockers: a review of their pharmacological and physiological diversity in The Annals of pharmacotherapy. 2014;48(6):723-733.
- Yanai H, Hakoshima M, Adachi H, et al. Effects of Six Kinds of Sodium-Glucose Cotransporter 2 Inhibitors on Metabolic Parameters, and Summarized Effect and Its Correlations With Baseline Data. Journal of clinical medicine research. 2017;9(7):605-612.
- Cha SA, Park YM, Yun JS, et al. A comparison of effects of DPP-4 inhibitor and SGLT2 inhibitor on lipid profile in patients with type 2 diabetes. Lipids in health and disease. 2017;16(1):58.
- Feingold KR, Grunfeld C. Role Of Glucose And Lipids In The Cardiovascular Disease Of Patients With In: De Groot LJ, Chrousos G, Dungan K, et al., eds. Endotext. South Dartmouth (MA): MDText.com, Inc.; 2018.
- Invokana® [package insert]. Titusville, NJ: Janssen Pharmaceuticals.
- Farxiga® [package insert]. Wilmington, DE. AstraZeneca Pharmaceuticals;
- Jardiance® [package insert]. Ridgefield, CT: Boehringer Ingelheim Pharmaceuticals; 2017.
- Singh HK, Prasad MS, Kandasamy AK, Dharanipragada K. Tamoxifen-induced hypertriglyceridemia causing acute pancreatitis. Journal of pharmacology & pharmacotherapeutics. 2016;7(1):38-40.
- Marjoribanks J, Farquhar CM, Roberts H, Lethaby A. Cochrane corner: long-term hormone therapy for perimenopausal and postmenopausal women. Heart (British Cardiac Society).2018;104(2):93-95.
- O’Farrell S, Garmo H, Holmberg L, Adolfsson J, Stattin P, Van Hemelrijck M. Risk and timing of cardiovascular disease after androgen-deprivation therapy in men with prostate Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 2015;33(11):1243-1251.
- McKay LI, Cidlowski JA. Physiologic and Pharmacologic Effects of 2003.http://www.ncbi.nlm.nih.gov/books/ NBK13780/. Accessed February 16, 2015.
- Fazal MA, Idrees MK, Akhtar Dyslipidaemia among renal transplant recipients: cyclosporine versus tacrolimus. JPMA The Journal of the Pakistan Medical Association. 2014;64(5):496-499.
- Jakobsen JC, Nielsen EE, Feinberg J, et al. Direct-acting antivirals for chronic hepatitis C. The Cochrane database of systematic reviews. 2017;9:Cd012143.
- Endo D, Satoh K, Shimada N, Hokari A, Aizawa Impact of interferon-free antivirus therapy on lipid profiles in patients with chronic hepatitis C genotype 1b. World journal of gastroenterology.2017;23(13):2355-2364.
- Kanda T, Moriyama M. Direct-acting antiviral agents against hepatitis C virus and lipid metabolism. World journal of 2017;23(31):5645- 5649.
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam




