UNG THƯ TUYẾN GIÁP THỂ BIỆT HÓA KHÁNG I-131:
CHIẾN LƯỢC CHẦN ĐOÁN VÀ ĐIỀU TRỊ TẠI BỆNH VIỆN TWQĐ 108
PGS. TS. BS Lê Ngọc Hà và cs
Khoa Y học hạt nhân – Bệnh viện TW QĐ 108
ABSTRACT
Radioactive iodine-refractory differentiated thyroid cancer: Diagnostic and treatment strategies in Hospital 108
Radioactive iodine (RAI) refractoriness is a serious disease with poor prognosis and more frequent in older patients, in those with large metastases, in poorly differentiated thyroid cancer, and in those tumors with high 18-fluordeoxyglucose uptake on PET/CT. These patients have a 10 – year survival rate of less than 10%. Many patients may survive in the absence of treatment for years with a stable or slowly progressive disease. However, a few patients may require treatment when the tumor burden is large and when progression has been documented. For these reasons, it is important to adequately select patients who should be treated and then manage them with an interdisciplinary approach. Our paper oulines the diagnostic and therapeutic strategies in radioactive iodine refractory patients.
Keywords: radioactive iodine, radioactive iodine refractory differentiated thyroid cancer.
TÓM TẮT
Ung thư tuyến giáp kháng iôt là tình trạng bệnh lý ác tính có tiên lượng xấu và thường xuất hiện ở bệnh nhân lớn tuối, di căn, ung thư kém biệt hoá và bắt giữ FDG cao trên hình ảnh PET/CT. Các bệnh nhân này có tỷ lệ thời gian sống thêm 10 năm dưới 10%. Nhiều bệnh nhân có bệnh ổn định hoặc tiến triển chậm mặc dù không điều trị. Tuy nhiên, một số bệnh nhân đòi hỏi phải được điều trị khi gắng nặng bệnh lớn, di căn nhiều và tiến triển nhanh. Vì vậy, các bệnh nhân ung thư tuyến giáp biệt hoá kháng I-131 cần được chẩn đoán, theo dõi và điều trị hợp lý với sự phối hợp của nghiều chuyên ngành. Bài báo cáo tổng quan về chiến thuật chẩn đoán và xử trí bệnh nhân ung thư tuyến giáp biệt hoá kháng I-131.
Từ khoá: iốt phóng xạ, ung thư tuyến giáp biệt hoá kháng I-131.
Chịu trách nhiệm chính: Lê Ngọc Hà
Ngày nhận bài: 01/7/2019
Ngày phản biện khoa học: 21/7/2019
Ngày duyệt bài: 1/8/2019
Ung thư tuyến giáp (UTTG) là loại bệnh ung thư ngày càng phổ biến, chiếm tỷ lệ 5,1% các bệnh ung thư và đứng thứ năm trong các loại ung thư thường gặp ở nữ giới. Năm 2018, trên thế giới ước tính có khoảng 567.233 ca UTTG mới được chẩn đoán và 41.071 ca tử vong do UTTG. Tại Việt Nam, UTTG đứng thứ tám trong các loại ung thư thường gặp ở cả hai giới và đứng thứ sáu trong các loại ung thư thường gặp ở nữ giới. Năm 2018 ước tính có 5.418 ca mới mắc UTTG, trong đó bệnh nhân (BN) nữ giới chiếm 4/5 với 4.538 ca và chỉ có 528 ca tử vong do UTTG.
Nhờ những tiến bộ trong chẩn đoán và điều trị, trong những năm gần đây tỷ lệ tử vong của UTTG biệt hóa đã giảm đáng kể tuy nhiên tỷ lệ tái phát, di căn sau điều trị còn khá cao từ 8 – 23%. Đa số BN UTTG biệt hóa tái phát, di căn được điều trị bằng phẫu thuật và 131I. Các BN UTTG biệt hóa tái phát, di căn đáp ứng với 131I có tiên lượng khá tốt với tỷ lệ sống thêm toàn bộ sau 10 năm đạt 92%. Tuy nhiên, 25 – 50% BN UTTG tái phát, di căn kháng với điều trị 131I và thường có tiên lượng xấu với tỷ lệ sống thêm toàn bộ sau 10 năm chỉ đạt 19% [2]. Do đó, nhiều tác giả trên thế giới trong thời gian gần đây đã đưa ra khái niệm UTTG biệt hóa kháng 131I (radioactive iodine refractory) dành cho nhóm BN này. Tuy nhiên, các tiêu chuẩn để xác định UTTG biệt hóa kháng 131I vẫn là vấn đề còn đang được bàn luận. Cần có thêm nhiều nghiên cứu để đi đến một khái niệm đồng thuận cũng như có hướng xử trí thích hợp.
1. KHÁI NIỆM UNG THƯ TUYẾN GIÁP THỂ BIỆT HÓA KHÁNG 131I
Khái niệm UTTG thể biệt hóa kháng 131I mới được đưa ra trong những năm gần đây để chỉ các bệnh nhân UTTG thể biệt hóa tái phát, di căn không đáp ứng với điều trị 131I. Tiêu chuẩn xác định nhóm bệnh nhân này còn chưa được thống nhất và vẫn đang được bàn luận. Tuy nhiên các tác giả đều thống nhất khi BN đã được xác định kháng 131I thì không còn chỉ định tiếp tục điều trị 131I.
Hội tuyến giáp Mỹ năm 2015 đã phân loại UTTG thể biệt hóa kháng 131I ở các BN được chuẩn bị thích hợp cho điều trị 131I (TSH kích thích ≥ 30 UI/ml và thực hiện chế độ ăn hạn chế i-ốt) thành 4 nhóm chính [3]:
– Tổn thương di căn không bắt giữ 131I trên xạ hình toàn thân ( XHTT) trong lần điều trị đầu tiên.
– Khối u trước kia có bắt giữ I131 nhưng sau đó mất khả năng tập trung 131I.
– 131I bắt giữ ở một số tổn thương nhưng không tập trung ở các tổn thương khác.
– Tổn thương di căn, tiến triển dù vẫn bắt giữ 131I.
Một số tác giả và nghiên cứu còn đưa ra các tiêu chí khác trong đánh giá BN kháng với 131I như liều điều trị 131I tích lũy > 600 mCi nhưng không đáp ứng hoàn toàn, tăng Tg huyết thanh sau điều trị 131I, tổn thương bắt giữ FDG trên PET/CT [4].
Trong nhóm BN UTTG kháng 131I đầu tiên theo phân loại của Hội tuyến giáp Mỹ, tổn thương di căn không bắt giữ 131I ở ngoài giường tuyến giáp ở ngay lần XHTT đầu tiên. Không có bằng chứng về lợi tích của việc tiếp tục điều trị 131I đối với các BN này. Hơn nữa, BN có tổn thương tái phát, di căn nhưng không bắt giữ 131I trên XHTT chẩn đoán tiếp theo cũng được coi là kháng với 131I bởi vì thậm chí XHTT sau điều trị có bắt giữ 131I thì lợi ích cũng rất hạn chế. Ở nhóm BN kháng 131I thứ hai, khối u tự mất khả năng tập trung 131I mà trước đó đã bắt giữ 131I. Tình huống này thường xảy ra ở các BN có di căn nhiều vị trí với kích thước lớn và do các tế bào biệt hóa có khả năng bắt giữ 131I đã bị tiêu diệt nhưng các tế bào còn lại biệt hóa kém không có khả năng bắt giữ 131I tiếp tục phát triển. Ở nhóm kháng 131I thứ ba, 131I vẫn được bắt giữ ở một số tổn thương nhưng không tập trung ở các tổn thương khác. Loại này thường gặp ở BN UTTG có nhiều tổn thương di căn kích thước lớn phát hiện trên chụp PET với 124I và FDG PET/CT so với XHTT với 131I. Ở các BN này, các tổn thương không bắt giữ 131I dường như sẽ tiến triển và điều trị i-ốt phóng xạ không có lợi ích trong tiến triển chung của bệnh. Ở nhóm kháng 131I thứ tư, tổn thương di căn tiếp tục tiến triển mặc dù có bắt giữ đáng kể 131I (xuất hiện tổn thương mới, tăng kích thước tổn thương và nồng độ Tg vài tháng sau điều trị I-131). Định nghĩa của các tình huống trên phụ thuộc vào các phương pháp chẩn đoán hình ảnh bao gồm XHTT với 131I kết hợp với CT, MRI hoặc FDG PET/CT. Các tiêu chí xác định UTTG thể biệt hóa kháng 131I còn có thể gây nhiều tranh cãi và cần thêm các nghiên cứu trong tương lai để đưa ra một định nghĩa rõ ràng hơn [3].
Các yếu tố tiên lượng đáp ứng với điều trị 131I là sự bắt giữ i-ốt phóng xạ tại khối u, BN trẻ, UTTG thể biệt hóa cao, di căn kích thước nhỏ và bắt giữ FDG mức độ ít. Trong thực tế, các yếu tố này có liên quan chặt chẽ với nhau và có thể cho phép tiên đoán kết quả điều trị 131I ngay ở thời điểm phát hiện di căn. Khoảng 2/3 BN UTTG di căn có bắt giữ 131I tại tổn thương di căn và chỉ một nửa số BN này được điều trị khỏi bằng điều trị nhiều đợt 131I.
Các trường hợp BN có bắt giữ 131I ở tất cả các tổn thương nhưng không đủ tiêu chuẩn khỏi bệnh sau điều trị nhiều đợt 131I nhưng tổn thương vẫn ổn định không tiến triển theo tiêu chuẩn RECIST. Các BN này có được coi là kháng 131I hay không hoặc nên dừng điều trị 131I và chuyển sang các phương pháp điều trị khác vẫn là vấn đề đang được tranh cãi. Khả năng điều trị khỏi với việc tiếp tục điều trị 131I là rất thấp và tác dụng phụ có thể tăng lên, bao gồm cả nguy cơ bị ung thư thứ hai và bệnh bạch cầu. Các yếu tố nên được cân nhắc trước khi quyết định tiếp tục điều trị 131I bao gồm đáp ứng với các lần điều trị trước, sự bắt giữ 131I mức độ cao và bắt giữ FDG mức độ thấp tại khối u cũng như tác dụng phụ hạn chế của điều trị 131I.
2. ĐÁNH GIÁ BỆNH NHÂN UNG THƯ TUYẾN GIÁP BIỆT HÓA KHÁNG 131I
BN UTTG thể biệt hóa tái phát, di căn kháng 131I thường có diễn biến lâm sàng thầm lặng gần như không có triệu chứng hoặc ảnh hưởng của tổn thương tái phát, di căn trong nhiều năm. Khi chưa có một phương pháp điều trị có khả năng đáp ứng hoàn toàn hoặc cải thiện thời gian sống thêm toàn bộ, việc điều trị chỉ nên hạn chế trong việc dự phòng sự tiến triển của bệnh và điều trị triệu chứng. Do đó, khi BN UTTG di căn được xác định kháng 131I cần tiến hành một số nội dung sau:
– Xác định đặc điểm, mức độ di căn bằng các phương pháp chẩn đoán hình ảnh như CT, MRI, FDG PET/CT.
– Đánh giá mức độ gây triệu chứng lâm sàng hiện tại hoặc nguy cơ gây triệu chứng lâm sàng của tổn thương di căn cho BN.
– Đánh giá tình trạng bệnh lý kết hợp của BN có thể ảnh hưởng đến việc lựa chọn phương pháp điều trị tổn thương di căn.
– Đánh giá mức độ tiến triển của tổn thương di căn trên chẩn đoán hình ảnh.
Việc đánh giá định kỳ kích thước và sự phát triển của tổn thương di căn có thể thuận lợi, chính xác và khách quan hơn bằng việc sử dụng các tiêu chí tương tự như tiêu chuẩn RECIST đánh giá đáp ứng các khối u đặc trong các thử nghiệm lâm sàng. Các tổn thương di căn dạng mô mềm kích thước > 1 cm được xác định là tổn thương đích trên các hình ảnh cắt ngang, thông qua việc đo kích thước dài nhất của mỗi tổn thương. Bệnh có thể coi như ổn định hoặc tiến triển tối thiểu nếu tổng các kích thước dài nhất của các tổn thương đích tăng không quá 20% và không xuất hiện thêm tổn thương mới trên hình ảnh chụp lại trong 12 – 15 tháng theo dõi. Chưa có nghiên cứu nào xác định được tần suất sử dung các phương pháp chẩn đoán hình ảnh tối ưu nhưng thông thường nên chụp lại trong vòng 3 – 12 tháng căn cứ vào kích thước và vị trí của tổn thương. Đánh giá thường xuyên hơn có thể được cân nhắc khi tổn thương di căn được xác định có liên quan với triệu chứng lâm sàng của BN. Thời gian đánh giá lâu hơn khi tổn thương di căn và triệu chứng lâm sàng của BN ổn định.
3. CHIẾN LƯỢC ĐIỀU TRỊ UNG THƯ TUYẾN GIÁP BIỆT HÓA KHÁNG 131I
Theo khuyến cáo của Hội tuyến giáp Mỹ, các BN UTTG thể biệt hóa di căn kháng 131I nhưng không có triệu chứng, ổn định hoặc tiến triển tối thiểu và ít có khả năng tiến triển nhanh gây các biến chứng lâm sàng mà không có chỉ định điều trị tại chỗ có thể được uống hormon tuyến giáp ức chế TSH và theo dõi định kỳ chụp hình đánh giá tổn thương sau mỗi 3 – 12 tháng. Tổn thương di căn tiến triển đánh giá theo tiêu chuần RECIST khi xác nhận sự tăng lên trên 20% tổng kích thước các tổn thương đích, xuất hiện thêm tổn thương mới có ý nghĩa hoặc xuất hiện các triệu chứng lâm sàng có liên quan đến bệnh nên được cân nhắc điều trị toàn thân thích hợp ngoài việc điều trị hormon ức chế TSH và/hoặc điều trị tại chỗ. Điều trị toàn thân có thể bao gồm các thuốc ức chế tyrosine kinase (Tyrosine Kinase Inhibitors – TKIs), hóa trị thông thường.
Mặc dù nồng độ Tg huyết thanh nên được đánh giá như một dấu ấn sinh học của mức độ bệnh lý, không nên coi BN có bệnh tiến triển và cần phải điều trị tích cực hơn chỉ dựa vào sự tăng Tg huyết thanh. Tuy nhiên, khi Tg huyết thanh tăng cao, nên cân nhắc việc chụp hình chẩn đoán thường xuyên và toàn diện hơn nhằm phát hiện các tổn thương cấu trúc kín đáo trước đó.
Các phương pháp điều trị tại chỗ bao gồm phẫu thuật, xạ trị ngoài, tiêm cồn qua da, điều trị bằng sóng tần số radio… Việc lựa chọn phương pháp điều trị thích hợp phụ thuộc vào vị trí, kích thước và số lượng tổn thương. Do đa số nguyên nhân tử vong trong UTTG đều do tái phát, di căn tại chỗ gây chèn ép nên theo quan điểm của Chung JK, việc xử trí UTTG thể biệt hóa di căn nên điều trị theo tổn thương (lesion-based) hơn là điều trị theo kinh nghiệm hay cá thể hóa điều trị. Schlumberger và cộng sự đã đề xuất hướng xử lý các BN kháng i-ốt theo sơ đồ dưới đây.
Hai nghiên cứu pha III sử dụng các thuốc ức chế tyrosine kinase cho BN UTTG thể biệt hóa kháng 131I di căn tiến triển nhanh, các BN có đột biến gen BRAFV600E được đưa ngẫu nhiên vào nhánh giả dược có thời gian sống thêm bệnh không tiến triển tương tự như các BN không có đột biến gen này. Đột biến gen BRAF dường như không có giá trị tiên lượng ở các BN UTTG biệt hóa đã tiến triển ở mức độ này (kháng 131I, tiến triển tại chỗ hoặc di căn tiến triển trong vòng 3 – 14 tháng theo tiêu chuẩn RECIST). Vì vậy, Hội tuyến giáp Mỹ không khuyến cáo xét nghiệm thường quy đột biến gen BRAFV600E nhằm mục đích tiên lượng ở các BN UTTG thể biệt hóa kháng 131I đã có tiến triển tại chỗ hoặc di căn.
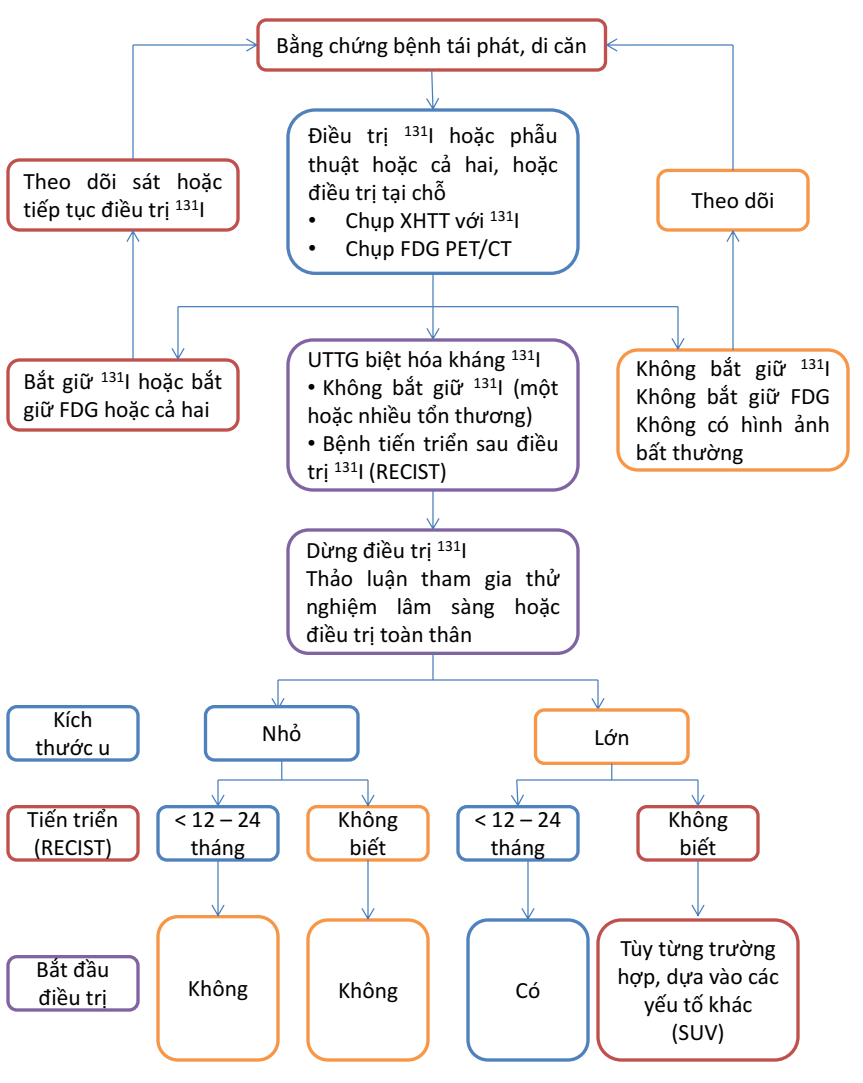
Hình 1. Hướng xử trí UTTG biệt hóa tái phát, di căn kháng 131I [5]
Trong thực hành lâm sàng, quyết định có hay không điều trị, điều trị bằng biện pháp nào cho các BN UTTG biệt hóa kháng 131I là một vấn đề cần nên được cân nhắc cẩn thận. Đứng trước một BN có tổn thương tái phát/di căn không bắt i-ốt phóng xạ, cần cân nhắc các yếu tố:
- Vị trí tổn thương: tái phát tại vùng giường tuyến giáp, hạch cổ hay tổn thương di căn: phổi, xương, não….
- Kích thước tổn thương: các tổn thương dưới 1cm, đặc biệt là với các hạch vùng cổ có thể theo dõi sát mà chưa cần can thiệp.
- Mức độ tiến triển của tổn thương: các tổn thương có tiến triển đánh giá theo tiêu chuẩn RECIST trong vòng 6 – 14 tháng sau liều 131I điều trị gần nhất được xem xét các biện pháp can thiệp.
- Khả năng xâm lấn, gây ra các triệu chứng ảnh hưởng tới tính mạng của BN: tổn thương tái phát tại vùng giường tuyến giáp nếu không được điều trị sớm có thể dẫn tới xâm lấn, chèn ép khí quản, đe dọa tính mạng bệnh nhân. Các tổn thương lớn tại não, phổi, hạch trung thất và tổn thương di căn tại cột sống cũng là các vị trí có khả năng gây chèn ép, cần phải can thiệp sớm.
Khi nào cần điều trị và lựa chọn biện pháp điều trị nào cần được quyết định bởi một tiểu ban ung thư bao gồm: phẫu thuật viên, bác sĩ y học hạt nhân, bác sĩ nội khoa ung thư, bác sĩ xạ trị, bác sỹ chẩn đoán hình ảnh và bác sĩ giải phẫu bệnh.
Tóm lại, việc xử trí BN UTTG thể biệt hóa tái phát, di căn kháng 131I phụ thuộc vào tình trạng lâm sàng của BN và việc đánh giá đặc điểm, tiến triển của tổn thương theo tiêu chuẩn RECIST dựa vào các phương pháp chẩn đoán hình ảnh.
TÀI LIỆU THAM KHẢO
- Cancer Today [online] Available at: http://gco.iarc.fr/today/home [Accessed 31 December 2018].
- Durante C, Haddy N, Baudin E, Leboulleux S et al (2006). Long-term outcome of 444 patients with distant metastases from papillary and follicular thyroid carcinoma: benefits and limits of radioiodine therapy. J Clin Endocrinol Metab, 91(8), 2892-9.
- Haugen BR et al (2016). 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cance Thyroid, 26(1), 1-133.
- Schlumberger M1, Brose M2, Elisei R3, Leboulleux S et al (2014). Definition and management of radioactive iodine-refractory differentiated thyroid cancer. Lancet Diabetes Endocrinol, 2(5), 356-8.
- Kim KJ, Kim BW, Lee YS et al (2013). On-site ultrasound-guided localization for impalpable nodal recurrences in papillary thyroid carcinoma patients. J Korean Surg Soc, 85(3), 104–108.
- NCCN Clinical Practice Guidelines in Oncology – Thyroid Carcinoma (Version 1.2018) [online] Available at: https://www.nccn.org/professionals/physician_gls/pdf/thyroid.pdf. [Accessed 31 May 2018].
- David SC et al (2009). Revised American Thyroid Association Management Guidelines for Patients with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid, 19 (11), 1167-214.
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam