BƯỚC ĐẦU NGHIÊN CỨU GIÁ TRỊ CỦA 18F-FDG PET/CT
TRONG ĐÁNH GIÁ ĐÁP ỨNG SỚM ĐIỀU TRỊ SORAFENIB
Ở BỆNH NHÂN UNG THƯ TUYẾN GIÁP BIỆT HÓA KHÁNG I-131
Lê Ngọc Hà1, Mai Hồng Sơn1, Nguyễn Thị Nhung1,
Nguyễn Thanh Hướng1, Nguyễn Thị Kim Dung1, Trần Ngọc Lương2
1Bệnh viện TƯQĐ 108, 2Bệnh viện Nội tiết Trung ương
ABSTRACTS
The value of 18F-FDG PET/CT in assessment of early treatment response in radioiodine refractory differentiated thyroid cancer (DTC) patients after sorafenib treatment: a pilot study
Introduction: There is 5 % of DTCs lose the I-131 avidity and become to resistance with radioiodine therapy. The target therapy using the tyrosine kinase inhibitor sorafenib for treatment of advanced iodine-refractory DTC may be benefit for patients. 18F-FDG PET/CT could be initially use as metabolic modality in early assessment of treatment response. Material and methods: Patients with refractory to radioactive iodine having indication of target therapy were underwent to whole body 18F-FDG PET/CT before and after the treatment of sorafenib 1,5 months. An analysis of the role of serum thyroglobulin (Tg), radiological (CT) and fluorodeoxyglucose (FDG) positron emission tomography (PET) response was performed. Results: A total of 7 patients were included in the pilot study. Clinical benefit was obtained in 57% of subjects with early partial metabolic response on PET/CT. The best responses were observed in lymph nodes and lung. The biological and radiological response to treatment were under estimated to metabolic response. Conclusions: PET/CT allows to assess the treatment response earlier than other modalities. The further study should be performed to evaluate the prognosis and benefit of metabolic response.
Keywords: 18F-FDG, PET/CT, sorafenib, iodine-refractory DTC
TÓM TẮT
Đặt vấn đề: Theo thống kê có 5% bệnh nhân ung thư tuyến giáp (UTTG) thể biệt hóa kháng với điều trị I-131. Điều trị đích sử dụng nhóm thuốc ức chế kinase bằng sorafenib có thể lợi ích với những bệnh nhân UTTG kháng I-131. 18-FDG PET/CT là phương pháp bước đầu đã dược ứng dụng để đánh giá đáp ứng sớm sau điều trị đích. Đối tượng và phương pháp: Bệnh nhân UTTG kháng điều trị I-131 có chỉ định điều trị đích được chụp 18F- FDG PET/CT trước và sau điều trị sorafenib 1.5 tháng. Đánh giá đáp ứng điều trị về chuyển hóa trên PET được đối chiếu với đáp ứng điều trị về hình thể (CT) và sinh học (Tg). Kết quả: Tổng số 7 bệnh nhân trong nghiên cứu có 4/7 bệnh nhân có đáp ứng một phần về chuyển hóa sau điều trị. Các tổn thương hạch và phổi đáp ứng tốt hơn so với tổn thương xương. Đáp ứng về chuyển hóa được biểu hiện sớm hơn so với đáp ứng sinh học và hình thể. Kết luận: PET/CT cho phép đánh giá sớm đáp ứng sau điều trị so với các phươnp pháp khác. Cần phải có các nghiên cứu xa hơn để đánh giá vai trò tiên lượng và lợi ích của PET/CT trong đánh giá đáp ứng điều trị đích.
Từ khóa: 18F-FDG, PET/CT, điều trị đích, kháng I-131
Chịu trách nhiệm chính: Lê Ngọc Hà
Ngày nhận bài: 01/7/2019
Ngày phản biện khoa học: 21/7/2019
Ngày duyệt bài: 1/8/2019
1. ĐẶT VẤN ĐỀ
Ung thư biểu mô tuyến giáp (UTTG) là bệnh ác tính thường gặp nhất trong số các ung thư tuyến nội tiết với tỷ lệ hơn 90% [1]. Về mặt mô bệnh học, ung thư biểu mô tuyến giáp được chia thành các thể chính là thể nhú, thể nang, thể tủy và thể kém biệt hóa (anaplastic thyroid carcinoma). Trong đó UTTG biệt hóa bao gồm UTTG thể nhú và thể nang chiếm đa số, hơn 90% các bệnh nhân UTTG [8]. UTTG thể biệt hóa thường có tiên lượng tốt do bệnh tiến triển chậm, có thể phẫu thuật triệt căn và đáp ứng với điều trị I-131.
Tuy nhiên, có xấp xỉ khoảng 25-50% số bệnh nhân này chết trong vòng 10 năm bắt đầu từ khi được chẩn đoán UTTG do di căn xa [7]. Mặc dù vai trò của điều trị I-131 còn đang tranh cãi ở những bệnh nhân có tái phát và di căn xa nhưng tính hiệu quả của phương pháp này có thể bị giảm sút do UTTG kháng với điều trị I-131.
Sử dụng hóa trị truyền thống đem lại hiệu quả rất hiếm hoi, đồng thời không còn được khuyết cáo trong các hướng dẫn điều trị trên thế giới [9].
Ở thời điểm hiện tại chưa có phương pháp nào thực sự hiệu quả áp dụng cho những trường hợp UTTG có kháng với điều trị I-131. Một vài nghiên cứu thực nghiệm lâm sàng pha III sử dụng Sorafenib và Lenvatinib đem lại những kết quả quan[3]. Tuy nhiên, các thuốc điều trị đích hiện nay có giá thành rất cao và độc tính cũng không hề nhỏ. Do vậy, đánh giá đáp ứng điều trị ở những bệnh nhân UTTG kháng I-131 được điều trị đích là rất quan trọng để tiết kiệm chi phí, nâng cao hiệu quả điều trị và giảm độc tính. Hiện nay, đánh giá đáp ứng điều trị trong các thử nghiệm pha III trên thế giới chủ yếu dựa vào lâm sàng, Tg và CT (RECIST 1.1).
Các tiêu chuẩn đánh giá này vẫn còn những hạn chế và không đánh giá sớm được đáp ứng điều trị. Để đánh giá sớm điều trị, quyết định chiến thuật điều trị phù hợp cho bệnh nhân, 18F-FDG PET/CT đã được ứng dụng ở một số ít nghiên cứu. 18F-FDG PET/CT là phương pháp đánh giá dựa vào chuyển hóa và có thể phát hiện sớm các thay đổi sau điều trị đích.
Tuy nhiên, ứng dụng phương pháp đánh giá dựa vào chuyển hóa theo tiêu chuẩn PERCIST 1.0 vẫn còn hạn chế và cần được tiếp tục nghiên cứu. Vì vậy, chúng tôi tiến hành nghiên cứu hiệu quả bước đầu của PET/CT trong đánh giá sớm đáp ứng điều trị sorafenib ở bệnh nhân ung thư tuyến giáp thể biệt hóa kháng với điều trị I-131.
2. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP
Bệnh nhân ung thư tuyến giáp thể biệt hóa kháng I-131 và có chỉ định điều trị đích theo hướng dẫn của hiệp hội ung thư tuyến giáp hoa kỳ 2015 được lựa chọn vào nghiên cứu [5]. Bệnh nhân kháng với điều trị I-131 được xác định dựa vào 1 trong 4 tiêu chuẩn: Bệnh nhân ung thư tuyến giáp có các tổ chức ác tính hoặc di căn không bắt giữ I-131 trên xạ hình toàn thân ở vị trí di căn đã biết. Tổ chức ung thư bị mất khả năng bắt giữ I-131 ở tổn thương đã bắt giữ I-131 trước đó. I-131 phóng xạ chỉ tập trung ở một số tổn thương ác tính nhưng một số tổn thương khác không tập trung I-131. Tổn thương di căn tiến triển mặc dù có bắt giữ I-131 và đã được điều trị I-131. Bệnh nhân ung thư tuyến giáp không phải thể biệt hóa kháng I-131, không có chỉ định điều trị đích và không đồng ý tham gia đều bị loại khỏi đối tượng nghiên cứu.
Các bệnh nhân trong nghiên cứu được làm các xét nghiệm công thức máu, sinh hóa máu: GOT, GPT, urea, creatinin, TSH, thyroglobulin (Tg), A-Tg. Sau đó, bệnh nhân được chụp 18-FDG PET/CT toàn thân có tiêm thuốc cản quang tĩnh mạch đánh giá lại giai đoạn trước khi điều trị sorafenib. Các tổn thương tái phát/di căn ở các vị trí có thể phẫu thuật đều được sinh thiết để xét nghiệm hóa mô miễn dịch và đột biết gen BRAF. Bệnh nhân có chỉ định điều trị đích được uống sorafenib liều 400mg/ngày chia 2 lần. Sau khi điều trị sorafenib 1,5 tháng, các bệnh nhân trong nghiên cứu được chụp xét nghiệm TSH, Tg, Atg và chụp 18-FDG PET/CT có tiêm cản quang tĩnh mạch để đánh giá sớm đáp ứng sau điều trị đích.
Tiêu chuẩn đánh giá đáp ứng sớm sau điều trị đích bao gồm: đáp ứng trên lâm sàng, đáp ứng chất chỉ điểm sinh học của tế bào ung dựa vào sự thay đổi của Tg, đáp ứng về kích thước, mức độ ngấm thuốc cản quang trên CT (RECIST 1.1) và đáp ứng về chuyển hóa trên PET/CT (PETCIST 1.0).
Qui trình chụp PET/CT toàn thân theo hướng dẫn của hội Y học hạt nhân Châu Âu 2010 [2]. Bệnh nhân còn được chụp PET/CT, tiêm thuốc cản quang theo thực hành của trường đại học Pittsburgh Hoa Kỳ để đánh giá cụ thể hơn những tổn thương ở vùng đầu – cổ. Phân loại đáp ứng điều trị được chia thành các tiêu chí sau: Đáp ứng hoàn toàn trên PET: không còn tổn thương tăng chuyển hóa FDG bất thường, khu trú trên xạ hình PET/CT (SUVmax < 2,5).
Đáp ứng một phần trên PET: giảm về số lượng, kích thước và chuyển hóa FDG của tổn thương trên xạ hình PET/CT, đồng thời không xuất hiện tổn thương mới tăng chuyển hóa FDG (SUVmax ≥ 2,5). Bệnh ổn định: tổn thương không thay đổi rõ rệt về số lượng, kích thước và chuyển hóa FDG sau điều trị. Bệnh tiến triển: xuất hiện tổn thương mới tăng chuyển hóa FDG bất thường, khu trú trên xạ hình PET/CT [6].
Các số liệu được thu thập và xử lý bằng phần mềm SPSS 18.0. Các biến định lượng được biểu diễn dưới dạng số trung bình ± độ lệch chuẩn. Sử dụng Student t-test so sánh các giá trị trung bình, sử dụng Chi-square test so sánh các tỷ lệ. Khác biệt chỉ có ý nghĩa thống kê khi p <0,05.
3. KẾT QUẢ NGHIÊN CỨU
Bảng 1. Đặc điểm chung của các bệnh nhân trong nghiên cứu
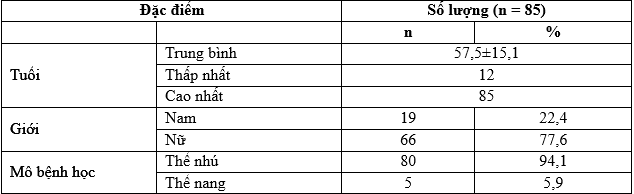
Tổng số bệnh nhân trong nghiên cứu là 7 bệnh nhân trong đó số bệnh nhân nữ nhiều hơn số bệnh nhân nam với tỷ lệ là 57%. Tuổi trung bình của nhóm bệnh nhân trong nghiên cứu là 68,8 ± 11,1.
Ung thư tuyến giáp thể nang chiếm 57% cao hơn so với tỷ lệ ung thư tuyến giáp thể nhú với 43%. Tất cả các bệnh nhân trong nghiên cứu đều được chẩn ở giai đoạn IV trước khi điều trị I-131 lần đầu tiên. Trong số 7 bệnh nhân, 4 bệnh nhân được chẩn đoán kháng điều trị I-131 với tiêu chuẩn I, chiếm 57% sau đó là tiêu chuẩn IV với 2 bệnh nhân chiếm 28,6% còn lại 1 bệnh nhân được chẩn đoán với tiêu chuẩn II với tỷ lệ 14,3%. Các tổn thương tái phát/di căn được phát hiện tại các vị trí như giường tuyến giáp, hạch, phổi và xương. Trong các vị trí tổn thương phát hiện được, phổi và hạch là hai vị trí hay gặp nhất với tỷ lệ 85,7% và 71,4%.
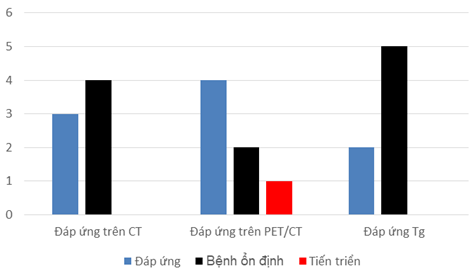
Biểu đồ 1. Kết quả đánh giá đáp ứng điều trị trên hình ảnh PET/CT, CT và đáp ứng Tg
Trên hình ảnh CT, tiêu chuẩn RECIST phát hiện được 3/7 trường hợp có đáp ứng một phần sau điều trị đích, 4/7 trường hợp bệnh ổn định. Phương pháp đánh giá đáp ứng sinh học dựa vào Tg (thyroglobulin) huyết thanh phát hiện phần lớn các bệnh nhân (5/7) ở tình trạng bệnh ổn định và 02/7 bệnh nhân có đáp ứng một phần.
Như vậy, phương pháp đánh giá RECIST và marker ung thư chỉ phát hiện được các bệnh nhân đáp ứng một phần và bệnh ổn định, không có bệnh tiến triển sau điều trị. Tuy nhiên, PET/CT phát hiện được thêm 01 bệnh nhân có đáp ứng điều trị so với CT nâng số bệnh nhân đáp ứng điều trị lên 04/7 so với 03/7 trên CT. Bên cạnh đó PET/CT còn phát hiện được 01 bệnh nhân có tiến triển sau điều trị so với CT và marker Tg. Sau khi chụp PET/CT đánh giá đáp ứng đã có 02/7 (28.5%) bệnh nhân được thay đổi nhận định điều trị, trong đó 01 bệnh nhân không đáp ứng điều trị đích được thay đổi chiến thuật điều trị khác.
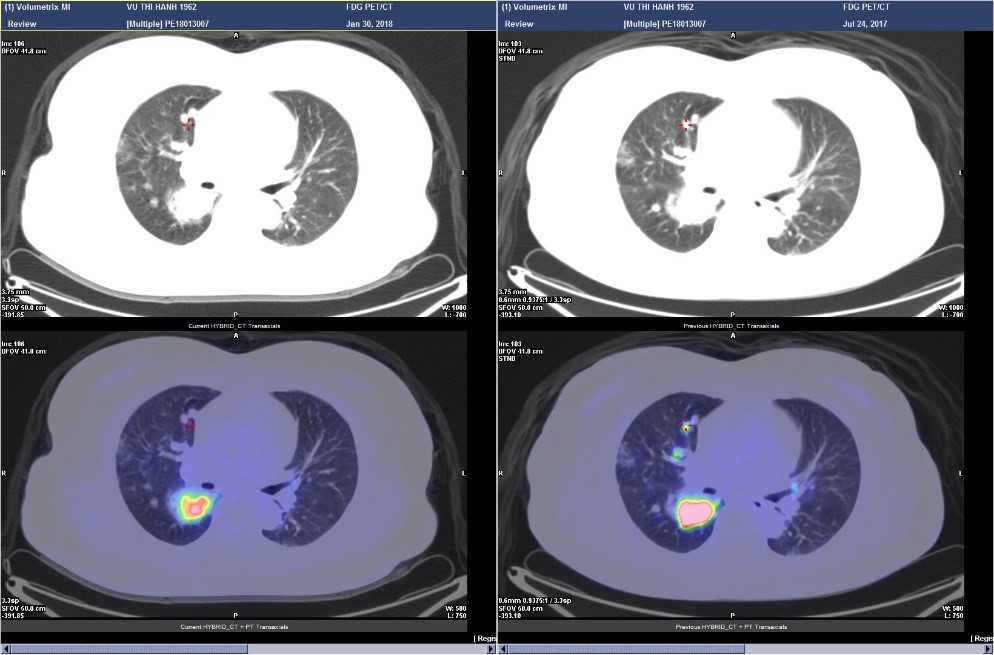
Hình 1. Bệnh nhân Vũ T.T, nữ, 53 tuổi, được chẩn đoán UTTG kháng điều trị I-131 và điều trị sorafenib. Trước điều trị bệnh nhân có di căn hạch cổ và nhiều vị trí tại hai phổi, sau điều trị các nốt và khối mờ ở phổi không giảm về kích thước nhưng lại giảm rõ rệt về chuyển hóa tương ứng với tình trạng đáp ứng về chuyển hóa.
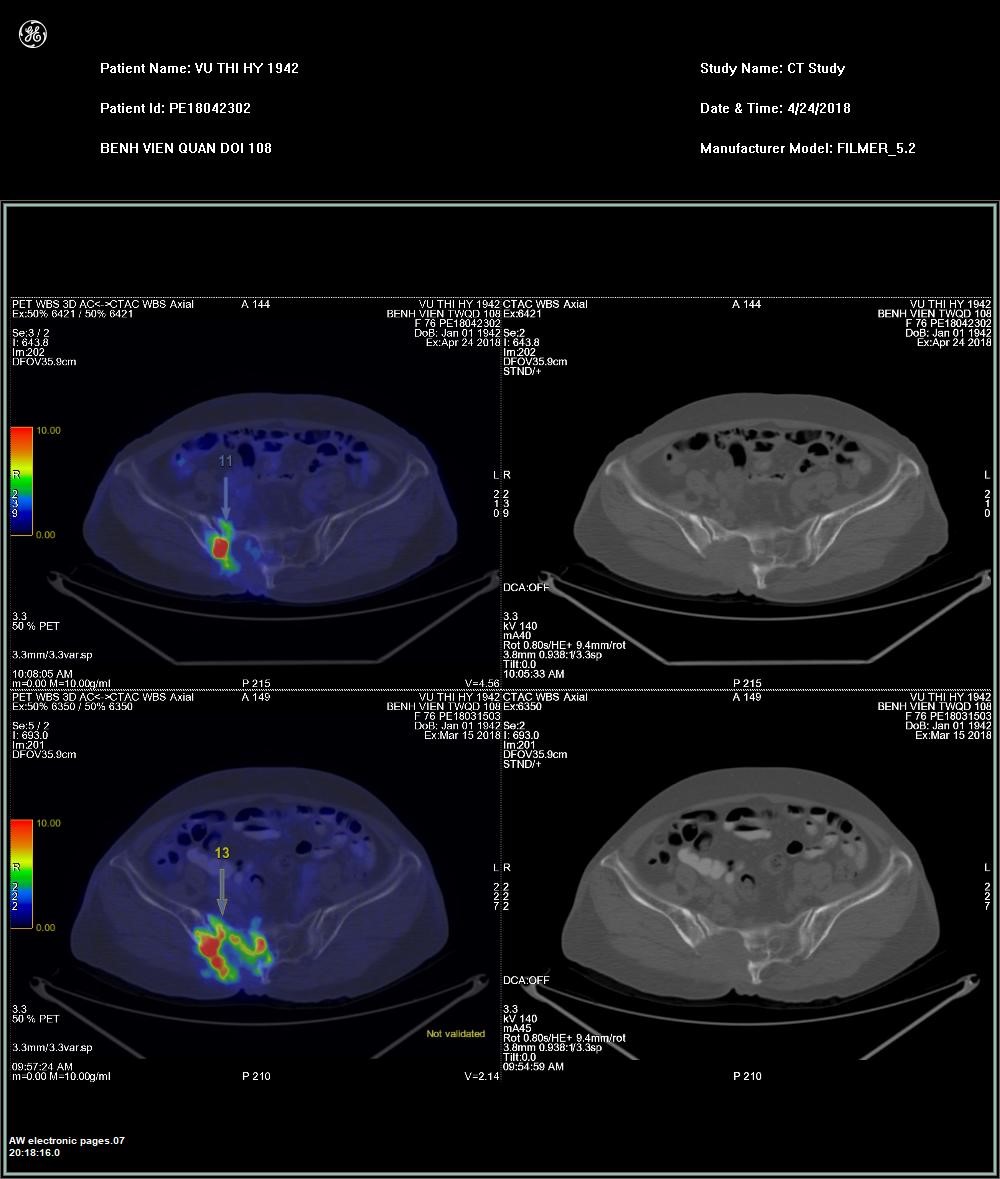
Hình 2. Bệnh nhân Vũ T.H, nữ, 38 tuổi, được chẩn đoán UTTG kháng I-131 có di căn nhiều vị trí ở phổi và xương. Sau điều trị sorafenib, tổn thương hủy xương tại xương chậu không thay đổi về diện xâm lấn trên CT nhưng giảm rõ rệt về chuyển hóa FDG sau điều trị.
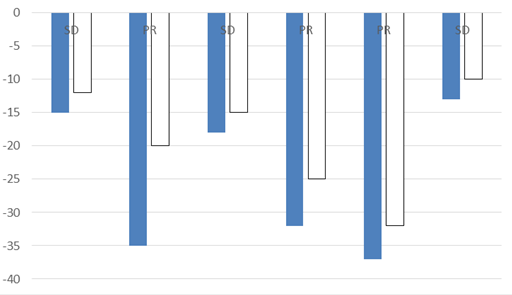
Biểu đồ 3. Sự thay đổi của kích thước và mức độ ngấm thuốc cản quang tại tổn thương của các bệnh nhân bệnh ổn định và đáp ứng một phần trên CT
(SD: bệnh ổn định, PR: bệnh đáp ứng một phần)
RECIST cho phép đánh giá đáp ứng dựa vào sự thay đổi kích thước tổn thương trước và sau điều trị. Sau điều trị có 03/7 bệnh nhân có đáp ứng một phần, giảm > 30% kích thước tổn thương so với trước điều trị.
Sau điều trị % thay đổi về kích thước là 34,7% ở bệnh nhân đáp ứng một phần cao hơn so với 14,3% sự thay đổi về kích thước ở bệnh nhân bệnh ổn định, sự khác biệt có ý nghĩa thống kê với p=0.025. Sự thay đổi của mức độ ngấm thuốc cản quang trước và sau điều trị là 25,5% ở bệnh nhân đáp ứng một phần và 15,5% ở bệnh nhân bệnh ổn định. Sự khác biệt chưa có ý nghĩa về mặt thống kê.
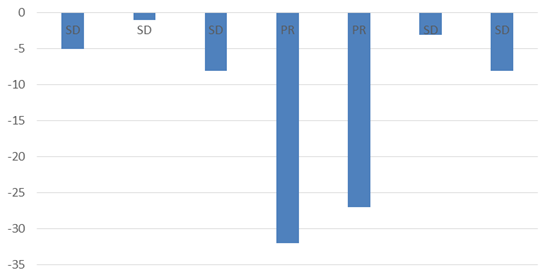
Biểu đồ 4. Đánh giá đáp ứng điều trị dựa theo sự thay đổi của Tg trước và sau điều trị
Sự biến đổi rõ rệt của Tg trước và sau điều trị chủ yếu được nhận thấy ở 02/7 (28,5%) bệnh nhân tương ứng với tình trạng bệnh đáp ứng một phần. Tuy nhiên, trong số bệnh nhân được cho là bệnh ổn định nếu dựa vào Tg là 5/7 (71,5%), có tới 03 bệnh nhân có đáp ứng một phần sau điều trị theo tiêu chuẩn PERCIST trên PET/CT.
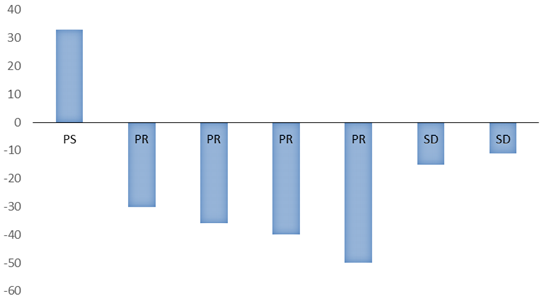
Biểu đồ 5. Sự biến đổi của SUV trước và sau điều trị
SUV ở bệnh nhân có bệnh tiến triển sau điều trị tăng ở mức > 30%, tương ứng với giá trị dương trên biểu đồ. Những bệnh nhân có đáp ứng sau điều trị có giảm SUV ở mức > 30%, tương ứng với giá trị âm trên biểu đồ. Bệnh nhân ổn định có giảm SUV, tuy nhiên sự thay đổi chỉ < 30% (SD: bệnh ổn định, PR: bệnh đáp ứng một phần).
Bảng 2. Mối liên quan giữa SUVmax và Tg tổn thương với đáp ứng sau điều trị
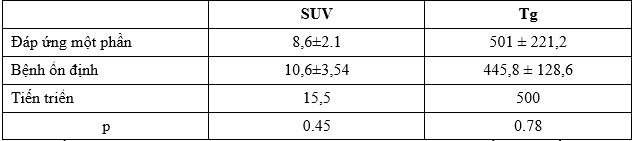
Chỉ số SUVmax trung bình ở bệnh nhân đáp ứng một phần trên PET/CT thấp hơn so với nhóm bệnh nhân ổn định và bệnh nhân tiến triển. Tuy nhiên sự khác biệt chưa có ý nghĩa thống kê. Chỉ số Tg ở bệnh nhân đáp ứng một phần trên PET/CT thậm chí còn lớn hơn so với nhóm bệnh nhân ổn định và tiến triển, sự khác biệt cũng chưa có ý nghĩa thống kê.
4. BÀN LUẬN
Điều trị I-131 vẫn là phương pháp phổ biến dành cho UTTG biệt hóa nhưng cho đến nay chưa có phương pháp nào thực sự hiệu quả đối với UTTG kháng điều trị I-131. Điều trị gene mới bắt đầu được thực hiện, nhắm vào các đột biến gây ra sự phát triển, duy trì và tiến triển của tế bào ung thư.
Các đột biến này rất đa dạng nhưng chủ yếu là đột biến gene BRAF trên con đường truyền tin MAPK gây ra sự tăng sinh của tế bào UTTG biệt hóa, làm mất tính biệt hóa và kháng với I-131.
Sorafenib là thuốc ức chế đa tyrosine kinase khôi phục con đường truyền tin MAPK làm giảm sự hoạt động của các tế bào UTTG đã mất tính biệt hóa và kháng I-131. Cơ chế điều trị chủ yếu dựa vào các quá trình đột biến ở ung thư tuyến giáp thể biệt hóa, tạo nên cơ sở vững chắc để điều trị đích cho bệnh nhân UTTG kháng I-131.
Điều trị sorafenib pha III đã được công bố trong nghiên cứu M.Brose và cộng sự từ 2014 [3].
Nghiên cứu của chúng tôi lựa chọn các bệnh nhân được khuyến cáo điều trị đích theo hướng dẫn của hiệp hiệp UTTG Hoa Kỳ 2015. Trong nghiên cứu của mình, chúng tôi bước đầu xác định vai trò của sorafenib trong thực hành điều trị bệnh nhân UTTG thể biệt hóa kháng I-131 mà không thể điều trị được bằng các phương pháp tại chỗ như phẫu thuật và xạ trị.
Dựa vào các phương pháp chẩn đoán hình ảnh có vai trò rất quan trọng đối với việc quyết định sự dụng sorafenib cho bệnh nhân hay không.
Như chúng ta đã biết, điều trị trúng đích có thể mang lại hiệu quả nhưng độc tính của thuốc lại không hề nhỏ. Nếu không xác định được các bệnh nhân đáp ứng sớm thì điều trị đích sẽ không mang lại hiệu quả cho bệnh nhân.
Cho đến nay, các nghiên cứu có đề cập đến đáp ứng điều trị đích ở bệnh nhân UTTG chủ yếu vẫn sử dụng tiêu chuẩn RECIST (tiêu chuẩn đánh giá dựa vào sự thay đổi kích thước khối u).
Trong khi đó, tiêu chuẩn PERCIST có thể đánh giá sớm đáp ứng điều trị thì vẫn còn chưa được áp dụng rộng rãi do giá thành chụp PET/CT cao và khả năng ứng dụng thực tế còn nhiều khó khăn.
Nghiên cứu của Marotta VS và cộng sự thực hiện chỉ trên 17 bệnh nhân, áp dụng PET/CT để đánh giá sớm đáp ứng sau điều trị cho thấy sorafenib có hiệu quả ở 71% bệnh nhân [10].
Trong số các bệnh nhân có lợi ích sau điều trị đích thì có tới 41% bệnh ổn định và 30% bệnh đáp ứng một phần theo tiêu chuẩn PERCIST.
Nghiên cứu của chúng tôi cho thấy 85,7% bệnh nhân có lợi ích sau điều trị sorafenib 1.5 tháng. Trong đó, 4/7 (57,1%) bệnh có đáp ứng một phần và 2/7 (28,5%) bệnh ổn định sau điều trị. Tỷ lệ đáp ứng trong nghiên cứu của chúng tôi cao hơn so với nghiên cứu của Marotta VS.
Bên cạnh đó, nghiên cứu của chúng tôi còn phát hiện được 01 bệnh nhân có bệnh tiến triển sau điều trị và không có chỉ định tiếp tục điều trị đích.
So sánh với các tiêu chuẩn đánh giá RECIST và đáp ứng sinh học, PERCIST có thể phát hiện sớm hơn sự thay đổi về đáp ứng do cơ chế đánh giá dựa vào chuyển hóa 18-FDG tại tổn thương.
Sự bắt giữ FDG của tổ chức có liên quan chặt chẽ với số lượng tế bào ung thư trong nó. Cụ thể là, chuyển hóa 18FDG sẽ tăng nếu số lượng tế bào ung thư, thể tích khối u tăng và ngược lại bởi vì tế bào ung thư sẽ tiêu thụ nhiều đường (glucose) hơn tế bào bình thường, đặc biệt khi bệnh tiến triển.
Do đó PET (positron emission tomography) phát hiện được những tổn thương ác tính sớm hơn sự biểu hiện trên hình ảnh giải phẫu của CT. Với công nghệ hiện nay, ngưỡng kích thước tối thiểu của tổn thương phát hiện được trên PET là 4mm tương đương khối lượng 0,1-0,5g, số lượng 108 – 109 tế bào. Chính vì vậy, sau khi kết thúc điều trị, hình ảnh PET âm tính cho tiên lượng tốt (số lượng tế bào ác tính chỉ còn từ 107 ) và ngược lại PET dương tính dự báo khả năng tổ chức ung thư còn tồn dư là rất cao.
Bên cạnh đó, thời điểm chụp PET cũng rất quan trọng vì nó phản ánh số lượng tế bào ung thư bị diệt, từ đó tiên lượng được điều trị ở những thời điểm tiếp theo. Đồng thời, những thay đổi về chuyển hóa FDG thường nhanh hơn thay đổi về mặt kích thước tổn thương sau điều trị.
Theo nghiên cứu của Marotta VS và cộng sự, đánh giá định lượng mức độ hấp thu 18-FDG tại tổn thương sau điều trị sorafenib mang lại lợi ích lâm sàng nhiều hơn các phương pháp đánh giá khác.
Trong nhiên cứu này, nếu dựa vào Tg thì số bệnh nhân có đáp ứng sẽ thấp hơn so với RECIST và PERCIST. Hơn nữa, đánh giá đáp ứng điều trị theo RECIST, không phát hiện được các tổn thương không đáp ứng với điều trị nhưng chưa tăng về kích thước mà chỉ biểu hiện ở mức độ về mặt chuyển hóa. Bên cạnh đó SUV ban đầu tại tổn thương cũng có ý nghĩa tiên lượng đáp ứng điều trị.
Nghiên cứu của chúng tôi cũng cho thấy, SUV ở bệnh nhân đáp ứng điều trị thấp hơn so với bệnh nhân không đáp ứng. Tuy nhiên, do số lượng bệnh nhân còn ít nên cần phải có các nghiên cứu tiếp theo để làm rõ giá trị của SUV trong tiên lượng đáp ứng điều trị.
Đối với các bệnh lý ung thư khác, như ung thư vòm họng, ung thư phổi, SUV được cho rằng có vai trò trong tiên lượng và đánh giá đáp ứng điều trị sớm.
5. KẾT LUẬN
Qua nghiên cứu bước đầu, 18-FDG PET/CT cho phép đánh giá sớm hơn đáp ứng với điều trị sorafenib ở bệnh nhân UTTG kháng I-131 so với các phương pháp khác. Từ đó, các bác sĩ lâm sàng có thể xác định các bệnh nhân có và không có lợi ích với điều trị để giảm giá gánh nặng về kinh tế, độc tính cho bệnh nhân.
Bên cạnh đó, định lượng chỉ số SUV bước đầu có giá trị tiên lượng đáp ứng sau điều trị. Tuy nhiên, cần phải có các nghiên cứu với số bệnh nhân lớn và theo dõi lâu dài hơn.
TÀI LIỆU THAM KHẢO
- Phạm Thị Minh Bảo Lê Ngọc Hà và cộng sự (2006), “Một số kinh nghiệm điều trị ung thư tuyến giáp biệt hóa sau phẫu thuật bằng I-131 tại Bệnh viện Trung ương Quân đội 108 từ 1999 đến 2005”, Y học lâm sàng Chuyên đề Y học Hạt nhân và Ung thư, tr. 30 – 37.
- Boellaard R. và các cộng sự. (2010), “FDG PET and PET/CT: EANM procedure guidelines for tumour PET imaging: version 1.0“, Eur J Nucl Med Mol Imaging. 37(1), tr. 181-200.
- Brose M. S. và các cộng sự. (2014), “Sorafenib in radioactive iodine-refractory, locally advanced or metastatic differentiated thyroid cancer: a randomised, double-blind, phase 3 trial“, Lancet. 384(9940), tr. 319-28.
- Cooper D. S. và các cộng sự. (2009), “Revised American Thyroid Association management guidelines for patients with thyroid nodules and differentiated thyroid cancer“, Thyroid. 19(11), tr. 1167-214.
- Haugen B. R. và các cộng sự. (2016), “2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer: The American Thyroid Association Guidelines Task Force on Thyroid Nodules and Differentiated Thyroid Cancer“, Thyroid. 26(1), tr. 1-133.
- Schoder H. và các cộng sự. (2009), “PET monitoring of therapy response in head and neck squamous cell carcinoma“, J Nucl Med. 50 Suppl 1, tr. 74S-88S.
- Hundahl SA Fleming ID, Fremgen AM & Menck HR. (1998), “A National Cancer Data Base Report on 53,856 cases of thyroid carcinoma treated in the U.S., 1985–1995“, Cancer. 832, tr. 2638–2648.
- MJ Schlumberger (1998), “Papillary and follicular thyroid carcinoma.“, New England Jour nal of Medicine. 338, tr. 297–306.
- Pacini F Schlumberger M, Dralle H, Elisei R, Smit JW & Wier singa W. (2006), “European consensus for the management of patients with differentiated thyroid carcinoma of the follicular epithelium.“, European Journal of Endocrinology. 154, tr. 787–803.
- Vincenzo Marotta và các cộng sự. (2013), “Sorafenib in advanced iodine‐refractory differentiated thyroid cancer: efficacy, safety and exploratory analysis of role of serum thyroglobulin and FDG‐PET“, Clinical Endocrinology. 78(5), tr. 760-767.
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam