BỆNH XƯƠNG ĐÁI THÁO ĐƯỜNG
GS.TS. Nguyễn Hải Thủy
Trường Đại học Y Dược Huế
SUMMARY
Diabetic Osteopathy
Diabetes mellitus and osteoporosis may occur simultaneously by chance. Diabetes mellitus is associated with decreased bone strength as well as increased fracture risk. Diabetic osteopathy is the pathology linking between diabetes mellitus and bone. It appears to be mediated by complex pathways, including the insulin-insulin growth factors system, accumulation of advanced glycation endproducts in bone collagen, microangiopathy, and increased bone marrow fat content. Bone mineral density is decreased in type 1 diabetes, but bone fragility in type 2 diabetes, depends on bone quality deterioration rather than bone mass reduction. Thus, surrogate markers and examination methods are needed to replace the insensitivity of BMD in assessing fracture risks of T2DM patients. Also, at least in T2DM, the classical diagnosis of osteoporosis by dual-energy X-ray absorptiometry and the fracture risk estimation by FRAX (fracture risk assessment tool) are only partially useful in assessing fracture risk. Trabecular bone score (TBS) and trabecular bone score- adjusted FRAX offer an enhanced estimation of fracture risk in these patients. One reason for the occurrence of more fractures despite higher bone density in T2D could be an increasedrisk of trauma, which is possibly linked to hypoglycemia or an increased number of falls because of complications from impaired eyesight, cerebral ischemia, and poor balance resulting from neuropathy. Adequate glycemic control is generally associated with decreased fracture risk, with the exception of specific antidiabetics (thiazolidinediones, canagliflozin) that have been shown to have a detrimental effect. Besides optimal glycemic control, general
recommendations regarding adequate dietary calcium and Vit.D intake, regular exercise, adequate treatment for diabetes and avoidance of other potential risk factors should be given. Most currently used antiosteoporotic treatments seem equally effective in diabetic patients as compared with patients without diabetes, but clinical data regarding the reduction in fracture risk specifically in patients with diabetes mellitus are lacking.
Chịu trách nhiệm chính: Nguyễn Hải Thủy
Ngày nhận bài: 01/8/2018
Ngày phản biện khoa học: 18/8/2018
Ngày duyệt bài: 31/8/2018
I. ĐẶT VẤN ĐỀ
ĐTĐ là bệnh lý mãn tính trong đó tăng glucose máu kéo dài gây tổn thương, rối loạn chức năng và suy yếu các cơ quan. Trên thế giới hiện có 382 triệu người mắc bệnh ĐTĐ và đến năm 2035 con số này sẽ tăng lên 592 triệu người.
Ngoài ra hơn 316 triệu người Tiền ĐTĐ và dự báo 471 triệu vào năm 2035.Số người mắc bệnh ĐTĐ týp 2 đang gia tăng ở mọi quốc gia và 5,1 triệu người ĐTĐ chết trong năm 2013.
Biến chứng ĐTĐ từ lâu được quan tâm chủ yếu là tim mạch bao gồm biến chứng mạch máu nhỏ như bệnh thận, bệnh võng mạc, bệnh thần kinh ĐTĐ và bệnh mạch máu lớn như bệnh mạch vành bệnh ĐM 2 chi dưới, ĐM thận và mạch máu não.
Tăng đường máu nói riêng và các yếu tố liên quan bệnh ĐTĐ nói chung cũng ảnh hưởng đến chu chuyển xương và tính toàn vẹn xương gây ra bệnh lý xương trên người bệnh ĐTĐ được gọi bệnh xương đái tháo đường (diabetic osteopathy)cũng là một biến chứng nghiêm trọng mà từ lâu tại Việt Nam thường ít quan tâm.
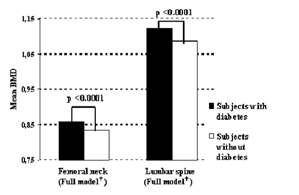
Biểu đồ 1. BMD đo tại cổ xương đùi và cột sống của bệnh nhân ĐTĐ cao hơn so với người không ĐTĐ
Tất cả các thể ĐTĐ đều có tác động đến nguy cơ gãy xương liên quan đến loãng xương[1-2], trong đó bệnh nhân ĐTĐT2 thường có mật độ khoáng xương (BMD) bình thường hoặc cao. Vì vậy, bệnh ĐTĐcó thể liên quan đến việc giảm độ bền của xương nhưng không phản ánh hoàn toàn khi đo BMD[3].
Nhiều nghiên cứu ghi nhận ĐTĐT2 có liên quan đến tăng nguy cơ gãy xương đùi ở cả nam giới với chỉ số nguy cơ tương đối (RR)
2.8 và nữ là 2.1. Kết quả phù hợp các nghiên cứu được thực hiện tại Hoa Kỳ và châu Âu. Mối liên quan giữa thể bệnh ĐTĐ và gãy xương đùi trong ĐTĐ týp 1 với RR= 6.3, cao hơn so với ĐTĐ týp 2 với RR= 1.7.Vestergaard và CS ước tính tỷ lệ nguy cơ ĐTĐ và gãy xương đùi là 1,38 đối với ĐTĐT2 và 6,94 đối với ĐTĐT1. Ngoài ra tăng nguy cơ gãy xương ngoài cột sống (nonspine fracture) cũng đã được ghi nhận ở ĐTĐT2 [4].
Nghiên cứu 109.983 Y tá trong độ tuổi 34- 59 và theo dõi 22 năm đối với biến chứng gãy xương đùi ghi nhận cả ĐTĐ týp 1 và typ 2 có liên quan đến tăng nguy cơ gãy xương đùi. Kết quả của nghiên cứu này nhấn mạnh sự cần thiết phải có chiến lược phòng chống gãy xương ở tất cả bệnh nhân ĐTĐ [5].
Loãng xương được định nghĩa là một bệnh lý với đặc điểm khối lượng xương suy giảm, vi cấu trúc của xương bị hư hỏng, dẫn đến tình trạng xương bị yếu và hệ quả là tăng nguy cơ gãy xương.Dựa trên định nghĩa loãng xương hiện nay, cả mật độ xương và chất lượng xương, bao gồm các tính chất về cấu trúc và cơ chất của xương, là những yếu tố quan trọng trong việc xác định độ bền của xương.
Bệnh xương ĐTĐ là một bệnh đồng mắc của bệnh nhân ĐTĐ và được đặc trưng bởi những thay đổi kiến trúc vi mô làm giảm chất lượng xương dẫn đến tăng nguy cơ gãy xương ở các týp ĐTĐ.
Hiện nay, chẩn đoán loãng xương dựa trên đo mật độ khoáng xương (BMD) Đo hấp phụ năng lượng tia X kép (Dual Energy Xray Absorptiometry- DEXA, DXA).Kết quả được báo cáo có sự khác biệt, trong độ lệch chuẩn (SD), Khối lượng xương đỉnh (Peak Bone Mass) (T-score). Theo Tổ chức Y tế Thế giới (WHO) định nghĩa loãng xương khi chỉ số BMD < – 2,5.
Giảm BMD có giá trị dự báo nguy cơ loãng xương. Tuy nhiên, mặc dù được sử dụng rộng rãi nhưng hạn chế chính của BMD là sự chồng chéo đáng kể về BMD giữa đối tượng có và không có gãy xương. Giải thích cho điều này là BMD không phản ảnh tất cả các yếu tố góp phần vào độ bền của xương. Trong số các yếu tố này là vi cấu trúc xương xốp (trabecular), cũng là một yếu tố quyết định đáng kể độ cứng của xương và bổ sung cho mật độ xương. Một hạn chế khác của phép đo BMD là đánh giá không tương xứng với vỏ xương tùy thuộc vào vị trí đo đo, có tỷ lệ chu chuyển xương tương đối chậm.
Trong quá trình quét DXA một số thông số khác có thể giúp xác định những bệnh nhân có nguy cơ gãy xương cao, như chiều dài cổ xương đùi, góc cổ thân, moment quán tính thời điểm cắt ngang và độ dày vỏ xương. Ngoài ra, chúng phản ánh hình thái hoặc cấu trúc đại thể, vốn chịu ảnh hưởng của BMD. Đặc biệt trên bệnh nhân ĐTĐ có nhiều yếu tố nguy cơ vì thế tiêu chí phân loại loãng xương cần được sửa đổi bao gồm các yếu tố nguy cơ lâm sàng.
II. CƠ CHẾ BỆNH SINH BỆNH XƯƠNG ĐTĐ
Bệnh ĐTĐ tác động đến xương thông qua một số cơ chế, trong đó một số có thể có cơ chế tác động mâu thuẫn.Nhiều nghiên cứu ghi nhận nguy cơ gãy xương của ĐTĐT 1 do giảm BMD. Sự hình thành xương bị suy yếu này là kết quả của sự thiếu hụt insulin và yếu tố tăng trưởng giống insulin-1 (Insulin like Grow Factor-1), dẫn đến giảm khối lượng xương đỉnh (peakbone mass).
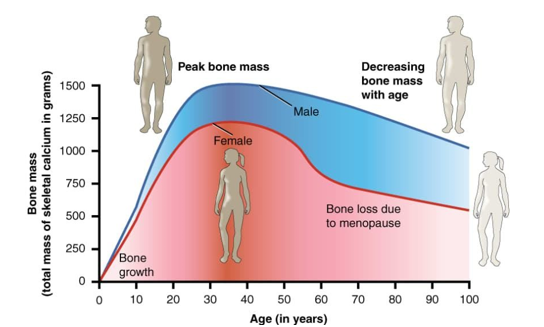 Biểu đồ 2. Khối lượng xương đỉnh (peakbone mass) thay đổi theo tuổi và sinh lý
Biểu đồ 2. Khối lượng xương đỉnh (peakbone mass) thay đổi theo tuổi và sinh lý
Ngoài ra một số bệnh tự miễn khác đi kèm với ĐTĐT 1 có thể dẫn đến một yếu tố nguy cơ bổ sung cho loãng xương và tăng nguy cơ gãy xương (loãng xương thứ phát) trong ĐTĐT 1 [6].
Ngược lại trong bệnh ĐTĐT 2, béo phì, tăng tải xương và kháng insulin làm tăng insulin máu dẫn đến tăng tạo xương. Vì thế trong ĐTĐT 2 chất lượng xương giảm hơn là giảm BMD. Tuy nhiên trong các thể ĐTĐ ghi
nhận xương kém chất lượng và độbền.
1. Rối loạn trong hình thành liên kết chéo của Collagen (Alterations in Collagen Cross-Link Formation)
Cơ chất xương bao gồm vật liệu hỗn hợp hai pha – pha khoáng (cung cấp độ cứng) và các sợi collagen (cung cấp độ bền, độ dẻo dai và biến dạng ) [7]. Sự liên kết chéo collagen đóng một vai trò quan trọng trong độ bền của xương [8].
 Biều đồ 3. Các dạng liên kết chéo của collagen tại xương
Biều đồ 3. Các dạng liên kết chéo của collagen tại xương
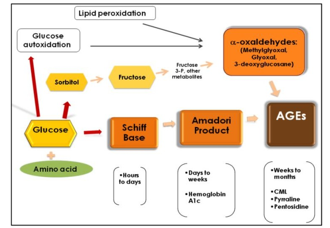
Collagen liên kết chéo có thể được chia thành liên kết chéo hai chiều có enzyme chưa thành thục qua trung gan lysyl-hydroxylasea và lysyl-oxidase, liên kết chéoba chiều thành thục và liên kết chéo Non-enzymatic do sự đường hóa (glycation) hoặc oxy hóa (AGEs) như là Pentosidine[9]. Các loại liên kết chéo này khác nhau về cơ chế hình thành và chức năng[10]. Không chỉ tăng đường huyết mà lại còn do Stress oxy hóa làm giảm sự liên kết chéo enzyme có lợi và tích tụ các AGE bất lợi trong xương.
Biều đồ 4. Liên kết chéo của collagen liên quan tăng glucose tại xương
2. Những thay đổi chất chỉ điểm chu chuyển xương (BTM)
Chu chuyển xương là một mối quan hệ kép giữa quá trình hình thành xương bởi các tạo cốt bào (tạo xương mới) và quá trình hủy xương bởi các hủy cốt bào (loại bỏ xương cũ). Các chất chỉ điểm xương gồm 2 nhóm tạo xương và hủy xương.
Các chất tạo xương bao gồm Osteocalcin (OCN), Phosphatase alkaline đặc hiệu xương (BAP), Phosphatase kiềm (AP), Procollagen type 1 amino terminal propeptide (P1NP), và Procollagen type 1 carboxyl terminal propeptide (P1CP),
Các chỉ điểm hủy xương bao gồm N terminal cross-linked telopeptide of type-I collagen (NTX) và C-terminal cross-linked telopeptide of type-I collagen (CTX). Một số
chất chỉ điểm như OC, CTX, và P1NP, cũng có thể thay đổi nồng độ đường máu hoặc thu nhận glucose, làm cho bệnh nhân ĐTĐ có ít chất chỉ điểm chu chuyển xương và có nhiều chất chỉ điểm rối loạn chuyển hóa glucose. Trong hầu hết các nghiên cứu về chỉ điểm chu chuyển xương, Osteocalcin, một chỉ điểm tạo xươngbị giảm trong ĐTĐT2. [7].
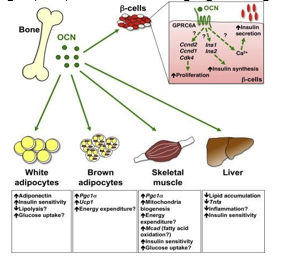
Biểu đồ 5. Vai trò sinh lý của Osteocalcin
Osteocalcin (OC), một trong những protein tiết ra đặc trưng của tạo cốt bào có một số đặc tính nội tiết tố và được tiết ra trong tuần hoàn thông thường từ các tạo cốt bào. Các nghiên cứu trên động vật ghi nhận tác động của uncarboxylated Osteocalcin (ucOC) liên quan đến chuyển hóa xương và chuyển hóa glucose và khối lượng chất mỡ[8-9]. Pittas et al. ghi nhận nồng độ OC huyết thanh có tương quan nghịch với glucose huyết tương lúc đói, insulin đói, HOMA-IR, hsCRP, interleukin-6, BMI và mỡ cơ thể [10].
Tuy nhiên, các chỉ điểm tạo xương khác không nhất thiết khác nhau ở bệnh nhân đái tháo đường. Các chỉ điểm hủy xương được báo cáo là gia tăng, giảm hoặc không khác biệt ở người bệnh ĐTĐ.
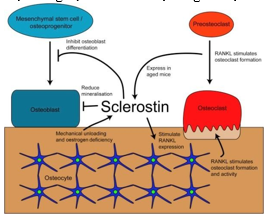
Biểu đồ 5. Vai trò sinh lý của Sclerostin
Ngoài ra chức năng thận, có thể ảnh hưởng đến việc định lượng một số chất chỉ điểm sinh học của chu chuyển xương và cũng ảnh hưởng đến hình thái mô học cấu trúc của xương.Việc thiếu sự khác biệt trong các chỉ điểm chu chuyển xương chỉ ra rằng ĐTĐT1 và ĐTĐT2 không khác nhau về hiệu ứng trên các chất chỉ điểm xương, mặc dù trong ĐTĐT2nồng độ Sclerostin (Scl) cao hơn, đề xuất xương bị ảnh hưởng thông qua hiệu ứng đối kháng theo hướng chuyển hóa Wnt trong ĐTĐT2, nhưng trong ĐTĐT1 thì không[11].
3. Osteoprotegerin và RANK(Receptor Activator of Nuclear factor Kappa B)
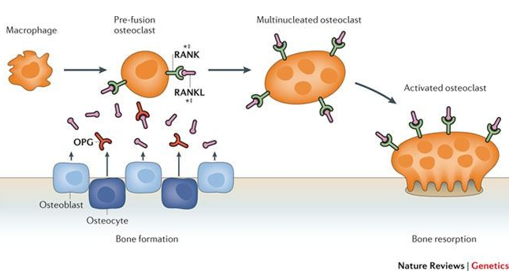 Biểu đồ 6. Liên quan giữa Osteoprotegerinvà RANK
Biểu đồ 6. Liên quan giữa Osteoprotegerinvà RANK
Nồng độ Osteoprotegerin (OPG) huyết thanh tăng đáng kể ở bệnh nhân ĐTĐ làm thúc đẩy
nhiều nghiên cứu liên quan giữa sản xuất/giải phóng OPG và nồng độ đường huyết [12].
 Biểu đồ 7. Liên quan giữa RANK và RANKL
Biểu đồ 7. Liên quan giữa RANK và RANKL
Osteoprotegerin là một protein thuộc họ thụ thể yếu tố hoại tử khối u (TNFR) có khả năng liên kết với RANKL (Receptor activator ofnuclear factor kappa B ligand), ngăn RANKL liên kết với RANK và ức chế sự thành lập hủy cốt bào. Gia tăng nồng độ Osteoprotegerin ở bệnh nhân ĐTĐT1 có thể là do phản ứng của cơ thể đối tăng hủy xương. Nồng độ huyết thanh OPG cũng tăng đáng kể ở bệnh nhân ĐTĐT2 so với những người khỏe mạnh hiến máu [12].
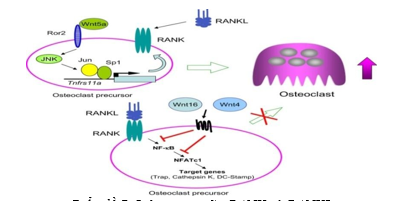
4. Đường dẫn tín hiệu Wnt
Tín hiệu Wnt cũng được cho là một tính năng gây bệnh loãng xương trong ĐTĐ.Tín hiệu WNT đã được chứng minh là một con đường điều tiết quan trọng trong sự biệt hóa về tạo xương của các tế bào gốc trung mô
không chỉ trong sự phát triển của phôi mà còn trong việc duy trì và phân biệt tế bào gốc ở độ tuổi trưởng thành.
Kích hoạt con đường tín hiệu Wnt thúc đẩy sự tạo xương trong khi bất hoạt của con đường Wnt dẫn đến tình trạng loãng xương.
Kích hoạt và bất hoạt tính quang sai lạc của đường tín hiệu Wnt chuẩn trong tạo xương gây xơ cứng và loãng xương.
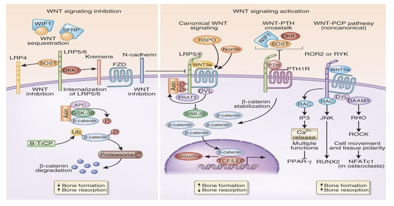 Biểu đồ 8. Đường dẫn tín hiệu Wnt
Biểu đồ 8. Đường dẫn tín hiệu Wnt
Mani et al. đã chỉ ra rằng một đột biến đơn lẻ trong Protein 6 liên quan thụ thể LDL.(LDL.R), đồng thụ thể cho con đường tín hiệu Wnt, có liên quan về mặt di truyền với bệnh loãng xương cũng như ĐTĐ, rối loạn lipid máu và bệnh mạch vành. Ngoài ra, một số nghiên cứu đã ghi nhận rằng yếu tố phiên mã đặc hiệu tế bào T4 (TCF-40), đồng hành của þ- catenin trong con đường tín hiệu WNT kinh điển, là gen nhạy cảm mạnh nhất ĐTĐT2[13].
5. Yếu tố di truyền.
Mật độ khoáng xương bị ảnh hưởng bởi các yếu tố di truyền. Sự đa hình gen A1-type- 1-collagen (COL1A1) ở bệnh nhân ĐTĐT1 có liên quan với giảm BMD ở cổ xương đùi và giảm nồng độ vitamin D huyết thanh so với nhóm chứng [38]. Sự đa hình của gen thụ thể Vitamin D cũng ảnh hưởng trên BMD ở bệnh nhân ĐTĐ[14].
III. YẾU TỐ NGUY CƠ
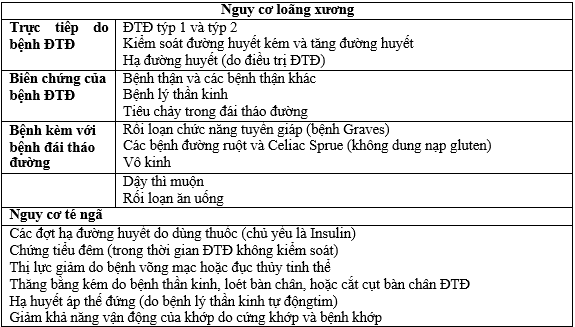
Các yếu tố nguy cơ bất thường cho gãy xương do loãng xương được biết đến và chúng được liệt kê trong Bảng 1 như sau.
Bảng 1. Các YTNC gãy xương do loãng xương ở bệnh ĐTĐ
Tăng đường huyết tác động lên các tế bào mô xương làm tăng sản xuất Interleukin-6 (IL-6) trong dòng tạo cốt bào (osteoblast) và IL-6 kích thích hủy cốt bào (osteoclasts) gây hủy xương. Tăng đường máu làm tăng sự tích lũy của các sản phẩm đường hóa bậc cao (AGEs) trong collagen dẫn đến giảm chất lượng xương và độ bền xương. Hơn nữa, collagen gắn đường sẽ gây ức chế sự biểu hiện các tạo cốt bào[15].
Mối liên quan giữa tăng đường huyết và nguy cơ gãy xương dường như không tuyến tính. Các nghiên cứu đã báo cáo không tăng nguy cơ, hoặc thậm chí giảm nguy cơ , khi so sánh những người có rối loạn dung nạp glucose với những người có đường huyết bình thường.
Bên cạnh đo tăng thải glucose niệu còn có một tác dụng gián tiếp khác của tăng đường huyết, gây tăng đào thải calci niệu, dẫn đến giảm khối lượng canxi trong cơ thể và giảm chất lượng xương và gây gãy xương. Trong số những người mắc bệnh ĐTĐ, không thấy có mối liên quan rỏ giữaHbA1C và nguy cơ gãy xương qua các nghiên cứu.
2. Insulin
Insulin là hormon đồng hóa , tác động trên xương thông qua các thụ thể insulin trên tạo cốt bào loại 1 và 2 (osteoblasts – IRS-1 và IRS-2 (chất nền giống insulin). Kích thích của IRS-1 ảnh hưởng đến chu chuyển xương, trong khi kích thích IRS-2 thay đổi sự cân bằng giữa sự tạo xương hơn là hủy xương. Insulin kích thích sự tăng sinh tạo cốt bào, bất hoạt p27, thúc đẩy quá trình tổng hợp collagen và tăng thu nhận glucose. Tăng insulin trong ĐTĐT2 (tác dụng kích thích của insulin lên sự tạo xương) cùng với sự đề kháng insulin làm tăng khối lượng xương thông qua các tác động lên sự tạo xương thông qua các thụ thể bề mặt IRS-1 và IRS-2 trên tạo cốt bào và bằng cách giảm nồng độ globulin gắn kết hormone giới tính (SHBG), dẫn đến tăng nồng độ Estradiol và Testosterone[16].
Trong ĐTĐT1, do sự thiếu hụt insulin và Insulin like Grow Factor-1(IGF-1), ngay từ khi chẩn đoán, dẫn đến giảm tạo xương, gây khoáng hóa bất thường, vi cấu trúc xương bất thường làm xương yếu và giảm khối lượng xương đỉnh.
3. Hạ đường huyết và thuốc hạ đường huyết
Nguy cơ gãy xương ở bệnh nhân ĐTĐ cũng bị ảnh hưởng bởi tần suất của hạ đường huyết, nhất là hạ đường huyết không có các triệu chứng báo trước. Mặc dù hạ đường huyết có thể xảy ra khi bệnh nhân sử dụng nhóm sulfonylurea, tuy vậy nguy cơ bị té ngã với nồng độ HbA1C thấp còn liên quan đến sử dụng insulin .
Bên cạnh đó các thuốc điều trị đường huyết còn có thể ảnh hưởng nguy cơ gãy xương theo nhiều cách. Thật vậy sử dụng nhóm Metformin không liên quan đến tỷ lệ cao gãy xương. Tuy nhiên tỷ lệ gãy xương cao hơn ở nhóm bệnh nhân dùng nhóm Glitazone (TZDs). TZD hoạt động như chất kích thích của thụ thể nhân nhóm hoạt hóa tăng sinh peroxisome gamma (PPAR-y) và có thể làm giảm mật độ xương thông qua sự ức chế sự biệt hóa và hoạt động của các tạo cốt bào. Trong thực tế, hoạt hóa PPAR-y gây ra sự biệt hóa của tế bào gốc trung mô thành tế bào mỡ, chứ không phải là tạo cốt bào và làm cho các tạo cốt bào chết theo chương trình[17-18]. Mặt khác, do tác dụng TZD làm giảm nồng độ insulin máu và do đó giảm tác dụng đồng hóa của insulin lên xương.
Tỷ lệ gãy xương cao hơn đã được báo cáo ở những bệnh nhân được điều trị bằng insulin so với các bệnh nhân không được điều trị bằng insulin [19].
Tuy nhiên nhóm incretin (chất chủ vận thụ thể GLP-1 và chất ức chế DPP-4) lại có tác dụng có lợi cho xương, có thể do hoạt động đồng hóa xương của GLP-1 có thể hoặc trực tiếp hoặc gián tiếp thông qua sự tham gia của các tế bào C tuyến giáp. Các tế bào C được biết đến chủ yếu để sản xuất calcitonin, một loại hormon giảm calci và giảm phosphate. Calcitonin ức chế sự hủy xương bằng cách ức chế hoạt động của các hủy cốt bào. Một số nghiên cứu ghi nhận GLP-1 và các hormon incretin khác, chẳng hạn như GIP hoặc GLP- 2, có thể có tác dụng tích cực trên xương thông qua tính chống hủy xương và có thuộc tính đồng hóa, cho thấy tác dụng có lợi của thuốc chủ vận GLP-1R hoặc chất ức chế DPP-4 trên chuyển hóa xương.[35]
Các cơ chế phân tử liên quan đến con đường chuyển hóa Wnt/beta-catenin, tỷ OPG/RANKL (osteoprotegerin /receptor activator of nuclear factor kappa B ligand ) và nồng độ Sclerostin[20].
4. Vitamin D
Hầu hết các nghiên cứu tại nhiều nơi khác nhau đều ghi nhận tình trạng thiếu vitamin D ở những người bệnh ĐTĐ nhiều hơn so với người không ĐTĐ. Nguyên nhân thiếu hụt vitamin D trong ĐTĐ bao gồm tố chất di truyền (ĐTĐT1), tăng BMI (ĐTĐT2), albumin niệu (ĐTĐT 1 hoặc ĐTĐT2), hoặc bài tiết quá mức các chất chuyển hóa vitamin D hoặc protein liên kết vitamin D (ĐTĐT1, ĐTĐT2) [21-22].
5. Thừa cân béo phì.
Chỉ số BMI thấp có liên quan đến giảm BMD, khả năng tăng loãng xương và nguy cơ gãy xương [64]. Một đa phân tích gộp cho thấy BMI cũng là một yếu tố dự báo
quan trọng của BMD trong ĐTĐT2. Thừa cân và béo phì được cho là yếu tố bảo vệ của BMD. Béo phì, phổ biến ở ĐTĐT2, có liên quan mật thiết với BMD cao hơn có thể thông qua tải trọng cơ học và các yếu tố nội tiết tố như insulin, estrogen và leptin [23].
Nghiên cứu GLOW (Global Longitudinal study of osteoporosis in Women) cho thấy nguy cơ gãy xương, chiều cao, cân nặng và chỉ số BMI khác nhau theo vị trí gãy xương. Có sự tương quan tuyến tính nghịch giữa BMI và gãy xương cổ tay, tương quan tuyến tính dương giữa BMI và gãy xương sống và không có mối liên quan đáng kể giữa BMI và gãy xương phần trên cẳng chân[24].
6. Biến chứng của ĐTĐ
Một số nghiên cứu đã báo cáo về các biến chứng liên quan đến bệnh ĐTĐ như là yếu tố nguy cơ gãy xương ở những người có ĐTĐT2, nhưng kết quả không nhất quán. Sự phát triển của bệnh loãng xương ở cả hai loại bệnh ĐTĐ cũng được thúc đẩy bởi sự cùng tồn tại của các biến chứng mạch máu mãn tính, cũng ảnh hưởng đến các mạch máu tủy xương[25].
IV. THỰC HÀNH LÂM SÀNG BỆNH XƯƠNG ĐÁI THÁO ĐƯỜNG.
Chủ yếu ĐTĐ người cao tuổi 2 dễ bị té ngã hơn, nhưng ít được biết về các yếu tố nguy cơ té ngã trong quần thể này. Nguy cơ té ngã cao hơn và gãy xương ở bệnh nhân đái tháo đường do bệnh võng mạc ĐTĐ hoặc đục thủy tinh thể, làm giảm thị lực. Ở những bệnh nhân có bệnh thần kinh vận động cảm giác cùng với bệnh bàn chân đái tháo đường, rối loạn thăng bằng và té ngã cũng được ghi nhận.
Patel et al. gợi ý rằng giảm cảm giác rung (bệnh thần kinh ngoại vi) là một yếu tố nguy cơ quan trọng cho việc té ngã. Các tác giả cũng kết luận rằng siêu âm định lượng (QUS), DXA, có thể là một phương pháp hữu ích hơn để dự đoán nguy cơ gãy xương ở những phụ nữ ĐTĐ lớn tuổi.
Điều trị bằng insulin cũng liên quan đến việc té ngã, có thể do bệnh nặng hơn và/hoặc các đợt hạ đường huyết[26].
Trong ĐTĐT1, nguy cơ gãy xương tăng có thể do giảm BMD, vì vậy quy trình chẩn đoán cơ bản và tiêu chuẩn vàng để chẩn đoán loãng xương và nhóm nguy cơ của bệnh nhân đái tháo đường là DXA.
Trong ĐTĐT2, nguy cơ gãy xương do loãng xương cao hơn có thể là kết quả của chất lượng xương kém hơn, cấu trúc vi mô và đại thể bị suy giảm và có xu hướng giảm. Cần phải làm rõ việc sử dụng các phương pháp chuẩn để đánh giá nguy cơ gãy xương trong ĐTĐT2.
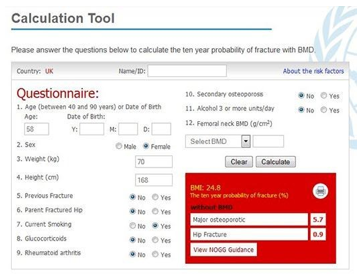
Bảng 1. Thang điểm FRAX đánh giá nguy cơ tuyệt đối 10 năm của gãy xương đùi và loãng xương
Đánh giá nguy cơ tuyệt đối 10 năm của gãy xương đùi và loãng xương có thể được tính toán bằng thang điểm FRAX. (Fracture Risk Assessment Tool). Điểm số của The FRAX được thiết kế để dự đoán nguy cơ tuyệt đối 10 năm của gãy xương đùi và loãng xương bằng cách sử dụng BMD của cổ xương đùi và các yếu tố nguy cơ lâm sàng khác của gãy xương[27].
Thang điểm FRAX bao gồm chỉ số BMD cổ xương đùi, tuổi, giới tính, chỉ số khối cơ thể, tiền sử gãy xương, tiền sử gia đình gãy xương đùi, đang hút thuốc lá, sử dụng corticosteroids gần đây, viêm khớp dạng thấp và uống ít nhất 3 đơn vị có cồn mỗi ngày. Schwartz et al. cho thấy trong một nghiên cứu rằng BMD cổ xương đùi và FRAX đều liên quan đến nguy cơ gãy xương ở người ĐTĐT2 lớn tuổi và cả hai phương pháp đều có ích để đánh giá lâm sàng nguy cơ gãy xương. Họ cũng cảnh báo rằng, tại bất kỳ điểm số BMD hoặc điểm số FRAX nào,nguy cơ gãy xương đều cao hơn ở những người mắc ĐTĐ.
Để cải thiện việc điều trị loãng xương, các dấu ấn sinh học của chu chuyển xương có thể được sử dụng. Họ có thể đánh giá trực tiếp hoặc gián tiếp, phát triển xương hoặc hoạt động hủy xương.
Theo nồng độ của chu chuyển xương chúng ta có thể đánh giá nguy cơ gãy xương và đánh giá hiệu quả điều trị. Những chỉ điểm này được đo trong huyết thanh, huyết tương và nước tiểu. Khả năng đo lường các chỉ điểm này đã dẫn đến những tiến bộ lớn trong nghiên cứu lâm sàng. Thật không may, vì lý do có sẵn, chi phí, và khả năng tái sản xuất, các chỉ điểm sinh học của chu chuyển xương thường không được đo thường xuyên bởi các chuyên gia không liên quan bệnh xương.
2.1. Chất lượng xương
Xương phải cứng và có thể chống lại sự biến dạng, do đó tải là có thể. Xương cũng phải linh hoạt và có thể biến dạng để cho phép hấp thụ năng lượng trong quá trình tác động tải. Xương cũng phải nhẹ để chuyển động. Sự cân bằng giữa độ cứng cơ chất của xương và tính linh hoạt của xương đạt được bằng cách thay đổi hàm lượng khoáng chất của xương. Hàm lượng khoáng vật càng lớn thì độ cứng của vật liệu càng lớn và độ linh hoạt càng thấp.
Cường độ bền của xương, một trong những yếu tố quyết định chính của xương, phụ thuộc vào khối lượng xương được phản ánh bởi BMD và trên vi cấu trúc xương. Vì vậy, độ bền xương phát sinh từ số lượng xương và chất lượng xương. Chất lượng xương bao gồm các yếu tố hình thái và chất liệu góp phần vào sức đề kháng gãy xương[28].
Chất lượng xương không được xác định chính xác. Nó được mô tả như là một sự pha trộn của tất cả các yếu tố xác định bộ xương có thể chống gãy xương như là vi cấu trúc của xương, tổn thương vi cấu trúc, chất lượng collagen, kích thước tinh thể khoáng và tốc độ của chu chuyển xương.
Trên thực tế, BMD chỉ giải thích được 70- 75% sức bền của xương, phần còn lại có thể liên quan đến các yếu tố khác như tích tụ gãy vi cấu trúc, rối loạn vi cấu trúc xương, rối loạn tái tạo xương, hoặc ảnh hưởng của các yếu tố nguy cơ ngoài xương .
Trong bệnh ĐTĐ, tăng đường huyết và stress oxy hóa làm giảm cơ chất của xương trong điều kiện sau khi chuyển đổi collagen, chẳng hạn liên kết chéo enzyme đã và chưa trưởng thành và sự hình thành AGEs không cần enzyme. Tác động bất lợi của AGE lên tế bào xương làm tăng sự mỏng manh của xương và làm giảm chất lượng xương trong bệnh ĐTĐ.
Mặc dù sử dụng BMD, dấu ấn sinh học và các yếu tố nguy cơ lâm sàng gãy xương, nhiều bệnh nhân có nguy cơ gãy xương đã không được phát hiện và nhiều hiện tượng gảy xương không được giải thích. BMD chỉ là một đánh giá khối lượng xương. Nó không cung cấp thông tin về chất lượng xương, một thông số quan trọng khác mô tả xương. Vì thế yếu tố nguy cơ lâm sàng gãy xương (công cụ FRAX) là một đánh giá gián tiếp về chất lượng xương.
Sự hiện diện của tần suất gãy xương sống (VFs) cũng có thể được sử dụng để đánh giá chất lượng xương ở từng bệnh nhân, vì một nghiên cứu lớn về tỷ lệ VFs trong loãng xương sau mãn kinh cho thấy bệnh nhân có VFs trước đó dễ bị VFs mới hơn.
Một cách quan trọng để mô tả chất lượng xương là đánh giá vi cấu trúc của xương vi cấu trúc xương góp phần vào sức bền cơ học của xương và do đó, với khả năng chống lại gãy xương.
Mất xương thường đi kèm với sự suy giảm trong kiến trúc xương, dẫn đến giảm số lượng xương xốp của xương, tăng khoảng cách giữa các phân tử và mất kết nối xương xốp. Ngoài ra, giảm độ dày của vỏ xương và tăng độ rỗng của xương xốp có thể dẫn đến sự mỏng manh của cổ xương đùi[29].
Loãng xương, do đó, được gọi là “xốp”. Mặc dù không có phương pháp đơn lẻ nào có thể mô tả đặc tính chất lượng xương, hiện tại kỹ thuật không xâm nhập về hình ảnh có thể được kết hợp với kỹ thuật cơ học ex-vivo và kỷ thuật thành phần cấu trúc cung cấp sự hiểu biết toàn diện về chất lượng xương.
Một loạt các kỹ thuật chẩn đoán hình ảnh cho phép mô tả đặc điểm hình thái học và vi cấu trúc xương từ vĩ mô đến microscale và cũng cho đến kích thước nano. Các phương pháp để mô tả đặc tính hình học và kiến trúc xương bao gồm:
CT định lượng.
CT định lượng ngoại vi độ phân giải cao. MRI độ phân giải cao và vi định lượng
CT.
Đánh giá đại thể hình thái xương siêu âm ba chiều (3D) có thể được thực hiện in vivo bằng cách sử dụng Chụp cắt lớp điện toán định lượng (Quantiative Computed Tomography- QCT) nhưng một nhược điểm quan trọng của QCT là phân phối bức xạ ion hóa cho bệnh nhân.
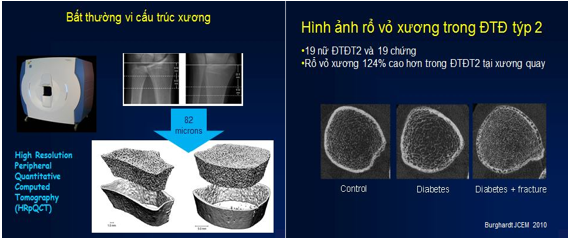
Sự ra đời của máy quét ngoại vi có độ phân giải cao (HR-pQCT) với độ phân giải đẳng hướng khoảng 80µm đã cho phép hình ảnh invivo của hình thái học xương xốp tại các vị trí ngoại vi như là xương quay.
Hình ảnh 1 và 2. Tổn thương xương ngoại biên ở bệnh nhân ĐTĐ qua HRpQTC
Các phép đo này phần lớn bị giới hạn ở các vị trí ngoại biên nhưng có lợi ích đồng thời với việc giảm liều bức xạ tương đối so với các phép đo từ việc quét toàn bộ QCT. MRI độ phân giải cao (HR-MRI) cho phép chụp ảnh 3D không ion của xương xốp ở các vị trí ngoại vi. Một lợi thế quan trọng của kỹ thuật này là khả năng tạo ra hình ảnh 3D của hình thái xương và vi cấu trúc xương mà không cần bức xạ ion hóa, nhưng nhược điểm bao gồm thời gian quét dài cần thiết cho hình ảnh có độ phân giải cao của xương xốp. Để đáp ứng nhu cầu về một công cụ lâm sàng có khả năng đánh giá vi kiến trúc xương, thang điểm đánh giá xương xốp (TBS) đã được phát triển.
2.2. Chỉ số xương xốp (Trabecular Bone Score=TBS)
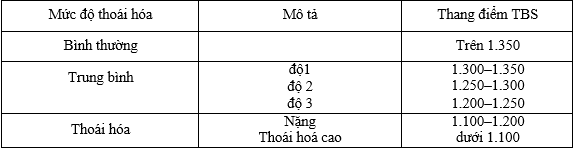
Bảng 2. Mức độ suy thoái của cấu trúc xương xốp theo TBS
 Chỉ số xương xốp (TBS) là một phương pháp thăm dò không xâm nhập được thiết kế để đánh giá các thông số vi cấu trúc xương xốp bắt nguồn từ các hình ảnh DXA. Mô tả TBS như một tham số kết cấu phản ánh các biến thể cấp độ xám của pixel trong hình ảnh DXA. Các biến thể này có thể phản ánh vi cấu trúc, nhưng kích thước pixel của máy DXA hiện có 4 lần lớn hơn so với kích thước xương xốp trung bình. TBS phát triển dựa trêncác sự kiện sau đây [30-31-36].
Chỉ số xương xốp (TBS) là một phương pháp thăm dò không xâm nhập được thiết kế để đánh giá các thông số vi cấu trúc xương xốp bắt nguồn từ các hình ảnh DXA. Mô tả TBS như một tham số kết cấu phản ánh các biến thể cấp độ xám của pixel trong hình ảnh DXA. Các biến thể này có thể phản ánh vi cấu trúc, nhưng kích thước pixel của máy DXA hiện có 4 lần lớn hơn so với kích thước xương xốp trung bình. TBS phát triển dựa trêncác sự kiện sau đây [30-31-36].
- Một bệnh nhân khỏe mạnh xương xốp có cấu trúc tốt và dày đặc ở xương sống (kết nối cao, số lượng xương xốp cao và khoảng cách nhỏ giữa xương xốp). Nếu chiếu cấu trúc này lên mặt phẳng, sẽ có được một hình ảnh chứa một số lượng lớn các biến thể giá trị pixel, nhưng biên độ của các biến thể này là nhỏ.
- Ngược lại, bệnh nhân loãng xương có cấu trúc xương xốp thay đổi và xương xốp (kết nối thấp, số lượng xương xốp thấp và không gian rộng giữa bè xương xốp). Nếu chiếu cấu trúc này lên mặt phẳng, sẽ có được một hình ảnh chứa số lượng biến thể giá trị pixel thấp, nhưng biên độ của các biến thể này cao.
Số lượng xương xốp bị mất trong quá trình lão hóa ở phụ nữ và nam giới là tương tự hoặc chỉ hơi ít ở nam giới hơn so với phụ nữ. Sức bền của đốt sống bị tổn hại nhiều hơn bằng cách mất kết nối hơn bởi xương xốp mỏng. TBS đo mức độ suy thoái của cấu trúc xương xốp.
Nghiên cứu hồi cứu lớn với hơn 29.000 phụ nữ sau mãn kinh cho thấy TBS dự đoán độc lập gãy xương ở một nhóm bệnh nhân ĐTĐ [32].
Một nghiên cứu đoàn hệ hồi cứu sử dụng
kết quả BMD từ cơ quan đăng ký lâm sàng.
Đánh giá khả năng của TBS cột sống thắt lưng để tăng nguy cơ gãy xương ở T2DM ở 56 phụ nữ mãn kinh sau bệnh nhân ĐTĐ typ 2 và 61 bệnh nhân nữ không có DM hoặc IGT. T2DM có liên quan với BMD cao hơn (1,155 so với 1,048 g/cm 2 trung bình, P<0,05) ở tất cả các vị trí nhưng cột sống thắt lưng TBS thấp hơn (1,211 so với 1,295 ở mức trung bình, P<0,05). Tỷ lệ chênh lệch được điều chỉnh (aOR) cho phép đo ở mức thấp nhất so với cao nhất là dưới 1 đối với BMD (P<0,05) nhưng tăng lên TBS cột sống thắt lưng (aOR 2,39, khoảng tin cậy 95% (CI) 2,22–2,81).
Cũng theo những kết quả này cột sống thắt lưng TBS dự đoán gãy xương ở những người bị tiểu đường và chiếm một phần lớn nguy cơ gãy xương do tiểu đường hơn BMD [33].
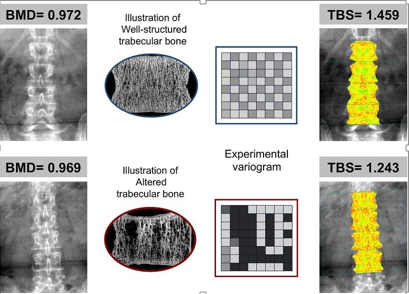
Hình 3. Trình bày nguyên tắc của chỉ số xương xốp (TBS) và một số ví dụ trong đó TBS dường như độc lập với BMD. Phía trên là các hình ảnh BMD và TBS của một phụ nữ 73 tuổi, với chỉ số BMI 24,2, BMD cột sống là 0,972 g / cm 2 và TBS là 1,459. Phía dưới là hình ảnh BMD và TBS của một phụ nữ 74 tuổi, với chỉ số BMI là 24,3, BMD cột sống là 0,969 g/cm2 và TBS là 1,243. Chứng minh nguyên tắc giá trị TBS cao khi nhiều xương xốp được kết nối và ít thưa xương, trong khi số lượng xương xốp ít và kết nối kém và thưa xương hơn với khi giá trị TBS thấp.
Về phương diện lâm sàng, TBS có thể dự báo nguy cơ gãy xương. Sử dụng TBS có thể tăng số lượng bệnh nhân có nguy cơ được xác định, cải thiện việc quản lý bệnh nhân trong đó chất lượng xương có tác động lớn hơn so với số lượng xương. TBS giúp theo dõi sự tiến hóa của cấu trúc xương xốp của bệnh nhân theo thời gian và theo dõi các tác động của điều trị thuốc chống loãng xương hoặc đồng hóa.Trên bệnh nhân ĐTĐ, TBS có thể được sử dụng như một phương tiện chẩn đoán và sử dụng để đánh giá hiệu quả điều trị. TBS không thay thế hoàn toàn các thăm dò hiện có mà giúp bổ sung và hỗ trợ các bác sĩ lâm sàng quyết định. BMD và TBS là hai tham số độc lập phản ánh các đặc tính xương khác nhau: số lượng và chất lượng. Cả BMD và TBS đều rất quan trọng trong việc đánh giá sức mạnh của xươngcũng như đưa ra quyết định về loại điều trị.
V. BIỆN PHÁP CAN THIỆP BỆNH XƯƠNG ĐÁI THÁO ĐƯỜNG
Những cân nhắc điều trị ở những bệnh nhân ĐTĐ bị loãng xương là những khuyến nghị từ thực hành lâm sàng tốt hơn là nghiên cứu dựa trên bằng chứng (Bảng 3).
Bảng 3: Quản lý chung loãng xương ở bệnh nhân ĐTĐ.
- Tránh nhóm Glitazones
- Kiểm soát đường huyết tốt
- Giảm thiểu các cơn hạ đường huyết
- Phòng ngừa biến chứng ĐTĐ, đặc biệt là bệnh thận
- Để đánh giá và dự phòng té ngã
- Bổ sung canxi và vitamin D
- Thuốc chống loãng xương đặc hiệu (điều trị chống hủy xương hoặc điều trị đồng hóa xương)
Tất cả bệnh nhân ĐTĐ cần được tư vấn về nguy cơ loãng xương và gãy xương. Bệnh nhân nên được tư vấn về lượng calci đủ (ít nhất 100-1200 mg/ngày) và lượng vitamin D (800–1000 IU/ngày). Khi bệnh nhân đáp ứng các hướng dẫn điều trị, có một số lựa chọn bao gồm các thuốc chống loãng xương như bisphosphonates, denosumab (ức chế RANK Ligand), SERM, tác nhân đông hóa và Teriparatide (PTH). Không có dữ liệu lâu dài về hiệu quả của một trong những loại thuốc này ở bệnh nhân ĐTĐ[34].
Việc kiểm soát đường huyết đầy đủ ở những bệnh nhân ĐTĐ đặc biệt quan trọng vì có dữ liệu cho thấy các biến chứng vi mạch của ĐTĐ, như bệnh võng mạc và bệnh thần kinh, phát sinh từ sự kiểm soát đường huyết chưa đạt lý tưởng, có thể dẫn đến việc té ngã và gãy xương tiếp theo.
VI. KẾT LUẬN
Dựa trên các dữ liệu hiện tạicho thấy bệnh nhân ĐTĐ có nguy cơ cao bị gãy xương, vì vậy sàng lọc loãng xương trên bệnh nhân ĐTĐlà hợp lý. Hướng dẫn sàng lọc loãng xương có thể được sử dụng cho bệnh nhân T1DM và T2DM, nhưng điều quan trọng cần lưu ý là ĐTĐ là yếu tố nguy cơ loãng xương và gãy xương và gãy xương có thể xảy ra ở mật độ BMD cao hơn ở bệnh nhân DM [108]. Kết quả của sự thiếu hiệu quả của BMD trong việc đánh giá nguy cơ gãy xương trong ĐTĐT2, các vấn đề lâm sàng chính là làm thế nào để đánh giá rủi ro và khi nào bắt đầu điều trị để ngăn ngừa gãy xương trong thực hành hàng ngày. Mặc dù có những chất chỉ điểm tiềm năng (osteocalcin, AGEs và insulin) cho những mục đích như vậy, không rõ liệu có thể tiên đoán được sự xuất hiện gãy xương mới ở bệnh nhân ĐTĐ typ 2 hay không và có thể sử dụng trong thực hành hàng ngày. Một quy trình đơn giản và được khuyến cáo cho tất cả các bác sĩ tham gia điều trị T2DM là đặt câu hỏi cho bệnh nhân về tiền sử gãy xương của họ.
Khoảng một nửa trong số họ sẽ được xác định là những người có khả năng xương và cần điều trị loãng xương để phòng ngừa gãy xương. Ngoài ra nếu bệnh nhân ĐTĐT2 trải qua xét nghiệm cột sống X quang chúng ta nên trực tiếp tìm kiếm gãy xương sống. Gần đây, thuật toán đánh giá nguy cơ gãy xương (FRAX) đã được phát triển bởi WHO, có thể đánh giá nguy cơ gãy xương của một cá nhân ngay cả khi không đo được BMD.
Thuật toán này tích hợp ảnh hưởng của một số yếu tố nguy cơ được xác định tốt cho gãy xương độc lập với BMD và do đó nó có thể hữu ích cho chiến lược phát hiện trường hợp xác định bệnh nhân đái tháo đường có nguy cơ gãy xương cao. TBS là một tham số mới, được xác định từ phân tích cấp độ xám của hình ảnh DXA. TBS đáp ứng nhu cầu về một phương pháp không xâm lấn để đánh giá vi kiến trúc xương – yếu tố quyết định sức mạnh của xương. Ngoài ra, TBS có thể được ước tính rất đơn giản, sử dụng các máy DXA có sẵn rộng rãi và trong cùng một quy trình như phép đo BMD. TBS là một giá trị định lượng, có thể tái sản xuất và dễ xử lý.
TÀI LIỆU THAM KHẢO
- Kurra and E. Siris, “Diabetes and bone health: the relationship between diabetes and osteoporosis-associated fractures,”Diabetes/Metabolism Research and Reviews, vol.27, no.5, pp.430–435, 2011.
- Janghorbani, R.M.van Dam, W.C.Willett, and F.B.Hu, “Systematic review of type 1 and type 2 diabetes mellitus and risk of fracture,” American Journal of Epidemiology, vol.166, no. 5, pp. 495–505, 2007.
- Vestergaard, “Discrepancies in bone mineral density and fracture risk in patients with type 1 and type 2 diabetes—a metaanalysis,” Osteoporosis International, vol.18,no.4,pp.427–444, 2007.
- J. Melton III, C. L. Leibson, S. J. Achenbach, T. M. Therneau, and S. Khosla, “Fracture risk in type 2 diabetes: update of a population-based study,”Journal of Bone and Mineral Research, vol.23, no.8, pp.1334– 1342,2008.
- Janghorbani, D. Feskanich, W. C. Willett, and F. Hu, “Prospective study of diabetes and risk of hip fracture,”Diabetes Care,vol.29,no.7,pp.1573–1578,2006.
- A. Brown and J. L. Sharples, “Osteoporosis: an underappreciated complication of diabetes,”Clinical Diabetes,vol.22,no. 1, pp. 10–20, 2004.
- M. Kindblom, C. Ohlsson, O. Ljunggren et al., “Plasma osteocalcin is inversely related to fat mass and plasma glucose in elderly Swedish men,”Journal of Bone and Mineral Research, vol.24,no.5,pp.785–791,2009.
- K. Lee, H. Sowa, E. Hinoi et al., “Endocrine regulation of energy metabolism by the skeleton,”Cell,vol.130,no.3,pp.456–469, 2007.
- Ferron, E.Hinoi, G.Karsenty, and P.Duc,“Osteocalcin differentially regulatesþcell and adipocyte gene expression and affects the development of metabolic diseases in wild-type mice,”Proceedings of the National Academy of Sciences of the United States of America,vol.105,no.13,pp.5266– 5270,2008.
- G.Pittas,S.S.Harris,M.Eliades,P.Star k,andB.DawsonHughes, “Association between serum osteocalcin and markers of metabolic phenotype,”JournalofClinicalEndocrinol ogyand Metabolism,vol.94,no.3,pp.827– 832,2009.
- Gennari, D. Merlotti, R. Valenti et al., “Circulating Sclerostin levels and bone turnover in type1 and type2diabetes,”Journal of Clinical Endocrinology and Metabolism, vol.97 , no.5,pp.1737–1744, 2012.
- Secchiero, F. Corallini, A. Pandolfi et al., “An increased osteoprotegerin serum release characterizes the early onset of diabetes mellitus and may contribute to endothelial cell dysfunction ,”American Journal of Pathology,vol.169,no.6,pp.2236–2244, 2006.
- Jin, “The WNT signalling pathway and diabetes mellitus,”Diabetologia,vol.51,no.10,pp.1 771–1780,2008.
- Bid, R. Konwar, C. Aggarwal et al., “Vitamin D receptor (FokI, BsmI and TaqI) gene polymorphisms and type 2 diabetes mellitus : a North Indian Study,”Indian Journal of Medical Sciences ,vol.63 ,no.5, pp.187–194,2009.
15. S. Yamagishi, K. Nakamura, and H. Inoue, “Possible participation of advanced glycation end products in the pathogenesis of osteoporosis in diabetic patients,”Medical Hypotheses,vol.65, no. 6, pp. 1013–1015, 2005.
- R¨ akel, O. Sheehy, Rahme, and J. LeLorier, “Osteoporosis among patients with type 1 and type 2 diabetes,”Diabetes and Metabolism,vol.34,no.3,pp.193– 205,2008.
- A. Soroc´ eanu,D.Miao,X.- Y.Bai,H.Su,D.Goltzman, and A. C. Karaplis, “Rosiglitazone impacts negatively on bone by promoting osteoblast/osteocyte apoptosis,”Journal of Endocrinology, vol.183, no.1, pp.203– 216,2004.
- Payer, P. Jackuliak, and Z. Killinger, “Risk of osteoporotic fractures in diabetic patients treated with glitazones treatment,” Osteologicky Bulletin,vol.15,no.2,pp.57–60,2010.
- K. Nicodemus and A. R. Folsom, “Type 1 and type 2 diabetes and incident hip fractures in postmenopausal women,”Diabetes Care,vol.24,no.7,pp.1192–1197,2001.
- Nuche-Berenguer, P. Moreno, P. Esbrit et al., “Effect of GLP-1 treatment on bone turnover in normal, type 2 diabetic, and insulin-resistant states,” Calcified Tissue International,vol.84, no. 6, pp. 453–461, 2009.
- Bu´ can, M. Ivaniˇsevi´ c, T. Zemunik et al., “Retinopathy and nephropathy in type 1 diabetic patients—association with polymorphysms of vitamin D-receptor, TNF, Neuro-D and Il-1 receptor 1 genes,”Collegium Antropologicum, vol.33, no.2,pp. 99–105, 2009.
- A. Diaz, A. G. Mainous III, P. J. Carek, A. M. Wessell, and C. J. Everett, “The association of vitamin D deficiency and insufficiency with diabetic nephropathy: implications for health disparities, ”Journal of the American Board of Family Medicine,vol. 22, no. 5, pp. 521–527, 2009.
23. D.T.Felson,Y.Zhang,M.T.Hannan,and J .J.Anderson,“Effects of weight and body mass index on bone mineral density in men and women: the Framingham Study,”Journal of Bone and Mineral Research, vol.8, no.5,pp.567–573,1993.
24. J.Compston,J.Flahive,D.W.Hosmeretal .,“Relation ship of weight, height and body mass index with fracture risk at different sites in postmenopausal women: the Global Longitudinal Study of Osteoporosis in Women (GLOW),”Journal of Bone Mineral Research, vol.29, no.2,pp.487–493,2014.
- Suzuki, C. Sugimoto, M. Takizawa et al., “Correlations between bone mineral density and circulating bone metabolic markers in diabetic patients,”Diabetes Research and Clinical Practice, vol.48, no.3, pp.185–191,2000.
26. S. Volpato, S. G. Leveille, C. Blaum, L.
- Fried, and J. M. Guralnik, “Risk factors for falls in older disabled women with diabetes: the Women’s Health and Aging Study,”The Journals of Gerontology A: Biological Sciences and Medical Sciences,vol.60, no.12,pp.1539– 1545,2005.
- A. Kanis, A. Oden, O. Johnell et al., “The use of clinical risk factors enhances the performance of BMD in the prediction of hip and osteoporotic fractures in men and women,”Osteoporosis International, vol. 18, no. 8, pp. 1033–1046, 2007.
- L. Bouxsein, “Bone quality: where do we go from here?” Osteoporosis International, vol. 14, supplement 5, pp. S118–S127, 2003.
J. P. Roux, J. Wegrzyn, and S. Boutroy, “Relationship between Trabecular Bone Score (TBS), Bone Mass and Microarchitecture in Human vertebrae: an ex vivo study,” Osteoporosis International, vol. 23, supplement 2, pp. S385–S386, 2012
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam