TĂNG TRIGLYCERIDE VÀ BỆNH TIM MẠCH DO XƠ VỮA
GS.TS. Nguyễn Hải Thủy
SUMMARY
Hypertriglyceridemia and Atherosclerotic Cardiovascular Disease
Atherosclerotic cardiovascular disease (ASCVD) is the leading cause of death and it has been confirmed that increased low density lipoprotein cholesterol (LDL-C) is an independent risk factor for atherosclerosis. Recently, the increasing evidence has showed that hypertriglyceridemia (HTG) is associated with incremental ASCVD risk. Hypertriglyceridemia is a very common problem in clinical practice with a prevalence of approximately 10%.1 High triglyceride concentration are markers for several type of TG rich lipoproteins (TRL) such as VLDL, IDL, especially LDLsd and apolipoproteins C-III. Patients with HTG may be at significant risk for ASCVD even if LDL cholesterol levels are at goal with Statins, and therefore warrant treatment that promotes regular exercise, optimizes diet and reduces overweight…. HTG in patients with type 2 Diabetes Mellitus, ASCVD, or metabolic syndrome… may benefit from additional drug including Fibtrates, Omega-3 polyunsaturated fatty acids (PUFAs) treatment aside from a Statins to address other lipid abnormalities. This review introduces the role of hypertriglyceridemia and TRLs in the pathogenesis of ASCVD, the relevance of a high TG level as a predictor of ASCVD, the beneficial cardiovascular outcomes from TG-lowering intervention trials.
Keywords
Atherosclerotic Cardiovascular disease (ASCVD); Lipoprotein remnants; Lipoprotein lipase (LPL); Triglycerides (TG); Triglyceride-rich lipoproteins (TRL)
I.Đặt vấn đề
Triglyceride (TG) là một trong những thành phần chính của lipid máu, là một dạng chất béo mà cơ thể chúng ta vẫn tiêu thụ hàng ngày có nguồn gốc chủ yếu từ mỡ động vật và thực vật chứa trong thực phẩm hàng ngày. Sau khi được đưa vào cơ thể, TG sẽ kết hợp với cholesterol và một số thành phần lipid khác được vận chuyển bởi Chylomicron và nhiều loại lipoprotein khác để tạo thành năng lượng nhờ xúc tác của enzyme lipoprotein lipase (LPL). Sau đó được tích trữ chủ yếu ở các tế bào gan và tế bào mỡ. Nếu cơ thể tích tụ quá nhiều TG gây tác hại cho cơ thể thông qua các bệnh lý nổi bật trên lâm sàng trong những năm gần đây như hội chứng chuyển hóa, gan nhiểm mỡ, đái tháo đường týp 2, bệnh tim mạch xơ vữa…
Đối tượng tăng TG máu đã và đang tăng trên toàn thế giới, đặc biệt là ở các nước đã và đang phát triển. Tại Hoa Kỳ ghi nhận có sự gia tăng nồng độ TG huyết tương trung bình gấp 7 lần so với cách đây 30 năm. Sự gia tăng TG này trùng hợp, một phần, với sự gia tăng các đối tượng thừa cân béo phì, hội chứng chuyển hóa và đái tháo đường týp 2.
Phân loại của tăng TG cho đến nay vẫn dựa theo khuyến cáo của Hội đồng chuyên gia về Chương trình Giáo dục Cholesterol Quốc gia lần III (NCEP III), theo đó phân loại nồng độ TG <150 mg/dL được xem bình thường. giá trị 150 – 199 mg/dL được coi là giới hạn cao và trên 200 mg/dL đều được gọi là cao và trên 500 mg/dL được coi là rất cao.
Tăng TG máu nói chung là kết quả của tăng một hoặc nhiều chất lipoprotein giàu TG như chylomicrons, VLDL hoặc dạng thừa của chúng (Hình 1). .

Hình 1: Các lipoprotein chứa nhiều triglyceride
Sự gia tăng TG xảy ra do gia tăng tổng hợp, giảm quá trình dị hóa hoặc do cả hai, với nguyên nhân cơ bản thường là kết quả của sự thay đổi các yếu tố như apolipoprotein C-II, apolipoprotein C-III, CETP ( cholesterol ester transfer protein) và enzyme LPL. Ngoài ra, tăng TG máu cũng có thể là thứ phát sau các tình trạng bệnh khác (đái tháo đường, suy giáp, bệnh thận và hội chứng thận hư…). Không có gì đáng ngạc nhiên, các điều kiện môi trường, đặc biệt là chế độ ăn uống những chất có chỉ số đường cao hoặc chất béo cao và trong đó mất cân bằng giữa tiêu thụ và sử dụng năng lượng, có liên quan đến tăng TG máu . Bên cạnh đó, lối sống không lành mạnh, ít hoạt động, tiêu thụ rượu bia quá nhiều là một trong những đóng góp chính cho sự gia tăng gần đây về nồng độ TG lưu hành ở các nước đã và đang phát triển.
II. Tăng TG máu là yếu tố nguy cơ độc lập đối với bệnh tim mạch
Những đối tượng có nồng độ TG cao có nguy cơ bị biến chứng tim mạch, đặc biệt là xơ vữa động mạch. Nghiên cứu Framingham ghi nhận sự liên quan giữa tăng TG máu với bệnh tim mạch, đặc biệt ở phụ nữ. Ngoài ra nhiều nghiên cứu khác trước đó cũng đã cho thấy mối liên hệ giữa TG cao và tăng nguy cơ mắc bệnh tim mạch.
Câu hỏi được đặt ra liệu TG có phải là yếu tố nguy cơ độc lập hay không đối với bệnh tim mạch xơ vữa. Ví dụ, qua phân tích tổng hợp các dữ liệu hợp tác về các yếu tố nguy cơ mới nổi lên cho thấy TG là yếu tố nguy cơ đối với bệnh tim mạch và đột quỵ, nhưng sau khi điều chỉnh các yếu tố nguy cơ chuẩn (chủ yếu là cholesterol liên quan đến lipoprotein), một số các nhà nghiên cứu cho rằng nồng độ TG ít có giá trị nhiều trong dự đoán. Tuy nhiên, một số khuyến cáo khác ở bệnh nhân có nồng độ TG trên 500 mg/dL có nguy cơ cao viêm tụy và khuyến cáo việc định lượng nồng độ TG và điều trị cho những người có nồng cao bất kể có hay không có nguy cơ tim mạch.
Liên quan giữa nồng độ TG với bệnh tim mạch (sau khi tính đến các yếu tố nguy cơ khác như tăng LDL-C và HDL-C thấp) không được thuyết phục khiến một số người đặt câu hỏi liệu việc đo nồng độ TG có giúp ích gì cho việc quản lý bệnh nhân tim mạch xơ vữa hay không. Tuy nhiên, có một số lý do quan trọng để đánh giá nồng độ chất TG ở bệnh nhân, đặc biệt là những người mắc bệnh tim mạch xơ vữa, hội chứng chuyển hóa, gan nhiễm mỡ, đái tháo đường tuýp 2.
Ngoài ra, ngày càng có nhiều nghiên cứu chỉ ra TG là yếu tố nguy cơ độc lập đối với bệnh tim mạch ngay cả khi điều chỉnh nồng độ cholesterol toàn phần, LDL-C và HDL-C. Ví dụ, nghiên cứu PROCAM cho thấy tăng nguy cơ biến cố tim mạch khi nồng độ TG tăng và nguy cơ tồn tại sau khi tính đến các yếu tố nguy cơ chính khác, và nghiên cứu PRISE IT-TIMI 22 cho thấy nồng độ TG có tác động đáng kể đến kết quả tim mạch ở bệnh nhân mắc hội chứng mạch vành cấp tính độc lập với LDL-C. Hơn nữa, các nghiên cứu ngẫu nhiên Mendel cho thấy mối quan hệ nhân quả giữa các yếu tố liên quan đến việc điều chỉnh nồng độ các lipoprotein giàu TG và bệnh tim mạch. Ví dụ, phân tích dữ liệu từ Nghiên cứu Tim mạch tại Thành phố Copenhagen cho thấy các biến thể di truyền của enzyme LPL dẫn đến giảm nồng độ TG cũng làm giảm tỷ lệ tử vong do mọi nguyên nhân. Các phân tích tổng hợp của các thử nghiệm ngẫu nhiên đã minh chứng rằng gia tăng nồng độ TG được xem như là một yếu tố nguy cơ độc lập về bệnh tim mạch do xơ vữa.
Một phân tích đánh giá tác động của việc giảm nồng độ cholesterol máu bằng Statin đã chỉ ra rằng, ở những bệnh nhân mắc bệnh tim mạch từ trước, việc giảm nguy cơ tồn dư không liên quan đến việc giảm LDL-C có thể liên quan đến các lipoprotein giàu TG. Một cách thuyết phục nhất, một phân tích tổng hợp gần đây của 29 nghiên cứu tiền cứu đã cho thấy nồng độ TG có chỉ số nguy cơ (OR) là 1,72 ( 95%,CI = 1,56 – 1,90) cho những người ở nồng độ TG cao sau khi điều chỉnh các yếu tố nguy cơ khác . Một tỷ lệ tương tự đã được báo cáo trong một phân tích tổng hợp bao gồm dữ liệu từ 26 nghiên cứu tiền cứu ở dân số châu Á và Thái Bình Dương. Với các bằng chứng ngày càng tăng cho thấy tăng TG là dấu hiệu tăng nguy cơ mắc bệnh tim mạch, một câu hỏi được đặt ra chính là liệu giảm mức TG có giúp bảo vệ tim mạch hay không. Kết quả của một số nghiên cứu cho thấy rằng giảm nồng độ TG có thể làm giảm nguy cơ biến cố tim mạch. Một phân tích về hai thử nghiệm phòng ngừa thứ phát của pravastatin cho thấy rằng HDL-C cao và TG thấp là những yếu tố dự báo quan trọng về giảm nguy cơ mắc các sự kiện bệnh tim mạch.
Một phân tích tổng hợp gần đây của 18 thử nghiệm đánh giá tác dụng của Fibrates đối với biến cố tim mạch đã ghi nhận giảm 10% nguy cơ tương đối đối với các biến cố tim mạch lớn ở những người bị tăng TG máu đơn thuần hoặc kết hợp với HDL-C thấp. Các phân tích tổng hợp khác cho thấy mối liên quan có ý nghĩa của nồng độ TG thấp và dự phòng biến cố tim mạch độc lập với các yếu tố nguy cơ chính khác. Do đó, bằng chứng cho thấy vai trò độc lập của nồng độ TG trong nguy cơ tim mạch và xác định nồng TG ở bệnh nhân có nguy cơ.
III. Có phải tăng TG máu có vai trò tác động trực tiếp trong việc thúc đẩy bệnh tim mạch xơ vữa không?
Cơ chế tăng TG máu tác động trực tiếp đến bệnh tim mạch xơ vữa vẫn chưa được làm sáng tỏ hoàn toàn. Tuy nhiên, một số giả thuyết đã được đưa ra bệnh tim mạch phổ biến nhất, xơ vữa động mạch là mục tiêu cho hầu hết các khám phá về vai trò trực tiếp của TG trên bệnh tim mạch, và ngày càng có nhiều bằng chứng cho thấy TG có thể ảnh hưởng trực tiếp đến các khía cạnh cụ thể của tổn thương xơ vữa động mạch.
Gia tăng nồng độ TG gây rối loạn các lipoprotein giàu TG (VLDL, IDL) làm gia tăng lượng phenotype LDL có kích thước bé dần (LDLsd) do không tiếp nhận với thụ thể LDL tại gan (Sơ đồ 1) dễ dàng xâm nhập vào nội mạc thành mạch gây xơ vữa động mạch, làm các mảng vữa có thành mỏng nguy cơ dễ bóc tách và lấp mạch. ( hình 2 và hình 3)
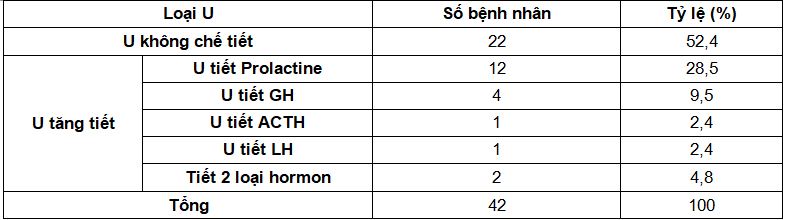
Sơ đồ 1. Giả thuyết về mối liên quan giữa rối loạn chuyển hóa của các lipoprotein giàu TG trong sự phát triển các phenotype của lipoprotein gây xơ vữa. Nồng độ TG càng cao thì càng gia tăng số lượng LDLsd. Các lipoprotein nhỏ này sẽ không được thu nhận với thụ thể LDL tại gan dẫn đến gia tăng tình trạng xâm nhập vào nội mạc làm gia tăng xơ vữa. Bên cạnh đó HDL cũng tăng biến đổi thành HDLsd loại HDL này mất chức năng chống xơ vữa. (CETP, cholesterol ester transfer protein; Chol, chole sterol; HL, hepatic lipase; LDLR, LDL receptor; LPL, lipoprotein lipase).

Hình 2 : Cơ chế bệnh sinh gây xơ vữa của LDLsd

Hình 3 : So sánh hình ảnh tổn thương mảng xơ vữa ổn định với bao xơ dày và không ổn định bao xơ mỏng liên quan LDLsd. Mảng xơ vữa không ổn định nguy cơ bóc tách gây lấp mạch.
Bên cạnh đó, một số giả thuyết dựa trên thực tế lâm sàng là các lipoprotein giàu TG (VLDL, chylomicron, IDL) cũng chứa một lượng cholesterol đáng kể và có thể thúc đẩy sự hình thành tế bào bọt bằng cách đóng góp cholesterol vào tổn thương. Tại các mảng xơ vữa động mạch, người ta còn tìm thấy nhiều lipoprotein khác ngoài LDL (IDL, VLDL thừa, Lp (a)) trong Hình 4.

Hình 4. Các hạt lipoprotein (IDL, VLDL thừa, Lp (a) hiện diện trong các mảng xơ vữa
Các hạt VLDL và Chylomicron thừa được tạo ra sau khi bị thủy phân một phần TG của chúng thông qua hoạt động của enzyme LPL. Những hạt này cũng có chứa cholesterol và có thể thu được cholesterol bổ sung bằng cách chuyển từ HDL thông qua hoạt động của protein chuyển cholesterol ester (CETP). Trong tăng TG máu, có sự gia tăng tổng hợp VLDL, độ thanh thải chậm và thường gia tăng trong các hạt lipoprotein thừa.
Trên thực tế, nồng độ TG máu lúc đói chủ yếu phản ánh các hạt lipoprotein thừa, đặc biệt là trong tăng TG máu và các hạt này có thể gây xơ vữa ( hình 4). Mặc dù chylomicron ở một mức độ nào đó, VLDL kích thước thường quá lớn để vượt qua lớp tế bào nội mô và xâm nhập vào lớp áo trong thành mạch, chuyển đổi thành phần thừa cho phép các hạt này tích tụ trong tổn thương xơ vữa động mạch và lắng đọng cholesterol. Điều này có nghĩa là nồng độ enzyme LPL tác động trên lipoprotein thừa, có thể tác động đến sự phát triển tổn thương xơ vữa động mạch và đã có những nghiên cứu trên động vật cho thấy mối liên quan này.
Bằng chứng về tầm quan trọng của các lipoprotein thừa trong quá trình phát sinh xơ vữa cũng đã ghi nhận từ những đối tượng tăng lipoprotein loại III. Trên những bệnh nhân này có sự giảm sự thanh thải của lipoprotein thừa và phát triển xơ vữa động mạch sớm.
Một yếu tố giảm thiểu trong việc đánh giá nồng độ cholesterol cung cấp trong các lipoprotein giàu TG góp phần gây xơ vữa động mạch là thực tế, mặc dù các hạt lipoprotein giàu TG và lipoprotein thừa cũng có chứa một lượng lớn cholesterol và TG. Ít nhất là liên quan đến sự tích tụ cholesterol trong các tế bào bọt, sự hiện diện của TG trong các tế bào thực sự thúc đẩy quá trình thủy phân cholesterol ester thành cholesterol.
Cholesterol được lưu trữ trong các tế bào bọt chủ yếu ở dạng cholesterol ester. Để được loại bỏ khỏi tế bào và mảng xơ vữa, trước tiên cholesterol ester phải được chuyển đổi thành cholesterol không ester. Sự hiện diện của TG xen kẽ với cholesterol ester trong các tế bào bọt tạo điều kiện cho quá trình thủy phân và loại bỏ cholesterol.
Sự thoái biến lipid của các hạt lipoprotein giàu TG không chỉ tập trung cholesterol trong các hạt mà nó còn tạo ra acid béo tự do (FFA) và monoglyceride. Các nghiên cứu nuôi cấy tế bào đã chứng minh rằng các axit béo chuỗi dài, đặc biệt là các axit béo bão hòa như Palmitate và Stearate, là các chất gây độc cho tế bào. Do đó, sự hiện diện của TG do thoái biến lipid trong các tổn thương xơ vữa động mạch có thể làm tăng nồng độ axit béo tự do gây độc trong các tế bào của thành động mạch, sẽ thúc đẩy sự chết của tế bào và gây viêm. Cả sự gia tăng chết tế bào và các tín hiệu viêm là mấu chốt chính của quá trình phát sinh xơ vữa.
Để hỗ trợ quá trình phân giải lipid TG như tiến trình điều khiển gây xơ vữa, đại thực bào tạo và tiết enzyme lipoprotein lipase và người ta ước tính rằng đại thực bào là nguồn LPL chính trong các mảng xơ vữa động mạch.
Thoái biến lipid cục bộ của lipoprotein giàu TG và tàn dư của chúng cũng có thể giải phóng các axit béo oxy hóa khác, có thể thúc đẩy độc tế bào và viêm; nguồn gốc chính trong sự phát triển tổn thương xơ vữa động mạch. Tăng lipoprotein lipase đại thực bào kích thích gây độc đại thực bào, trong khi làm giảm lipoprotein lipase đại thực bào ở chuột làm giảm kích thước mảng xơ vữa động mạch. Do đó, sự thủy phân cục bộ các hạt giàu triglyceride bằng đại thực bào có khả năng tạo ra tác dụng gây độc tế bào và viêm.
Rõ ràng là thành phần axit béo trong chế độ ăn của lipoprotein, bao gồm cả lipoprotein giàu TG, ảnh hưởng đến quá trình trao đổi chất của chúng theo những cách phức tạp và không hoàn toàn hiểu được. Thành phần axit béo của lipoprotein (cũng như phospholipids và cholesteryl ester) bị ảnh hưởng nhiều bởi acid béo của chế độ ăn uống. Mặc dù acid béo bão hòa của chế độ ăn uống được phổ biến cho là xấu, cho dù tiêu thụ chất béo bão hòa, làm tăng nguy cơ tim mạch vẫn còn gây tranh cãi dựa trên bằng chứng có sẵn. Tuy nhiên, ở những người mắc FH, tăng chất béo bão hòa trong chế độ ăn rõ ràng làm tăng nồng độ LDL-C. Điều cũng có vẻ rõ ràng là việc thay thế axit béo bão hòa trong chế độ ăn uống bằng axit béo đa không bão hòa (PUFA) làm giảm các biến cố tim mạch.
Omega-6 PUFA là PUFA đầu tiên được tìm thấy trong chế độ ăn uống phương Tây. Có bằng chứng cho thấy nồng độ TG thấp hơn, một phần, bằng cách tăng quá trình phân giải lipid của lipoprotein giàu TG. Omega-3 PUFA là nguồn PUFA chính khác của thức ăn. Cá là một nguồn phong phú omega-3 chuỗi dài, và có bằng chứng thuyết phục rằng PUFA omega-3 (ít nhất là từ các nguồn hải sản) làm giảm cả nồng độ TG và nguy cơ tim mạch.
Một thử nghiệm ngẫu nhiên có kiểm soát quy mô lớn gần đây (REDUCE-IT) sử dụng EPA sản phẩm dầu cá đã làm giảm 25% biến cố tim mạch lớn ở những bệnh nhân bị tăng TG máu (632). Thay thế chất béo bão hòa bằng axit béo không bão hòa đơn có thể giúp giảm một số biến cố tim mạch, nhưng PUFA dường như có mối liên quan nhiều hơn về sự cải thiện nguy cơ tim mạch so với axit béo không bão hòa đơn.
Trái ngược với axit béo dạng cis, axit béo không bão hòa dạng trans, thường thấy trong thực phẩm chế biến, có liên quan đáng kể với tăng nguy cơ tim mạch. Đưa ra bằng chứng này và bằng chứng khác, một báo cáo gần đây từ Hội đồng chuyên gia của Hiệp hội Lipid quốc gia khuyến cáo, đối với những bệnh nhân có nguy cơ mắc bệnh tim mạch thấp hoặc trung bình, nên giảm lượng axit béo bão hòa xuống <7% tổng năng lượng và axit béo dạng trans. Việc giảm chất béo bão hòa và dạng trans nên được thay thế bằng PUFA, protein và carbohydrate. Các hướng dẫn cũng đề nghị ăn cá hai lần mỗi tuần. Đối với những người có nồng độ TG cao, Hội đồng chuyên gia cũng khuyến nghị bổ sung axit béo không bão hòa đa omega-3 từ các nguồn hải sản. AHA/ACC năm 2018 liệt kê tăng TG máu liên tục là chất tăng nguy cơ phát triển ASCVD và khuyến nghị sử dụng dầu cá omega-3 cho những người có nồng độ TG cao để ngăn ngừa viêm tụy.
Tuy nhiên, hướng dẫn của AHA/ACC đã không loại trừ bằng chứng về thử nghiệm REDUCE-IT. Do đó, ở những người bị tăng TG máu và các yếu tố nguy cơ khác đối với ASCVD, người ta nên xem xét bắt đầu sử dụng dầu cá omega-3 hoặc tăng cường trị liệu bằng statin.
Thủy phân TG qua lipoprotein lipase không phải là cơ chế duy nhất tại thành động mạch về chuyển hóa các hạt giàu TG để tạo ra các hợp chất có khả năng gây xơ vữa. Các tế bào bọt cũng có khả năng nhập bào VLDL và các hạt lipoprotein thừa, sau đó có thể được thoái biến trong tiêu thể (lysosome)
Điều thú vị là, có bằng chứng cho thấy dưới tác động của xơ vữa, bao gồm cả sự kết hợp của đại thực bào, con đường chuyển hóa TG trong các đại thực bào có thể chuyển sang ưu tiên cung cấp lipoprotein giàu TG hơn là sự thủy phân ở bề mặt. Ngoài ra trong khi thủy phân bề mặt TG bằng lipase bề mặt chủ yếu chỉ cung cấp axit béo tự do cho các tế bào, sự thu nhận nhập bào của các hạt sẽ bao gồm việc cung cấp các hạt đầy đủ, bao gồm cả sterol của nó, sẽ làm trầm trọng sự tích tụ của tế bào bọt.
Một tiềm năng khác mà lipoprotein giàu TG có thể ảnh hưởng đến xơ vữa động mạch nhắm vào apolipoprotein CIII của VLDL và các phần thừa. ApoCIII ức chế enzyme lipoprotein lipase, ức chế sự thu nhận các phần thừa vào gan và nồng độ của nó liên quan đến tăng TG máu. Do đó, nồng độ apolipoprotein CIII cao có thể thúc đẩy sự lưu giữ tại động mạch chất VLDL và phần thừa làm cho chúng gây xơ vữa hơn, từ đó đề xuất apolipoprotein CIII như là mục tiêu điều trị. Trên thực tế, những cá nhân có vài đột biến trong ApoCIII có giảm nồng độ TG và LDL-C.

Hình 5: Cơ chế xơ vữa động mạch do tăng Triglyceride
Lipoprotein giàu triglyceride (TRLs) và các sản phẩm thoái biến lipid của nó bị thủy phân bởi lipoprotein lipase (LPL) và CETP (cholesterol ester transporter protein), chứa TRL thừa (TRL-R), sd-LDL, HDL3 (HDL tái tạo), axit béo tự do oxy hóa (ox-FFA) và các loại khác, có thể làm gia tăng sản xuất các loại oxy phản ứng (ROS) và giảm oxit nitric (NO) được giải phóng bởi nội mô và điều chỉnh tăng biểu hiện nội mô của một số phân tử (ICAM-1 = intercelluar adhesion molecule-1) VCAM-1 = vascular cell adhesion molecule-1) NLRP-1 = nucleotide-binding domain-like receptor family pyrin domain-containing protein 1) , thúc đẩy rối loạn chức năng nội mô. TRLs và các sản phẩm của chúng thâm nhập vào nội mạc mạch máu và gây ra tình trạng viêm góp phần kích hoạt tế bào đơn nhân, bám dính và xâm nhập. Trong khi đó, bạch cầu nội mạc cũng có thể lấy TG hoặc cholesterol trong TRL-R để tạo thành các tế bào bọt, sau đó phát triển thành lõi của mảng xơ vữa động mạch. Ngoài ra, một số cytokine (TNF-α =tumor necrosis factor-α, IL-1β =interleukin-1 β) và các loại khác) và các tế bào T tham gia vào quá trình xơ vữa động mạch và toàn bộ quá trình xơ vữa động mạch liên quan đến tiểu cầu kích hoạt và tập hợp để gây ra một trạng thái tiền đông máu (procoagulant state) và hình thành cục máu đông, trong chứng tăng triglyceride máu.
Hai nghiên cứu gần đây cho thấy mất chức năng đột biến ApoCIII làm giảm TG huyết thanh > 39%, giảm đáng kể LDL-C và tăng HDL-C, và giảm tỷ lệ biến cố tim mạch > 36%. Một chất ức chế chọn lọc oligonucleotide antisense của ApoCIII đã được phát triển làm giảm ApoCIII và TG huyết thanh ở chuột, linh trưởng và người đang trong thử nghiệm lâm sàng giai đoạn 2. Những nghiên cứu này chỉ ra rằng giảm ApoCIII bằng cách ức chế oligonucleotide antisense làm giảm đáng kể nồng độ TG máu. Bên cạnh tác dụng của chúng đối với lipid máu, các lipoprotein chứa ApoCIII cũng kích thích một loạt các quá trình bao gồm kích hoạt các tế bào đơn nhân, viêm, tế bào nội mô sản xuất NO, dẫn đến rối loạn chức năng thành mạch và tăng quá trình oxy hóa lipid và liên kết của lipoprotein với PG chất kích thích hình thành tế bào bọt.
Sau cùng nồng độ TG có thể ảnh hưởng đến sự phát sinh xơ vữa có liên quan đến việc phát hiện bệnh nhân tăng TG máu cũng có xu hướng gia tăng nồng độ các yếu tố gây huyết khối như chất ức chế hoạt hóa fibrinogen và plasminogen và chất trung gian gây viêm (TNF-alpha, IL-6, 1 và MCP-1). Huyết khối và viêm là yếu tố chính trong xơ vữa động mạch và sự tiến triển của nó gây bệnh mạch vành và đột quỵ.
IV. Biện pháp giảm nồng độ TG máu
Tăng TG huyết tương có thể đóng góp trực tiếp hoặc gián tiếp vào nhiều khía cạnh của sự phát triển tổn thương xơ vữa động mạch. Bất kể liệu triglyceride có phải là nguyên nhân trực tiếp gây ra bệnh tim mạch hay không, nhiều bằng chứng cho thấy việc đánh giá nồng độ TG có vai trò quan trọng trong việc đánh giá và kiểm soát nguy cơ tim mạch, và điều trị làm giảm TG có thể làm giảm nguy cơ mắc các bệnh tim mạch. Điều này đặc biệt đúng đối với bệnh nhân mắc bệnh mạch vành hoặc đái tháo đường.
Một số tác nhân đã cho thấy hiệu quả trong việc giảm TG và cũng làm giảm nguy cơ mắc bệnh tim mạch. Hiện nay, các tác nhân trị liệu được khuyên dùng để điều trị tăng triglyceride máu là fibrate, statin, niacin và omega-3 PUFA và những loại khác đang được triển khai. Trong số đó liệu pháp fibrate là phương pháp hiệu quả để trực tiếp hạ thấp nồng độ TG. Fibrate đã được chứng minh là làm giảm mức chất béo trung tính 30% -50% tùy theo mức cơ bản.
Mặc dù các thử nghiệm điều trị kết hợp statin với fenofibrate đã không đáp ứng được các tiêu chí chính của chúng về việc giảm các biến cố tim mạch, nhưng phân tích của tất cả các thử nghiệm fibrate cho thấy lợi ích đáng kể về việc giảm các biến cố bệnh tim mạch xơ vữa khi xem xét nhóm phụ của bệnh nhân có triglyceride tăng cao và HDL-C thấp và các đặc điểm của hội chứng chuyển hóa hoặc đái tháo đường.
KẾT LUẬN
Sự liên quan giữa gia tăng nồng độ TG máu và bệnh tim mạch xơ vữa đã được chứng minh. Vấn đề đang tranh luận là nồng độ TG trực tiếp thúc đẩy quá trình tạo xơ vữa hoặc, thay vào đó, chỉ là một dấu ấn sinh học cho các quá trình khác ảnh hưởng đến nguy cơ tim mạch. Tuy nhiên, bằng chứng hỗ trợ việc định lượng nồng độ TG và chế độ điều trị giảm nồng độ TG cần được tăng cường đặc biệt ở những bệnh nhân mắc hội chứng chuyển hóa, đái tháo đường và bệnh tim mạch xơ vữa.
Tài liệu tham khảo
- National Cholesterol Education Program Expert Panel on Detection E. Treatment of High Blood Cholesterol in A. Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation. 2002;106:3143–3421.
- Grundy SM, Cleeman JI, Merz CN, Brewer HB Jr, Clark LT, Hunninghake DB, Pasternak RC, Smith SC Jr, Stone NJ. National Heart L, Blood I, American College of Cardiology F, American Heart A. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation. 2004;110:227–239.
- Brinton E. Management of Hypertriglyceridemia for Prevention of Atherosclerotic Cardiovascular Disease. Cardiology clinics. 2015;33:309–323.
- Miller M, Stone N, Ballantyne C, Bittner V, Criqui M, Ginsberg H, Goldberg A, Howard W, Jacobson M, Kris-Etherton P, Lennie T, Levi M, Mazzone T, Pennathur S. American Heart Association Clinical Lipidology T, Prevention Committee of the Council on Nutrition PA, Metabolism, Council on Arteriosclerosis T, Vascular B, Council on Cardiovascular N, Council on the Kidney in Cardiovascular D. Triglycerides and cardiovascular disease: a scientific statement from the American Heart Association. Circulation. 2011;123:2292–2333.
- Austin M, Hokanson J, Edwards K. Hypertriglyceridemia as a cardiovascular risk factor. The American journal of cardiology. 1998;81:7B–12B.
- Sarwar N, Danesh J, Eiriksdottir G, Sigurdsson G, Wareham N, Bingham S, Boekholdt S, Khaw K, Gudnason V. Triglycerides and the risk of coronary heart disease: 10,158 incident cases among 262,525 participants in 29 Western prospective studies. Circulation. 2007;115:450–458.
- Castelli W. The triglyceride issue: a view from Framingham. American heart journal. 1986;112:432–437.
- Miller M. Chapter 9. High-density lipoprotein cholesterol and triglycerides in coronary heart disease risk assessment. In: Ballantyne C, ed. Clinical lipidology: A companion to Braunwald’s Heart Disease, Second Edition. Philadelphia: Elsevier Saunders; 2015:100-108.
- Talayero B, Sacks F. The role of triglycerides in atherosclerosis. Current cardiology reports. 2011;13:544–552.
- Assmann G, Cullen P, Schulte H. The Munster Heart Study (PROCAM). Results of follow-up at 8 years. European heart journal 1998; 19 Suppl A:A2-A11.
- Patel A, Barzi F, Jamrozik K, Lam T, Ueshima H, Whitlock G, Woodward M, Asia Pacific Cohort Studies C. Serum triglycerides as a risk factor for cardiovascular diseases in the Asia-Pacific region. Circulation. 2004;110:2678–2686.
- Chang W, Lin J, Dong J, Li D. Pyroptosis: an inflammatory cell death implicates in atherosclerosis. Medical hypotheses. 2013;81:484–486.
- Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Circulation. 2002;106:3143–3421.]
- Brunzell J, Davidson M, Furberg C, Goldberg R, Howard B, Stein J, Witztum J. American Diabetes A, American College of Cardiology F. Lipoprotein management in patients with cardiometabolic risk: consensus statement from the American Diabetes Association and the American College of Cardiology Foundation. Diabetes Care. 2008;31:811–822.
- Keech A, Simes R, Barter P, Best J, Scott R, Taskinen M, Forder P, Pillai A, Davis T, Glasziou P, Drury P, Kesaniemi Y, Sullivan D, Hunt D, Colman P, d’Emden M, Whiting M, Ehnholm C, Laakso M. investigators Fs. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes mellitus (the FIELD study): randomised controlled trial. Lancet. 2005;366:1849–1861.
- Barter P, Rye K. Is there a role for fibrates in the management of dyslipidemia in the metabolic syndrome? Arteriosclerosis, thrombosis, and vascular biology. 2008;28:39–46.
- Elam M, Lovato L, Ginsberg H. Role of fibrates in cardiovascular disease prevention, the ACCORD-Lipid perspective. Current opinion in lipidology. 2011;22:55–61.
18.Deepak L. Bhatt, Michael Miller,Eliot A. Brinton, et al (2020). REDUCE-IT(Reduction of Cardiovascular Events with Icosapent Ethyl – Intervention Trial) USA.Results From the 3146 Patients Randomized in the United States. Circulation. 2020;141:367–375.
Vui lòng không reup bài khi chưa được cho phép!
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam