NGHIÊN CỨU SỰ BỘC LỘ MỘT SỐ DẤU ẤN HOÁ MÔ MIỄN DỊCH TRONG UNG THƯ BIỂU MÔ TUYẾN GIÁP THỂ BIỆT HOÁ TÁI PHÁT/DI CĂN
Ngô Thị Minh Hạnh, Trịnh Tuấn Dũng, Hoàng Quốc Trường, Lê Ngọc Hà
Bệnh viện TW QĐ 108
ABSTRACT
Expression of some immunohistochemical markers in recurrent, metastatic differentiated thyroid carcinoma
Objective: To evaluate expression some of immunohistochemical markers in recurrent, metastasis differentiated thyroid carcinoma. Subject and Method: 72 patients were totally thyroidectomized, recieved 131I therapy, follow-up and re-operated recurrent tissues at 108 Military Central Hospital from 11/2014 to 10/2017. Evaluate expression some of immunohistochemical markers from FFPE (Formaldehyde Fixed-Paraffin Embedded) tissue sections of patients with recurrent, metastasis differentiated thyroid carcinoma. Results: Recurrent, metastatic differentiated thyroid carcinoma re-opreated was highly positive with thyrogolulin, TTF1, CK19, HBME-1 makers, respectively, 86.1%, 83.3%, 84.7%, 95.8%; galectin-3 positive accounted for 30.6%. Positive expression with TTF1, CK19, HBME-1, galectin-3 in papillary carcinoma was higher than in follicular carcinoma, according to 82.4% (0%), 89.7% (0%), 97.1% (75%), 32.4% (0%). The rate of BRAF-V600E mutation in papillary carcinoma was 70.6%, none of follicular carcinoma was positive. Conclusions: Immuohistochemical expression with thyrogolulin, TTF1, CK19, HBME-1 markers in recurrent, metastasis differentiated thyroid carcinoma was hingly positive and higher in papillary carcinoma than follicular carcinoma; the rate of BRAF-V600E mutation in papillary carcinoma was 70,6 %.
Key words: Differentiated thyroid carcinoma, immunohistochemistry, recurrence, metastasis.
TÓM TẮT
Mục tiêu: Đánh giá biểu hiện một số dấu ấn hoá mô miễn dịch (HMMD) trong ung thư biểu mô tuyến giáp (UTBMTG) thể biệt hoá tái phát/di căn. Đối tượng và phương pháp: 72 bệnh nhân (BN) được phẫu thuật tổn thương tái phát, di căn tại Bệnh viện Trung ương Quân đội (TWQĐ) 108 từ 11/2014 đến 10/2017. Đánh giá biểu hiện HMMD một số dấu ấn từ bệnh phẩm đúc khối nến của những BN trên. Kết quả: UTBMTG thể biệt hoá tái phát, di căn được phẫu thuật lại biểu hiện dương tính khá cao với các dấu ấn thyroglobulin, TTF1, CK19, HBME-1 tương ứng là 86,1%; 83,3%; 84,7%; 95,8%; galectin-3 dương tính chiếm 30,6%. Trong đó, thể nhú dương tính với các dấu ấn TTF1 (82,4%), CK19 (89,7%), HBME-1 (97,1%), Galectin-3 (32,4%) cao hơn ở thể nang tương ứng là 0%, 0%, 75%, 0%. Tình trạng đột biến gen BRAF-V600E xảy ra ở thể nhú là 70,6%, không gặp một trường hợp thể nang nào dương tính. Kết luận: UTBMTG thể biệt hoá tái phát/di căn biểu hiện dương tính các dấu ấn hoá mô miễn dịch TTF1, HBME-1, CK19, Galectin-3 khá cao và cao hơn ở thể nhú so với thể nang; đột biến gen BRAF-V600E ở thể nhú là 70,6%.
Từ khoá: Ung thư biểu mô tuyến giáp thể biệt hoá, hoá mô miễn dịch, tái phát, di căn.
Chịu trách nhiệm chính: Ngô Thị Minh Hạnh
Ngày nhận bài: 01/7/2019
Ngày phản biện khoa học: 21/7/2019
Ngày duyệt bài: 1/8/2019
1. ĐẶT VẤN ĐỀ
Ung thư biểu mô tuyến giáp (UTBMTG) thể biệt hoá bao gồm thể nhú và thể nang. Bệnh nhân (BN) UTBMTG thể biệt hóa sau khi được phẫu thuật cắt tuyến giáp toàn bộ, điều trị xóa mô giáp bằng 131I được theo dõi tái phát/di căn bằng xét nghiệm chính là nồng độ thyroglobulin (Tg), siêu âm và chụp xạ hình toàn thân với 131I. Tỷ lệ tái phát, di căn xảy ra ở khoảng 10-30% các trường hợp UTBMTG thể biệt hóa [6].
BN sau khi được phẫu thuật cắt bỏ khối tái phát, di căn, ngoài việc khẳng định chẩn đoán còn rất cần được đánh giá về thể mô bệnh học (MBH). Thông thường các bác sĩ giải phẫu bệnh dễ dàng xác định thể MBH nguyên phát nhưng trong một số trường hợp BN đã được điều trị, lại xuất hiện khối tái phát/di căn thì khó có thể xác định chính xác thể MBH nhất là những thể bệnh tiến triển.
Hoá mô miễn dịch (HMMD) được ứng dụng trong nhiều năm qua và đã hỗ trợ rất nhiều trong việc chẩn đoán giải phẫu bệnh. Việc ứng dụng HMMD trong chẩn đoán UTBMTG thể biệt hoá có thể giúp cho việc đánh giá chính xác thể bệnh, có ý nghĩa tiên lượng và đánh giá mức độ đáp ứng điều trị. Tuy nhiên, cho đến nay tại Việt Nam vấn đề này còn rất ít được nghiên cứu.
Vì vậy, chúng tôi tiến hành nghiên cứu này với mục tiêu: Đánh giá biểu hiện một số dấu ấn hoá mô miễn dịch trong ung thư biểu mô tuyến giáp thể biệt hoá tái phát, di căn.
ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
72 bệnh nhân UTBMTG thể biệt hóa được phẫu thuật tồn thương tái phát, di căn tại Bệnh viện TWQĐ 108 từ 11/2014 đến 10/2017.
2.1. Tiêu chuẩn chọn bệnh nhân
2.1.1. Tiêu chuẩn lựa chọn
– BN được phẫu thuật cắt toàn bộ tuyến giáp, điều trị 131I.
– Chẩn đoán MBH ban đầu là UTBMTG thể biệt hóa.
– Không có bằng chứng khối u trên lâm sàng và xạ hình chẩn đoán hoặc xạ hình sau điều trị nhưng phát hiện tổn thương trên CT hoặc PET/CT
– Kết quả MBH sau mổ tổn thương tái phát, di căn khẳng định ung thư.
– Có đầy đủ hồ sơ bệnh án, tiêu bản và khối nến lưu trữ.
2.1.2. Tiêu chuẩn loại trừ: BN được chẩn đoán là UTBMTG thể biệt hóa nhưng không phẫu thuật cắt toàn bộ tuyến giáp, không điều trị 131I, không còn đủ hồ sơ bệnh án, tiêu bản và khối nến lưu trữ, kết quả MBH sau mổ là lành tính.
2.2. Phương pháp nghiên cứu
2.2.1. Thiết kế nghiên cứu: Mô tả cắt ngang.
2.2.2. Cỡ mẫu nghiên cứu: Chọn mẫu toàn bộ.
2.2.3. Cách chọn mẫu nghiên cứu
Tất cả các BN được phẫu thuật điều trị UTBMTG thể biệt hóa tái phát, di căn từ 11/2014 đến 10/2017, đủ tiêu chuẩn như ở mục 2.1.1 được chọn vào nghiên cứu.
2.3. Cách tiến hành nghiên cứu
– Khai thác hồ sơ bệnh án.
– Đọc lại toàn bộ các tiêu bản MBH, những trường hợp chưa rõ chẩn đoán được cắt nhuộm lại. Phân thể MBH theo WHO năm 2004.
– Xét nghiệm HMMD: Các tiêu bản nhuộm được cắt từ bệnh phẩm đúc trong khối paraffin đã được cắt nhuộm HE trước đó, được thực hiện trên máy BenchMark ULTRA, Ventana theo hướng dẫn của nhà sản xuất với các dấu ấn TTF1, Thyroglobulin, CK19, Galectin-3, BRAF-V600E. Trong mỗi lần nhuộm đều có tiêu bản chứng dương và chứng âm.
2.4. Xử lý số liệu:
Bằng phần mềm SPSS Version 22.0.
3. KẾT QUẢ NGHIÊN CỨU
Bảng 1. Bộc lộ dấu ấn hoá mô miễn dịch trong UTBMTG thể biệt hoá tái phát, di căn
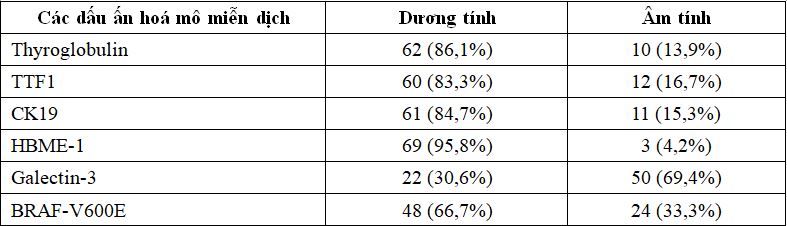
* Nhận xét: UTBMTG thể nhú biệt hoá tái phát/di căn biểu hiện dương tính với các dấu ấn Thyroglobulin, TTF1, CK19, HBME-1 khá cao tương ứng là 81,6%, 83,3%, 84,7%, 95,8%; Galectin-3 dương tính chiếm 30,6%. Tình trạng đột biến gen BRAF-V600E trong UTBMTG thể biệt hoá tái phát, di căn nói chung là 66,7%.
Bảng 2. Bộc lộ dấu ấn Thyroglobulin trong UTBMTG thể biệt hoá tái phát, di căn

* Nhận xét: Thể nang biểu lộ dương tính với thyroglobulin cao hơn thể nhú tương ứng là 100% và 85,3%.
Bảng 3. Bộc lộ dấu ấn TTF1 trong UTBMTG thể biệt hoá tái phát, di căn

* Nhận xét: Thể nhú biểu hiện dương tính với TTF1 thấp hơn thể nang tương ứng là 82,4% và 100%.
Bảng 4. Bộc lộ dấu ấn CK19 trong UTBMTG thể biệt hoá tái phát, di căn

* Nhận xét: CK19 dương tính ở thể nhú chiếm 89,7%, không có trường hợp thể nang nào dương tính với CK19.
Bảng 5. Bộc lộ dấu ấn HBME1 trong UTBMTG thể biệt hoá tái phát, di căn

* Nhận xét: Thể nhú biểu hiện dương tính với HBME1 cao hơn thể nang tương ứng là 97,1% và 75%.
Bảng 6. Bộc lộ dấu ấn Galectin-3 trong UTBMTG thể biệt hoá tái phát/di căn

* Nhận xét: Thể nhú biểu hiện dương tính với Galectin-3 là 32,4%, không có trường hợp thể nang dương tính với Galectin-3.
Bảng 7. Bộc lộ dấu ấn BRAF-V600 trong UTBMTG thể biệt hoá tái phát/di căn

* Nhận xét: Tỉ lệ phát hiện đột biến gen BRAF-V600E bằng HMMD trong trường hợp UTBMTG thể nhú tái phát, di căn là 70,6%, không có trường hợp thể nang nào dương tính.
4. BÀN LUẬN
Trong nghiên cứu của chúng tôi UTBMTG thể biệt hoá tái phát, di căn biểu hiện dương tính với các dấu ấn Thyroglobulin, TTF1, CK19, HMBE-1 khá cao tương ứng là 86,1%; 83,3%; 84,7%; 95,8%.
* Thyroglobulin
Tỉ lệ dương tính của thyroglobulin trong UTBMTG phụ thuộc vào mức độ biệt hoá và thể MBH. Trong các nghiên cứu đã công bố lên đến 100% thyroglobulin dương tính ở ung thư thể nhú thông thường, 75-96% thể nhú biến thể nang, 57-92% thể kém biệt hoá và gần như không biểu hiện ung thư không biệt hoá và ung thư thể tuỷ [1][5].
Còn trong nghiên cứu của chúng tôi, thyroglobulin dương tính ở thể biệt hoá tái phát, di căn nói chung là 86,1%.
Trong đó, thyroglobulin dương tính mạnh và lan toả ở 100% những tế bào thể nang, tương tự như nghiên cứu của Trần Ngọc Dũng [1].
Như vậy, thyroglobulin biểu hiện trong tổn thương di căn tương tự như trong khối u nguyên phát.
Tuy nhiên, thyrogolubin cũng dương tính ở các mô bào trong xoang hạch dẫn đến nhầm lẫn trong chẩn đoán di căn ung thư tuyến giáp dạng nang vào hạch [9] và cũng do tính chất nhuộm nền lan toả xung quanh mô u cũng đã dẫn đến dương tính giả trường hợp ung thư phổi di căn tuyến giáp [4].
* TTF1 (Thyroid transcription factor-1)
Các tế bào biểu mô nang tuyến giáp bình thường dương tính lan toả với TTF1. Trong nghiên cứu này, TTF1 dương tính trong UTBMTG thể biệt hoá tái phát, di căn là 83,3%.
Trong đó, biểu hiện nhiều hơn ở thể nhú là 82,4%, tất cả thể nang đều dương tính. Khi sử dụng kết hợp cùng với thyroglobulin, TTF1 là một dấu ấn có hiệu quả để xác định nguồn gốc tuyến giáp của tế bào u.
* HBME-1
HBME-1 đã được cho rằng là dấu ấn hữu hiệu trong chẩn đoán UTBMTG, dương tính ở màng bào tương mặt bên và chất keo ở bề mặt tế bào u, có thể dương tính với bào tương và biểu lộ hầu hết các tế bào nang tuyến giáp ung thư gồm ung thư UTBMTG thể biệt hoá, thể kém biệt hoá.
Trong nghiên cứu của chúng tôi, thể nhú biểu hiện dương tính với HBME-1 cao hơn thể nang tương ứng là 97,1% và 75%.
Nghiên cứu của Ito cho thấy HBME dương tính 60,9% ở UTBMTG thể nang và cao hơn u tuyến giáp thể nang có ý nghĩa thống kê với p < 0,0001. 100% dương tính với ung thư tuyến giáp thể nhú [3].
* Galectin-3
Galectin là một protein gắn với phần còn lại β-galactoside trên glycoprotein bề mặt tế bào được cho là điều hoà tăng sinh tế bào phát triển bình thường và chết theo chu kỳ cũng như là sự chuyển dạng ác tính và sự di căn ung thư.
Nhuộm HMMD galectin-3 cho thấy sự biểu hiện khác nhau trong ung thư tuyến giáp.
Trong trường hợp nghiên cứu UTBMTG thể biệt hoá tái phát, di căn của chúng tôi thấy galectin-3 dương tính là 30,6%. Trong đó, không có trường hợp thể nang nào dương tính với Galectin-3.
Trong nghiên cứu của Sumana cho thấy Galectin-3 có giá trị cho chẩn đoán các khối u tuyến giáp lành tính và ác tính với độ nhạy 86%, độ đặc hiệu là 85%, giá trị dự báo dương tính là 89,66% và giá trị dự báo âm tính là 80,95%.
Tuy nhiên, không có sự khác biệt giữa kết quả nhuộm giữa ung thư thể nhú và các thể tuyến giáp ác tính khác [8].
* CK19:
Biểu mô nang tuyến giáp bình thường thường âm tính với CK19 mặc dù có dương tính ổ ở nhu mô giáp kế cận khối u và tế bào biểu mô nang trong trường hợp viêm tuyến giáp [2].
Trong nghiên cứu của chúng tôi, CK19 dương tính 89,7% ở thể nhú và không có trường hợp nào dương tính với thể nang. Còn trong nghiên cứu của Nechifor-boila, CK19 âm tính 45,5% các trường hợp, trong đó không gặp trường hợp nào dương tính ở tổn thương tuyến giáp lành tính (u tuyến, tăng sản nốt, viêm tuyến giáp), chủ yếu gặp ở ung thư thể nhú thông thường [7].
Các nghiên cứu cũng đã chỉ ra không có dấu ấn nào đặc hiệu cho UTBMTG nhưng phối hợp nhiều dấu ấn hoá mô sẽ nâng tính đặc hiệu và độ nhậy cao hơn phát hiện những trường hợp ung thư thể nhú thông thường [7].
Trong nghiên cứu của chúng tôi có 2 trường hợp âm tính cả 3 dấu ấn HBME1, CK19, Galectin-3 trong đó có 1 trường hợp ung thư thể nang và 1 trường hợp biến thể tế bào ưa acid, không gặp trường hợp thể nhú thông thường nào âm tính cả 3 dấu ấn trên.
* BRAF-V600E
Gen BRAF nằm ở vị trí 7q34 mã hoá cho protein kinase serine-threonine. Đột biến gen BRAF dẫn đến việc sản xuất protein kinase không còn nhậy với tín hiệu ức chế bình thường, kết quả là tăng sinh tế bào, giảm chu trình chết tế bào và kích thích sinh u. Trong UTBMTG thể nhú, đột biến này được báo cáo từ 20-80% các trường hợp.
Trong nghiên cứu của chúng tôi, phát hiện đột biến gen ở thể nhú tái phát, di căn là 70,6% không phát hiện trường hợp nào ở thể nang. Đột biến gen BRAF-V600E là dấu ấn đặc hiệu cho ung thư thể nhú và thường liên quan đến bệnh tiến triển [10].
Trong nghiên cứu của Xiaoli Zhu phát hiện đột biến BRAF-V600E bằng phương pháp HMMD là 68,8% và đặc biệt có sự tương đồng ở 59 trường hợp dương tính ở cả khối u nguyên phát và ở hạch di căn [11]. Những trường hợp bệnh nhân có ung thư nguyên phát ở Việt Nam trước đây ít có khả năng khảo sát lại khối u ban đầu thì việc đánh giá tình trạng đột biến gen ở những khối u di căn có giá trị cho việc khẳng định chẩn đoán, đánh giá tiên lượng và đáp ứng điều trị.
5. KẾT LUẬN
– UTBMTG thể biệt hoá tái phát/di căn dương tính với các dấu ấn thyroglobulin, TTF1, CK19, HBME-1 khá cao tương ứng là 86,1%; 83,3%; 84,7%; 95,8% và cao hơn ở thể nhú so với thể nang.
– Tỷ lệ phát hiện đột biến gen BRAF-V600E ở thể nhú là 70,6%, không có trường hợp nào ở thể nang.
TÀI LIỆU THAM KHẢO
- Trần Ngọc Dũng, Lê Đình Roanh, Nguyễn Văn Chủ (2012). Nghiên cứu ứng dụng hoá mô miễn dịch trong ung thư biểu mô tuyến giáp biệt hoá. Tạp chí Y học Việt nam, 2 (396), tr. 54-59.
- Baloch ZW, Abraham S, Roberts S. et al (1999). Differential expression of cytokeratins in follicular variant of papillary carcinoma: an immunohistochemical study and its diagnostic utility. Hum Pathol. 30(10), pp. 1166-71.
- Ito Y, Yoshida H, Tomoda C et al (2005). HBME-1 expression in follicular tumor of the thyroid: an investigation of whether it can be used as a marker to diagnose follicular carcinoma. Anticancer Res, 25(1A), pp. 179-82.
- Kanjanahattakij N, Chayangsu P, Kanoksil W et al (2015). Pitfall in immunohistochemical staining for thyroglobulin in case of thyroid metastasis from lung carcinoma. Cytojournal, 12, pp. 27.
- Liu H, Lin F (2015). Application of Immunohistochemistry in Thyroid Pathology. Arch Pathol Lap Med, 139, pp. 67- 82.
- Mazzaferri E.L, Jhiang S.M (1994). Long-term impact of initial surgical and medical therapy on papillary and follicular thyroid cancer. J. Med, 97(5), pp. 418-428.
- Nechifor-Boilă A, Cătană R, Loghin A et al (2014). Diagnostic value of HBME-1, CD56, Galectin-3 and Cytokeratin-19 in papillary thyroid carcinomas and thyroid tumors of uncertain malignant potential, Rom J Morphol Embryol, 55(1), pp. 49-56.
- Sumana BS, Shashidhar S, Shivarudrappa AS (2015). Galectin-3 Immunohistochemical Expression in Thyroid Neoplasms. J Clin Diagn Res, 9(11), pp. 7-11.
- Venkatraman L, Maxwell P, McCluggage WG (2001). Thyroglobulin immunoreactivity in lymph node histiocytes: a potential diagnostic pitfall. J Clin Pathol, 54(4), pp. 314-6.
- Xing M. (2013). Molecular pathogenesis and mechanisms of thyroid cancer. Rev. Cancer, 13 (3), pp. 184–199
- Zhu X, Luo Y, Bai Q et al (2016). Specific immunohistochemical detection of the BRAF-V600E mutation in primary and metastatic papillary thyroid carcinoma. Exp Mol Pathol,100(1), pp. 236-41.
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam