LIÊN QUAN GIỮA SUY GIẢM THẦN KINH NHẬN THỨC VỚI HÌNH ẢNH HỌC MRI SỌ NÃO TRÊN BỆNH NHÂN ĐÁI THÁO ĐƯỜNG TYPE 2
Ths. BS. Nguyễn Văn Vy Hậu(1),
TS. Nguyễn Hải Thủy, PGS. TS. Hoàng Minh Lợi(2)
Nghiên cứu sinh Đại học Y Dược Huế, BV Gia Đình Đà Nẵng
Trường Đại học Y Dược Huế
ABSTRACT
Correlation between the brain lesion detection in magnetic resonance imaging with the neurocognitive disorders of patients with type 2 diabetes
Objective: to evaluate neurocognitive disorders byMMSE and MoCA tests and the neuropsychological risk factors in the type 2 diabetic patients, and to define the correlations between neurocognitive impairment with Brain Lesion detection in Magnetic Resonance Imaging in these patients. Methods: 50 patients with type 2 DM (mean age 63,2± 12,8 years, mean diabetic duration 13.8 ± 10.8 years)were evaluated the neurocognitive disorders byMMSE and MoCA tests and performed the brain MRI. Results: Age and duration of DM were significantly associated with cognitive dysfunction by MMSE and MoCA test (p < 0,001). HbA1c and glucose level, cholesterol, LDL.c. Triglycerid were significantly associated with nerocognitive impairment. The volume hypothalamus have decreased between normal neurocognitive group, mild neurocognitive and dementia (2,78 ± 0,95; 1,91 ± 0,38; 1,61 ± 0,38; p < 0,001, repectively), volume lateral ventricles (2,78 ± 1,13; 2,89 ± 1,36; 3,66 ± 1,24 (p< 0,001 repectively; 100% dementia group and 75% vas-dementia group, and 45,45% NMD group have injured cerebral infarction defect. Periventricular and subcortical white matter lesions (WMLs) and subcorticalatrophy were significantly associated with neurocognitive impairment. Conclusion: The neurocognitive impairment in the type 2 diabetes were significantly associated with volume hypothalamus and volume lateral ventricles, cerebral infarction defect, periventricular and subcortical white matter lesion ( WMLs) and subcortical atrophy. The structure and function of brain have change from mild neurocognitive impairment to progressive major dementia.
TÓM TẮT
Mục tiêu nghiên cứu: 1. Đánh giá mối liên quan, tương quan giữa suy giảm thần kinh nhận thức và các yếu tố nguy cơ. 2. Hình ảnh học cộng hưởng từ với mức độ suy giảm thần kinh nhận thức. Đối tượng và phương pháp nghiên cứu: Nghiên cứu mô tả cắt ngang 50 bệnh nhân đái tháo đường độ tuổi trung bình 63,2 ± 12,8 năm; thời gian mắc bệnh đái tháo đường 13,8 ± 10,8 năm; được chọn đánh giá nhận thức qua hai thang điểm MMSE và MoCa, sau đó phân tầng nhận thức theo DSM 5 và chụp MRI sọ não đánh giá. Thống kê bằng phần mềm SPSS 20, sử dụng các test sàng lọc tính trung bình, ANOVA test và ROC… Kết quả: Tuổi và thời gian mắc bệnh đái tháo đường có liên quan mật thiết với mức độ suy giảm nhận thức (p< 0,01) qua đánh giá hai thang điểm MMSE và MoCa. Nồng độ đường máu (AUC ROC 73,8, điểm cắt 6,15, p< 0,05), cholesterol máu (AUC ROC 76,6, điểm cắt 4,95, p < 0,05), LDL.c (AUC ROC 67,3, điểm cắt 2,6, p > 0,05) và triglyceride (AUC ROC 76,3; điểm cắt 1,21; p < 0,05) có tương quan với với mức độ suy giảm thần kinh nhận thức theo thang điểm MoCa. Thang điểm MoCa có giá trị hơn về độ nhạy và độ đặc hiệu khi đánh giá nhận thức ở bệnh nhân đái tháo đường (AUC ROC của MoCa 98%, Se=89%, Sp=99% CI (0,95-1) và AUC ROC của MMSE 88% Se=82%, Sp=88% CI (0,78-0,92), Kappa=2, p<0,001). Thể tích vùng đồi thị và hồi hải mã đã giảm rất nhiều có ý nghĩa thống kê (2,86 ± 0,67 so với 2,12 ± 0,98; p <0,01 bởi MMSE và 2,78 ± 0,95 so với 1,91 ± 0,38; p< 0,001 bởi MoCa) ở đối tượng suy giảm thần kinh nhận thức qua hình ảnh học MRI. Phân tầng suy giảm thần kinh nhận thức theo DSM 5 với hình ảnh học MRI ghi nhận tình trạng giảm thể tích đồi thị nặng dần theo mức độ suy giảm nhận thức giữa các nhóm đối tượng bình thường, suy giảm nhận thức nhẹ và sa sút trí tuệ, cụ thể tương ứng với V đồi thị giữa các nhóm: 2,78 ± 0,95; 1,91 ± 0,38; 1,61 ± 0,38 ; p < 0,001. Sự thay đổi thể tích não thất bên cũng gia tăng tỷ lệ với mức độ nặng của suy giảm nhận thức từ bình thường đến suy giảm thần kinh nhận thức nhẹ đến sa sút trí tuệ: 2,78 ± 1,13; 2,89 ± 1,36; 3,66 ± 1,24 ( p< 0,001). Các tổn thương như nhồi máu não lỗ khuyết có mặt 100% các đối tượng có sa sút trí tuệ, 75% ở đối tượng sa sút trí tuệ mạch máu và 45,45 % ở nhóm đối tượng có suy giảm thần kinh nhận thức mức độ nhẹ (p< 0,01). 54% ( 27/50) đối tượng nghiên cứu có nhồi máu lỗ khuyết đơn ổ đến đa ổ, trong đó 61,91% bệnh nhân có biểu hiện suy giảm thần kinh nhận thức theo MoCa và 85,71% có suy giảm nhận thức theo MMSE. 100% tổn thương não chất trắng và tình trạng teo não xuất hiện ở bệnh nhân có sa sút trí tuệ và 31,22 % ở nhóm sa sút trí tuệ mạch máu, 13,64% nhóm có suy giảm thần kinh nhận thức nhẹ. Tuy nhiên sự khác biệt này không có ý nghĩa thống kê ( p> 0,05). Kết luận: Các dạng tổn thương não thường gặp trên MRI sọ não ở bệnh nhân đái tháo đường là giảm thể tích đồi thì, tăng thể tích não thất bên, nhồi máu não lỗ khuyết và bệnh não chất trắng+ teo não. Mức độ suy giảm thần kinh nhận thức ở bệnh nhân đái tháo đường có liên quan mật thiết với tình trạng tăng thể tích não thất bên, giảm thể tích vùng đồi thì và hồi hãi mã. Teo não và bệnh lý chất trắng xuất hiện trong giai đoạn sa sút trí tuệ mức độ nhẹ, sa sút trí tuệ mạch máu và sa sút trí tuệ thật sự. Điều đáng ghi nhận là ngay tại thời điểm có biểu hiện suy giảm nhận thức nhẹ (NMD) thì không những thể tích não thất và thể tích đồi thị cũng đã thay đổi mà tổn thương não chất trắng cũng như teo não đều xuất hiện. Và sự thay đổi này có chiều hướng gia tăng theo mức độ nặng (gia tăng đường máu, mỡ máu, tình trạng hạ đường máu nhiều lần) và thời gian mắc bệnh đái tháo đường.
Chịu trách nhiệm chính: Nguyễn Văn Vy Hậu
Ngày nhận bài:
Ngày phản biện khoa học:
Ngày duyệt bài:
1. ĐẶT VẤN ĐỀ
Đái tháo đường là một bệnh chuyển hóa phức tạp, không lây, và gây ra nhiều biến chứng nặng nề lên các cơ quan của cơ thể như: nhồi máu cơ tim, suy thận, giảm thị lực, suy giảm trí nhớ, bệnh lý bàn chân đái tháo đường,…Đây là nguyên nhân gây tử vong đứng thứ ba sau ung thư và bệnh lý tim mạch. Năm 2015, IDF đã đưa ra nghiên cứu cho thấy cứ 6 giây qua đi có 1 người chết vì đái tháo đường, và hằng năm đái tháo đường cũng cướp đi sinh mạng của khoảng 4.9 triệu người trên thế giới. Nó như tảng băng trôi, tiến triển âm thầm, luôn gây ra những biến chứng bất ngờ khiến người bệnh khó nhận thấy được.
Cứ 2 người mắc đái tháo đường thì có 1 người không biết họ đang mắc bệnh. Và số lượng người hiểu biết về các nguy cơ và biến chứng của bệnh cũng không nhiều, đặc biệt là các biến chứng ít được biết đến như suy giảm nhận thức với các biểu hiện như: giảm trí nhớ (trí nhớ lời nói, trí nhớ hình ảnh, trí nhớ về công việc, trí nhớ tạm thời và trí nhớ lâu dài), mất sự chú ý, suy giảm tốc độ xử lý thông tin, giảm khả năng nói lưu loát, giảm khả năng hoạt động sinh hoạt thường ngày, thay đổi tính cách, trầm cảm,…lâu dài sẽ tiến triển đến nguy cơ sa sút trí tuệ nếu không được điều trị kịp thời.
Tại Việt Nam, tỷ lệ người bệnh mắc đái tháo đường trong đó có đái tháo đường type 2 có tình trạng bị trầm cảm, suy giảm trí nhớ và biểu hiện của Alzheimer cũng ngày một gia tăng nhưng chưa được quan tâm và điều trị đúng mức. Nguyên nhân và các yếu tố nguy cơ sinh bệnh học chưa được làm rõ, phương pháp chẩn đoán, điều trị và ngăn ngừa nguy cơ suy giảm nhận thức, sa sút trí tuệ vẫn chưa được xác định, cũng như chưa có nhiều nghiên cứu về so sánh mối tương quan giữa sa sút trí tuệ và các yếu tố nguy cơ ở bệnh nhân đái tháo đường type 2.
Xuất phát từ những vấn đề trên, chúng tôi tiến hành nghiên cứu đề tài này nhằm mục tiêu:
- Đánh giá mối liên quan, tương quan giữa suy giảm thần kinh nhận thức và các yếu tố nguy cơ.
- Hình ảnh học cộng hưởng từ với mức độ suy giảm thần kinh nhận thức.
2. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng nghiên cứu
2.1.1. Tiêu chuẩn chọn bệnh
Các người bệnh được lựa chọn ngẫu nhiên đưa vào nghiên cứu có các đặc điểm sau:
- Đủ 50 tuổi trở lên, không phân biệt giới tính, dân tộc, nghề nghiệp.
- Trình độ học vấn: từ cấp I trở lên (có biết chữ).
- Được chẩn đoán ĐTĐ type 2 theo tiêu chuẩn chẩn đoán của ADA năm 2016 đang khám hoặc điều trị tại Bệnh viện Đa khoa Gia Đình Đà Nẵng.
- Những bệnh nhân này được kiểm tra bằng các thang điểm đánh giá nhận thức: MMSE và MoCA.
- Tiêu chuẩn chẩn đoán ĐTĐ theo ADA năm 2016 [20]
Chẩn đoán ÐTÐ khi có một trong 4 tiêu chuẩn sau đây (tiêu chuẩn 1.2 cần xét nghiệm ở một thời điểm khác nhau):
- G0 ≥ 7 mmol/l.
- G2 ≥ 11.1 mmol/l.
- Glucosemáu bất kỳ = 11.1 mmol/l kèm theo các triệu chứng tăng Glucose máu điển hình hoặc các triệu chứng của cơn tăng Glucosemáu cấp (chỉcầnmộtlầnđủchẩnđoán).
- HbA1c ≥ 6.5%.
- Tiêu chuẩn loại trừ
Không đưa vào nghiên cứu các đối tượng có:
- Nghiện rượu.
- Tổn thương thần kinh thực thể.
- Các bệnh lý về tâm thần, thần kinh dẫn đến RLTKNT.
- Sử dụng thuốc an thần, chống loạn thần, thuốc gây ngủ, gây nghiện.
- Hành vi không hợp tác.
- Phạm vi nghiên cứu
- Thời gian nghiên cứu: Từ ngày 13/04/2015 đến ngày 15/06/2016.
- Địa điểm nghiên cứu: Khoa Nội, Bệnh viện Đa khoa Gia Đình Đà Nẵng.
2.2. Phương pháp nghiên cứu
2.2.1. Thiết kế nghiên cứu
Nghiên cứu theo phương pháp mô tả cắt ngang trên 50 bệnh nhân đái tháo đường điều trị thường xuyên tại đơn vị Nội tiết bệnh viện ĐK Gia Đình Đà Nẵng.
2.2.2. Phương pháp thu thập dữ liệu
Việc thu thập dữ liệu được tiến hành theo trình tự các bước:
– Bước 1: Khai thác thông tin người bệnh: tiền sử bệnh, các YTNC, hiểu biết về ĐTĐ và SGTKNT thông qua bảng câu hỏi tự điền (self-rated questionnaire), nhân trắc, BMI, VB…
– Bước 2: Đánh giá mức độ suy giảm thần kinh nhận thức qua 2 thang điểm MMSE và MoCA bằng cách phỏng vấn trực tiếp và phân tầng bằng thang điểm chẩn đoán DSM 5
– Bước 3: Xét nghiệm bổ sung: đường máu, HbA1c, mỡ máu, men gan, chức năng thận…
– Bước 4: Đánh giá lại bằng hình ảnh học cộng hưởng từ
2.2.3. Các tham số nghiên cứu:
Tuổi, giới tính, huyết áp, vòng bụng, cân nặng, chiều cao và BMI, đường máu, lipid máu, tiền sử mắc ĐTĐ và điều trị, tiền sử THA, tiền sử mắc ĐTĐ của gia đình.
Thang điểm đánh giá nhận thức MMSE và MoCA
– Thang điểm MMSE [15]
Cách tiến hành:
Phỏng vấn trực tiếp với mẫu MMSE chuẩn bị sẵn.
Tiến hành tính điểm MMSE của mỗi người bệnh.
Đánh giá mức độ SGNT qua thang điểm MMSE:
24 điểm: bình thường.
19-24 điểm: SGNT nhẹ.
14-19 điểm: SGNT vừa.
0-13 điểm: SGNT nặng
Đánh giá mức độ nhận thức đạt khi: MMSE ≥ 24 điểm.
– Thang điểm MoCA
Cách tiến hành:
Phỏng vấn trực tiếp với mẫu MoCA chuẩn bị sẵn.
Tiến hành tính điểm MoCA của mỗi người bệnh (cộng 1 điểm nếu học <12).
Đánh giá mức độ SGNT qua thang điểm MoCA:
≥ 26 điểm: bình thường.
< 26 điểm: SGNT.
Đánh giá mức độ nhận thức đạt khi: MoCA ≥ 26 điểm.
2.2.5. Xử lý số liệu
Tất cả dữ liệu thu thập được qua điều tra được nhập và xử lý theo chương trình xử lý thống kê SPSS 20.0.
3. KẾT QUẢ VÀ BÀN LUẬN
3.1. Phân tầng mức độ suy giảm thần kinh nhận thức ở các đối tượng nghiên cứu qua 2 thang điểm MMSE VÀ MoCA
3.1.1. Phân tầng mức độ suy giảm thần kinh nhận thức qua thang điểm MMSE
Bảng 3.1. Mức độ suy giảm thần kinh nhận thức của đối tượng nghiên cứu qua thang điểm MMSE
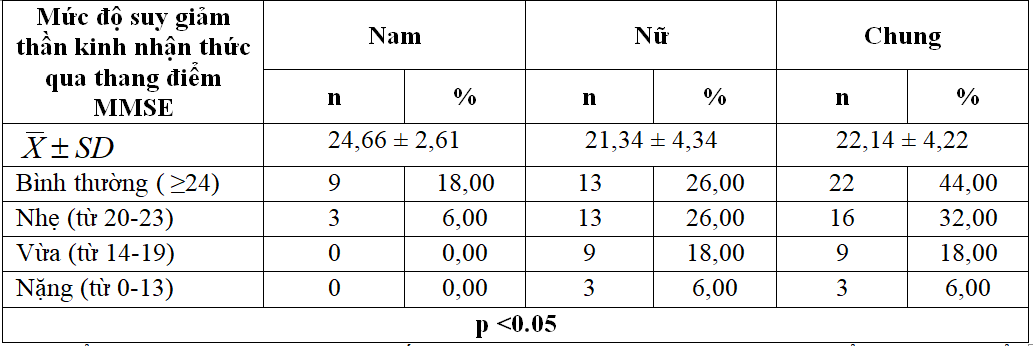
- Điểm MMSE trung bình của đối tượng nghiên cứu là 22.14 ± 4.22 điểm, ở nam điểm MMSE trung bình là 24.66 ± 2.61 điểm cao hơn so với nữ (21.34 ± 4.34 điểm).
- 0% đối tượng nghiên cứu không bị SGTKNT, và 6.0% đối tượng nghiên cứu bị SGTKNT mức độ nặng (có điểm MMSE từ 0-13 điểm). Mức độ SGTKNT nhẹ và vừa lần lượt chiếm tỷ lệ 32.0% và 18.0%.p<0.05: liên quan giữa mức độ SGTKNT qua thang điểm MMSE và giới tính có ý nghĩa thống kê.
3.1.2. Phân tầng mức độ sa sút trí tuệ qua thang điểm MoCA
Bảng 3.2. Mức độ suy giảm thần kinh nhận thức của đối tượng nghiên cứu qua thang điểm MoCA
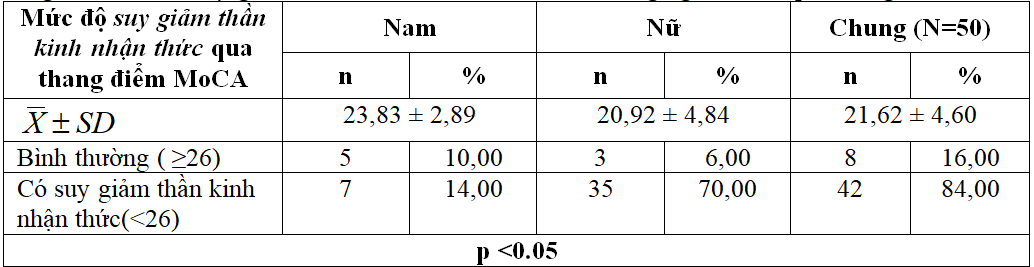
- Điểm MoCA trung bình của đối tượng nghiên cứu là 21.62 ± 4.60 điểm, ở nam điểm MMSE trung bình là 23,83 ± 2,89 điểm cao hơn so với nữ (20,92 ± 4,84 điểm).
- 84,00% đối tượng nghiên cứu có SGTKNT theo thang điểm MoCA và 16,00% đối tượng nghiên cứu có nhận thức bình thường.
- p<0.05: liên quan giữa mức độ SGTKNT qua thang điểm MoCA và giới tính có ý nghĩa thống kê.
3.2. So sánh mối tương quan giữa mức độ suy giảm thần kinh nhận thức và các yếu tố nguy cơ
3.2.1. Lâm sàng
Bảng 3.3. Mối tương quan giữa mức độ suy giảm thần kinh nhận thức và các YTNC lâm sàng
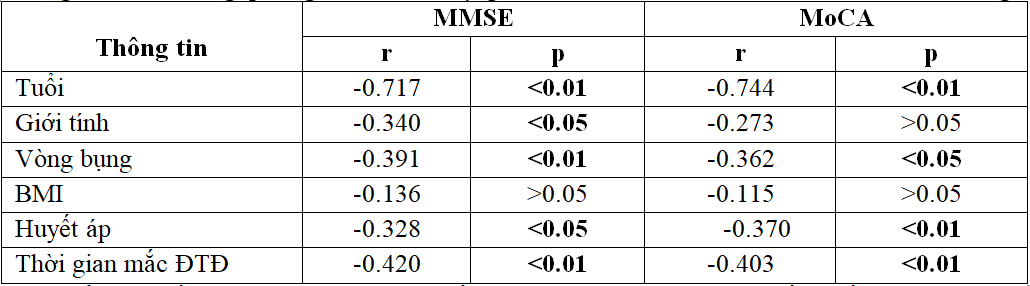
- Tuổi, chỉ số vòng bụng, thời gian mắc bệnh đái tháo đường, chỉ số huyết áp tương quan nghịch khá mật thiết với mức độ suy giảm nhận thức qua hai thang điểm MMSE và MoCa (p<0,01).
3.2.2. Cận lâm sàng
Bảng 3.4. Mối tương quan giữa mức độ sa sút trí tuệ và các YTNC cận lâm sàng
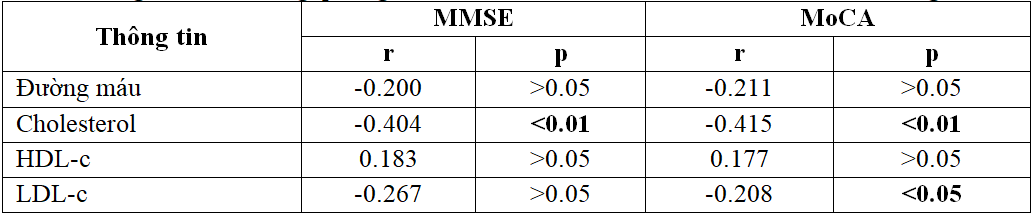
– Chỉ số Cholesterol máu có tương quan nghịch chặt chẽ với mức độ suy giảm nhận thức (p<0,01).
Chỉ số LDL.c có tương quan nghịch mức độ vừa với suy giảm nhận thức qua MoCa (p<0,05).
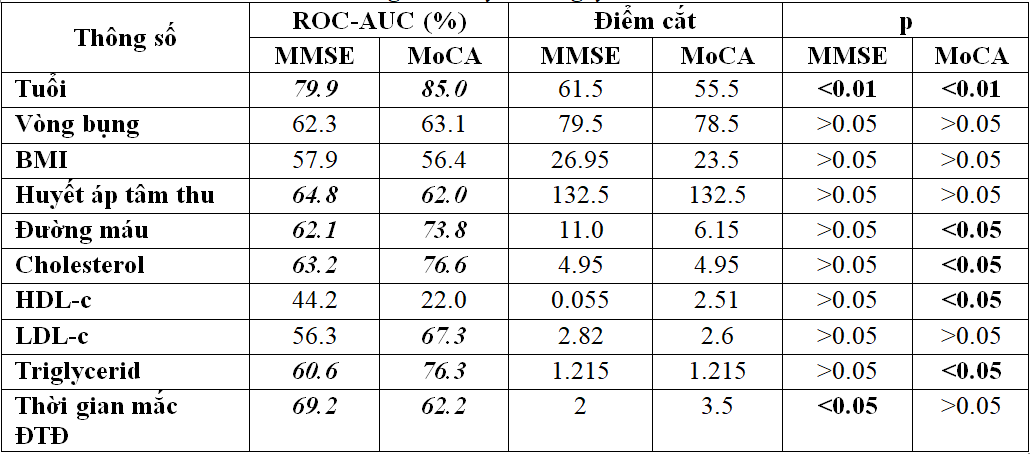
3.3. Xác định điểm cắt và AUC-ROC giữa các yếu tố nguy cơ và mức độ sa sút trí tuệ qua thang điểm MMSE VÀ MoCA
3.3.1. Giá trị điểm cắt các yếu tố nguy cơ với thang điểm MMSE
Bảng 3.5. Điểm cắt và diện tích dưới đường cong ROC giữa các yếu tố nguy cơ và thang điểm MMSE
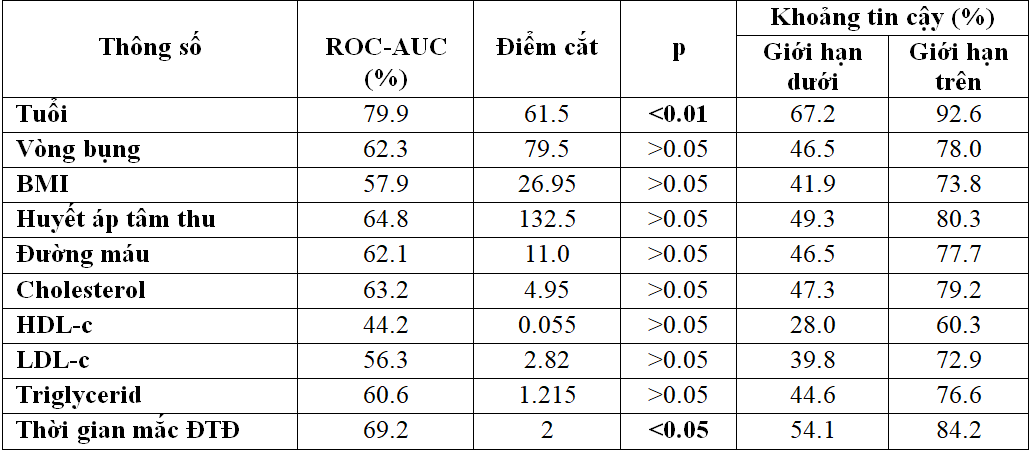
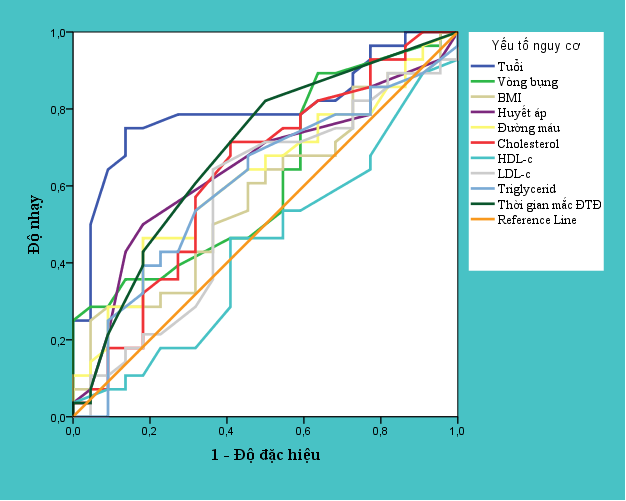
Biểu đồ 3.1. Đường cong ROC giữa các yếu tố nguy cơ với mức độ sa sút trí tuệ qua thang điểm MMSE
– Nếu đánh giá suy giảm nhận thức bằng thang điểm MMSE thì yếu tố nguy cơ tuổi và thời gian mắc bệnh đái tháo đường có AUC-ROC cao hơn các yếu tố còn lại bao gồm:giới tính, chỉ số mỡ máu, huyết áp tâm thu, đường máu tuy nhiên AUC-ROC của các yếu tố này cũng đều đạt trên 60%.
3.3.2. Giá trị điểm cắt giữa các yếu tố nguy cơ với thang điểm MoCa
Bảng 3.6. Điểm cắt và diện tích dưới đường cong ROC giữa các yếu tố nguy cơ và thang điểm MoCA
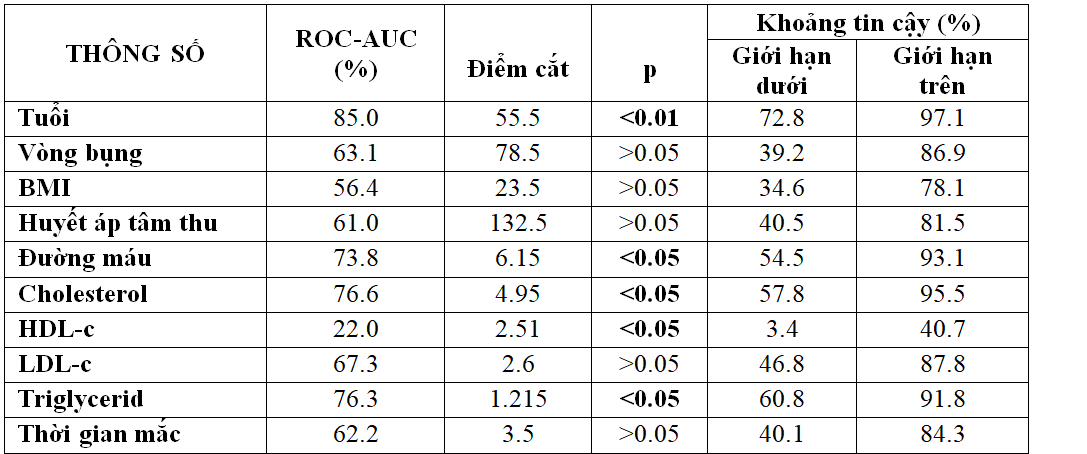
Biểu đồ 3.4. Đường cong ROC giữa các yếu tố nguy cơ với mức độ sa sút trí tuệ qua thang điểm MoCA
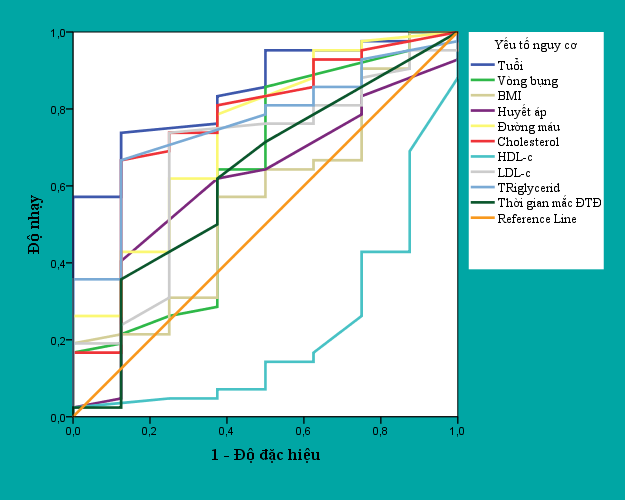
– Nếu dung thang điểm Moca đánh giá mức độ suy giảm nhận thức với các yếu tố nguy cơ thì AUC ROC của các yếu tố như tuổi, mỡ máu, thời gian mắc đái tháo đường, đường máu đạt trên 60%. Điều đáng ghi nhận là chỉ số HDL.c càng giảm thì nguy cơ suy giảm nhận thức càng tăng cao.
3.3.3. So sánh độ nhạy và độ đặc hiệu của hai thang điểm MMSE và MoCa trong đánh giá suy giảm thần kinh nhận thức
Biểu đồ 3.3. So sánh độ nhạy và độ đặc hiệu của 2 thang điểm MMSE và MoCA
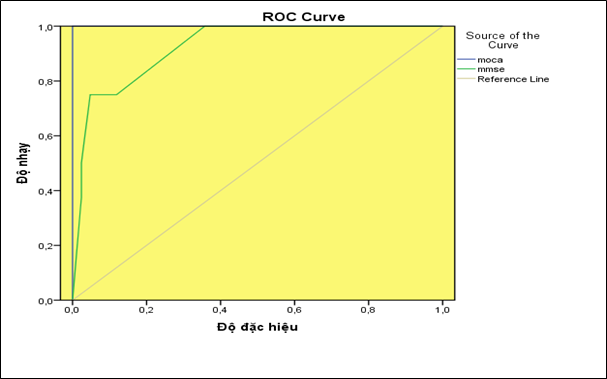
Thang điểm MoCA nhạy hơn so với thang điểm MMSE trong đánh giá mức độ SGTKNT ở người bệnh ĐTĐ type 2. AUC ROC của MoCa 98%, Se=89%, Sp=99% CI ( 0,95-1) và AUC ROC của MMSE 88% Se=82%, Sp=88% CI (0,78-0,92), Kappa=2, p<0,001
Bảng 3.7. So sánh thang điểm MMSE và MoCA qua điểm cắt và diện tích dưới đường cong ROC giữa các yếu tố nguy cơ
Diện tích dưới đường cong ROC giữa các YTNC với thang điểm MoCA lớn hơn so với MMSE ở các YTNC: tuổi, VB, ĐM, Chol, LDL-c, Trig. Điểm cắt tương ứng trong thang điểm MoCA nhỏ hơn MMSE với độ nhạy và độ đặc hiệu lớn hơn.
3.4. Mối tương quan giữa MRI sọ não với mức độ suy giảm thần kinh nhận thức
Bảng 3.8. Mối liên quan giữa các nhóm tổn thương bệnh lý trên MRI với hai thang điểm MMSE và MoCa
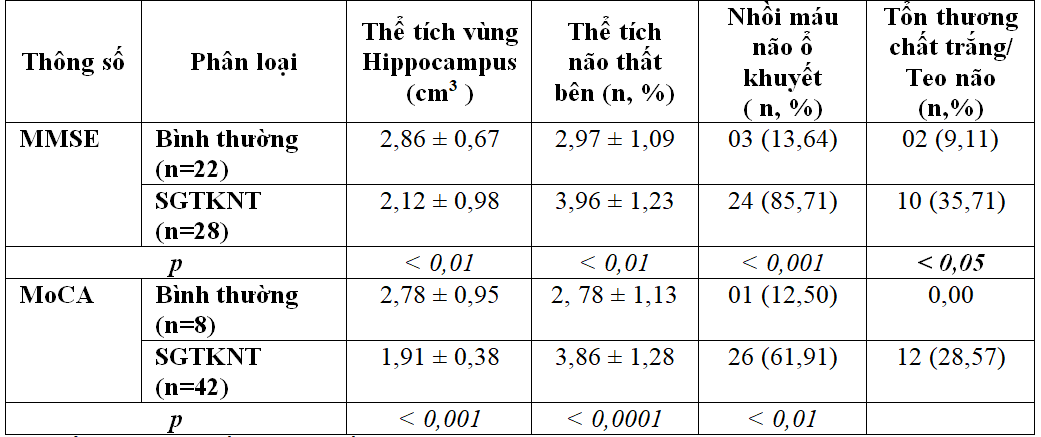
Thể tích vùng đồi thị và hồi hải mã đã giảm rất nhiều có ý nghĩa thống kê (2,86 ± 0,67 so với 2,12 ± 0,98; p <0,01 by MMSE và 2,78 ± 0,95 so với 1,91 ± 0,38; p< 0,001 by MoCa) ở đối tượng suy giảm thần kinh nhận thức qua hình ảnh học MRI.
Thể tích não thất bên ở bệnh nhân đái tháo đường có suy giảm thần kinh nhận thức tăng cao hơn các đối tượng có chức năng nhận thức bình thường. Sự khác biệt này có ý nghĩa thống kê ( p< 0,0001)
54% ( 27/50) đối tượng nghiên cứu có nhồi máu lỗ khuyết đơn ổ đến đa ổ, trong đó 61,91% bệnh nhân có biểu hiện suy giảm thần kinh nhận thức theo MoCa và 85,71% có suy giảm nhận thức theo MMSE.
Bệnh lý não chất trắng kèm hiện tượng teo não chiếm khoảng 28,57% ở đối tượng có suy giảm thần kinh nhận thức theo MoCa.
Trong nghiên cứu của Jack và cộng sự (1991) 85% thể tích vùng đồi thị vào đầu giai đoạn bệnh Alzheimer giảm thấp hơn so với nhóm chứng. Pearlson và cộng sự (1992) tìm thấy các khu vực của vùng đồi thị và hồi hải mãở bệnh nhân Alzheimer giảm 60% diện tích so với nhóm chứng. Scheltens cộng sự (1992) báo cáo độ nhạy để phân biệt sự thay đổi 81% bằng trực quan qua hai vùng đồi thị và thùy thái dương. Sau đó kết quả này đã được báo cáo tương quan teo não với Alzheimer bởi Vermersch và cộng sự (1994). Năm 1993, Killiany và cộng sự có thể xác định một cách chính xác 100% của các tổn thương kết hợp thể tích của vùng đồi thị, thùy thái dương và não thất bên (Killiany et al., 2000) ở bệnh nhân Alzheimer [7].
Jeroen de Bresser và cộng sự (2010), cho thấy mối liên quan giữa teo não và bệnh lý não chất trắng ở bệnh nhân đái tháo đường qua hình ảnh học MRI. Nghiên cứu cho thấy mối liên quan giữa tăng thể tích não thất bên ảnh hưởng đến quá trình teo hồi hải mã và đồi thị, cũng như xuất hiện các tổn thương dạng lỗ khuyết điển hình cho bệnh lý vi mạch máu ở bệnh nhân đái tháo đường trên sọ não [6].
Qua khảo sát 1125 đối tượng đái tháo đường (CASCADE) của Reinhold Schmidt và cộng sự (2004) đã cho thấy mối tương quan khá mật thiết giữa mức độ teo não, tổn thưỡng não chất trắng cao, nhồi máu não lỗ khuyết hơn ở nhóm chứng [9].
3.4.1. Phân tầng suy giảm giảm thần kinh nhận thức theo DSM 5
Nhóm nghiên cứu sử dụng thang điểm đánh giá DSM 5 cập nhật 2016 để phân tầng nhận thức của đối tượng nghiên cứu sau khi đánh giá phân loại có hay không có suy giảm nhận thức qua thang điểm MoCa.
Bảng 3.9. Phân tầng suy giảm thần kinh nhận thức theo theo phân loại DSM 5
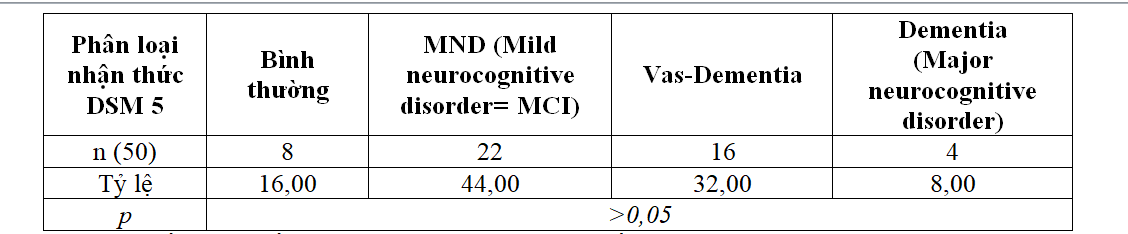
Nhận thấy trong số các bệnh nhân có suy giảm thần kinh nhận thức theo MoCa, sau khi đưa vào phân loại DSM 5 thì có đến 8% sa sút trí tuệ, 32% có sa sút trí tuệ mạch máu và chiếm đa số 44% là rối loạn thần kinh nhận thức mức độ nhẹ. Không có sự khác biệt có ý nghĩa thống kê giữa các nhóm bệnh trong đối tượng nghiên cứu.
3.4.2. Mối liên quan giữa các nhóm tổn thương bệnh lý trên MRI và mức độ suy giảm thân kinh nhận thức theo DSM 5
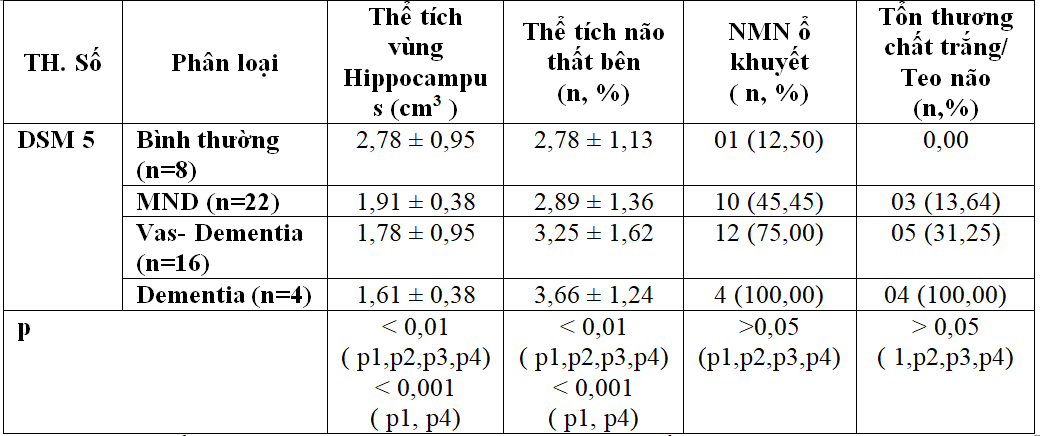
Theo phân tầng suy giảm nhận thức từ mức độ nhẹ đến sa sút trí tuệ, chúng tôi nhận thấy thể tích vùng đồi thị giảm đi giữa các nhóm đối tượng nghiên cứu. Cụ thể ở nhóm có mức độ nhận thức bình thường với nhóm có suy giảm nhận thức nhẹ có sự thay đổi thể tích đồi thì 2,78 ± 0,95 so với 1,91 ± 0,38; giữa nhóm sa sút trí tuệ thể tích đồi thị giảm nhiều nhất: 1,61 ± 0,38 so với 2,78 ± 0,95 ở nhóm đối tượng bình thường ( p < 0,001)
Tương tự như vậy sự thay đổi thể tích não thất bên cũng gia tăng tỷ lệ với mức độ nặng của suy giảm nhận thức: 2,78 ± 1,13 so với 3,66 ± 1,24 ( p< 0,001).
Điều đáng ghi nhận là ngay tại thời điểm ó biểu hiện suy giảm nhận thức nhẹ (NMD) thì không những thể tích não thất và thể tích đồi thị cũng đã thay đổi khá. Và sự thay đổi này có chiều hướng gia tăng theo mức độ nặng và thời gian mắc bệnh đái tháo đường..
Các tổn thương như nhồi máu não lỗ khuyết có mặt 100% các đối tượng có sa sút trí tuệ, 75% ở đối tượng sa sút trí tuệ mạch máu và 45,45 % ở nhóm đối tượng có suy giảm thần kinh nhận thức mức độ nhẹ.
Tổn thương não chất trắng và tình trạng teo não cũng thấy xuất hiện 100% bệnh nhân có sa sút trí tuệ và 31,22 % ở nhóm sa sút trí tuệ mạch máu, 13,64% nhóm có suy giảm thần kinh nhận thức nhẹ. Tuy nhiên sự khác biệt này không có ý nghĩa thống kê.
Điều này có hai ý nghĩa: Thứ 1 những tổn thương mạch máu ở bệnh nhân đái tháo đường thường song hành với nhau gồm cả vi mạch và mạch máu lớn, do đó những tổn thương vi mạch máu đại diện là nhồi máu não lỗ khuyết đã xuất hiện 52% (26/50) trong nhóm nghiên cứu. Tổn thương này xuất hiện tăng dần theo mức độ rối loạn thần kinh nhận thức. Thứ 2 bên cạnh tổn thương mạch máu, những rối loạn chuyển hóa đường do sản phẩm đường hóa bậc cao, tiến trình viêm hệ thống, chết tế bào theo chương trình đã tổn thương cấu trúc của não, sự thay đổi trong cấu trúc rõ ràng nhất là thay đổi thể tích đồi thị giảm dần với mức độ suy giảm thần kinh nhận thức và tăng dần thể tích não thất bên do thoái hóa và tổn thương các cống dẫn dịch não thất cũng như do nhiều nguy cơ có liên quan đến sự lắng đọng các mảng bám amyloid- β và sự hình thành các protein tau làm tổn thương không phục hồi các sợi dẫn truyền thần kinh cũng như tế bào thần kinh. Hệ quả là tình trạng thoái hóa chất trắng và quá trình teo não hình thành, là tiền đề cho sự xuất hiện sa sút trí tuệ của Alzheimer [7].
Nghiên cứu CASCADE cho thấy nguy cơ tăng tiến trình sa sút trí tuệ Alzheimer lên 4 lần hơn ở đối tượng đái tháo đường so với nhóm chứng [8]
Nghiên cứu của Val harten và cộng sự (2013) ghi nhận những tổn thương mạch máu và cấu trúc của não liên quan rất nhiều đến hoạt động viêm hệ thống, tăng đường máu và các sản phẩm đường hóa bậc cao, quá trình phosphoryl hóa, glycat hóa hay song hành với các tiến trình ngộ độc mỡ và đường. Trong dòng thác bệnh lý này, các quá trình hình thành các phức hợp protein tau à amyloid- β và cuối cùng là quá trình chết tế bào theo chương trình đã ảnh hưởng trực tiếp đến sự mât dần chức năng của não [11]
4. KẾT LUẬN
Qua nghiên cứu trên chúng tôi có một số kết luận như sau:
- Tuổi và thời gian mắc bệnh đái tháo đường có liên quan mật thiết với mức độ suy giảm nhận thức ( p< 0,01) qua đánh giá hai thang điểm MMSE và MoCa
- Nồng độ đường máu ( AUC ROC 73,8, điểm cắt 6,15, p< 0,05)), cholesterol máu ( AUC ROC 76,6, điểm cắt 4,95, p < 0,05)) , LDL.c (AUC ROC 67,3, điểm cắt 2,6, p > 0,05) và triglyceride ( AUC ROC 76,3; điểm cắt 1,21; p < 0,05) có tương quan với với mức độ suy giảm thần kinh nhận thức theo thang điểm MoCa.
- Thang điểm MoCa có giá trị hơn về độ nhạy và độ đặc hiệu khi đánh giá nhận thức ở bệnh nhân đái tháo đường (AUC ROC của MoCa 98%, Se=89%, Sp=99% CI ( 0,95-1) và AUC ROC của MMSE 88% Se=82%, Sp=88% CI (0,78-0,92), Kappa=2, p<0,001).
- Các dạng tổn thương não thường gặp trên MRI sọ não ở bệnh nhân đái tháo đường là giảm thể tích đồi thì, tăng thể tích não thất bên, nhồi máu não lỗ khuyết và bệnh não chất trắng+ teo não.
- Thể tích vùng đồi thị và hồi hải mã đã giảm rất nhiều có ý nghĩa thống kê (2,86 ± 0,67 so với 2,12 ± 0,98; p <0,01 bởi MMSE và 2,78 ± 0,95 so với 1,91 ± 0,38; p< 0,001 bởi MoCa) ở đối tượng suy giảm thần kinh nhận thức qua hình ảnh học MRI.
- Phân tầng suy giảm thần kinh nhận thức theo DSM 5 với hình ảnh học MRI ghi nhận tình trạng giảm thể tích đồi thị nặng dần theo mức độ suy giảm nhận thức giữa các nhóm đối tượng bình thường, suy giảm nhận thức nhẹ và sa sút trí tuệ, cụ thể tương ứng với V đồi thị giữa các nhóm: 2,78 ± 0,95; 1,91 ± 0,38; 1,61 ± 0,38 ; p < 0,001.
- Sự thay đổi thể tích não thất bên cũng gia tăng tỷ lệ với mức độ nặng của suy giảm nhận thức từ bình thường đến suy giảm thần kinh nhận thức nhẹ đến sa sút trí tuệ: 2,78 ± 1,13; 2,89 ± 1,36; 3,66 ± 1,24 ( p< 0,001).
- Các tổn thương như nhồi máu não lỗ khuyết có mặt 100% các đối tượng có sa sút trí tuệ, 75% ở đối tượng sa sút trí tuệ mạch máu và 45,45 % ở nhóm đối tượng có suy giảm thần kinh nhận thức mức độ nhẹ (p< 0,01).
- 54% ( 27/50) đối tượng nghiên cứu có nhồi máu lỗ khuyết đơn ổ đến đa ổ, trong đó 61,91% bệnh nhân có biểu hiện suy giảm thần kinh nhận thức theo MoCa và 85,71% có suy giảm nhận thức theo MMSE.
- 100% tổn thương não chất trắng và tình trạng teo não xuất hiện ở bệnh nhân có sa sút trí tuệ và 31,22 % ở nhóm sa sút trí tuệ mạch máu, 13,64% nhóm có suy giảm thần kinh nhận thức nhẹ. Tuy nhiên sự khác biệt này không có ý nghĩa thống kê ( p> 0,05)
- Điều đáng ghi nhận là ngay tại thời điểm có biểu hiện suy giảm nhận thức nhẹ (NMD) thì không những thể tích não thất và thể tích đồi thị cũng đã thay đổi mà tổn thương não chất trắng cũng như teo não đều xuất hiện. Và sự thay đổi này có chiều hướng gia tăng theo mức độ nặng (gia tăng đường máu, mỡ máu, hạ đường máu nhiều lần) và thời gian mắc bệnh đái tháo đường.
TÀI LIỆU THAM KHẢO
- Abbatecola AM, PaolissoG, LamponiM, BandinelliS, Laure-taniF, LaunerL, FerrucciL (2004), Insulin resistance and executive dysfunction in older persons, JAm Geriatr Soc,52,pp.1713–1718.
- Adam Brickman, Jordan Muraskin, MollyE. Zimmerman (2009), Structural neuro imaging in Alzheimer’s disease: dowhite matter hyperintensities matter?, Clinica lresearch, vol36, pp.181-190.
- Murray, Roger T.Staff, SusanD. Shenkin (2005), Brain White Matter Hyperintensities: Relative Importance of Vascular Risk Factors in Nondemented Elderly People, Radiology, 237, pp.251-257.
- Denise Feil, Carolyn W.Zhu (2011), The relationship between cognitive impairment and diabetes self management in a population based community sample of older adults with Type 2 diabetes, The relationship between cognitive impairment and diabetes, JBehavMed,35,pp.190–199.
- Hoffman WH, ArtlettCM, ZhangW, KreipkeCW, Passmore GG, Rafols JA, Sima AAF (2008), Receptor for advanced glycation end products and neuronal deficitin the fatal brainedema of Brain Res 1238, pp.154–162.
- JeroendeBresser, Mali, AudreyM. Tienhuis, et al (2010), Progression of cerebralatrophy and whitematter hyperintensities in patients with type2 diabetes, Diabetes Care,33, pp.1309-1314.
- J., KappelleL.J.(2006), Diabeticencephalopathy: a cerebro vascular disorder? Journal Sanne Manschot, ISBN-10:90-393-4204-0,pp.1-149.
- PeilaR, RodriquezBL, LaunerLJ (2002), Type 2 diabetes, APOE gene and the risk for dementia and related pathologies: The Honolulu-Asia Aging Study, Diabetes, vol 51,tr.1256-1262.
- RyanCM, GeckleMO (2000), Circum scribed cognitive dysfunction in middle aged adults with type 2 diabetes, Diabetes Care, vol23, 1486–1493.
- RajashreeR, D. Kholkute and S.S.Goudar (2012), Effects of Duration of Diabetes on Cognitive Functions in Streptozotocin Induced Young Diabetic Rats, AJMS, vol3, pp.256-263.
- Sanne Manschot, Augustina M.A. Brands et al (2006), Brain Magnetic Resonance Imaging Correlates of Impaired Cognition in Patients With Type 2 Diabetes, Diabetes, vol55, pp.1106-1115.
- Sara Nunes, Edna Soares, Frederico Pereira, Flávio Reis (2012), The role of inflammation indiabetic cardiomyopathy, International Journal of Interferon, Cytokine and Mediator Research, vol4, 59–73.
- Sara Nunes, EdnaSoares, Frederico Pereira, FlávioReis (2012), Diabetic encephalopathy: the role of oxidative stress and inflammation in type 2 diabetes, International Journal of Interferon, Cytokine and Mediator Research, vol4, 75-85.
- VanHartenB, OostermanJ, MuslimovicD, vanLoonBJ, ScheltensP, WeinsteinHC (2007), Cognitive impairment of MRI correlates in the elderly patients with type 2 diabetes mellitus, Age Ageing, vol36, 164–170.
- Vijayakumar M., Sirisha G.B.N., Farzana Begam and Dhanaraju (2012), Mechanism Linking Cognitive Impairment and Diabetes mellitus, European Journal of Applied Sciences, vol4, pp.1-5.
- Reijmer, Esther vanden Bergetal (2010), Cognitive dysfunction in patients with type 2 diabetes, Diabetes Metabolism Research and Reviews, 26, pp.507-519.
- Reijmer, EsthervandenBerg et al (2010), Accelerated cognitive decline inpatients with type 2 diabetes: MRI correlates and risk factors, Diabetes Metabolism Research and Reviews, 27, pp.195-202.
- ZubinPunthakee, Sullivan, et al (2012), Poor Cognitive Function and Risk of Severe Hypoglycemia in type 2 diabetes, Diabetes Care, 35,pp.787-793.
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam



