MỐI LIÊN QUAN GIỮA BIẾN ĐỔI NỒNG ĐỘ HOMOCYSTEINE MÁU VỚI MỘT SỐ CHỈ SỐ Ở BỆNH NHÂN ĐÁI THÁO ĐƯỜNG TÝP 2
ThS. Phạm Toàn Trung*, PGS.TS. Hoàng Trung Vinh**
* Bệnh viện 175, ** Học viện Quân y
SUMMARY
The relationship between the alteration of homocysteine concentrations with some parameters of type 2 diabetes mellitus patients.
The alteration of homocysteine concentrations in type 2 diabetes mellitus was associated with some factors. The object of the study was to determine the relationship of the alteration of homocysteine concentrations with age, sex, body mass index (BMI), duration of diabetes mellitus, metformin therapy, blood glucose, HbA1c and blood pressure control, some cardiac risk factors such as hypertension, microalbuminuria, dyslipidemia, diabetic chronic renal failure. Results showed that: homocysteine concentrations were significantly higher in patients without blood pressure control, with hypertension, microalbuminuria (+), diabetic chronic renal failure than those with blood pressure control, without hypertension, microalbuminuria (+), diabetic chronic renal failure. Hyperhomocysteinemia was inversely associated with degree of diabetic chronic renal failure and 3,45; 4,14; 3,87 – fold increased in patients with hypertension, microalbuminuria (+), diabetic chronic renal failure respectively. Homocysteine concentrations were significantly associated with sex, reversely correlated with age, eGFR (estimated glomerular filtraton rate) and inversely correlated with serum urea,
creatinine, LDL-C.
Keywords: type 2 diabetes mellitus, vitamin B12, folate and homocysteine concentrations.
Chịu trách nhiệm chính: Phạm Toàn Trung
Ngày nhận bài: 12.11.2016
Ngày phản biện khoa học: 25.11.2016
Ngày duyệt bài: 1.12.2016
1. ĐẶT VẤN ĐỀ
Bệnh tim mạch và bệnh thận mạn giai đoạn cuối do ĐTĐ vẫn là những nguyên nhân gây tử vong chính, ngay cả ở những nước phát triển. Bên cạnh những yếu tố nguy cơ (YTNC) đã được xác định (THA, rối loạn lipid máu…), có thể có những yếu tố khác liên quan bệnh sinh biến chứng tim mạch ở người ĐTĐ, trong đó HCy cao làm gia tăng nguy cơ mắc bệnh tim mạch và tỉ lệ tử vong do mọi nguyên nhân nói chung và do bệnh tim mạch nói riêng. Ở bệnh nhân ĐTĐ týp 2, tăng HCy còn làm tăng nguy cơ xuất hiện MAU, bệnh thận mạn do ĐTĐ. Nhiều nghiên cứu trong nước và trên thế giới cho thấy tăng HCy ở BN ĐTĐ týp 2 liên quan suy giảm chức năng thận, kiểm soát đường máu và huyết áp kém, tình trạng kháng insulin, điều trị metformin. Mục tiêu nghiên cứu: Tìm hiểu mối liên quan giữa HCy với BMI, thời gian phát hiện bệnh, điều trị metformin, kiểm soát đường máu, HbA1c, huyết áp, rối loạn lipid máu, microalbumin niệu, bệnh thận mạn.
2. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng
61 BN ĐTĐ týp 2 điều trị tại khoa Khớp – Nội tiết Bệnh viện 103 thuộc nhóm nghiên cứu.
–Bệnh nhân: tuổi > 30, được chẩn đoán xác định ĐTĐ týp 2 (lần đầu hoặc đã điều trị, có hoặc không có các biến chứng mạn tính của ĐTĐ). Loại trừ bệnh nhân đang có biến chứng cấp tính như: hôn mê, nhiễm khuẩn cấp, đang điều trị bằng vitamin B6, B12, folate
2.2. Phương pháp nghiên cứu
* Thiết kế nghiên cứu: tiến cứu, cắt ngang, mô tả.
* Nội dung nghiên cứu:
Tiến hành định lượng nồng độ VitB12, folate và HCy máu trên máy AxSYM của hãng Abbott (Hoa Kỳ) tại khoa Hoá Sinh – Bệnh viện 103.
HCy được xác định dựa trên nguyên lý miễn dịch huỳnh quang đối lưu. Đơn vị: µmol/l.
+ Hỏi bệnh sử, các biện pháp điều trị, khám lâm sàng các cơ quan, chiều cao, cân nặng.
+ Xét nghiệm các chỉ số huyết học, sinh hóa máu sinh hóa nước tiểu (10 chỉ tiêu, MAU), XQ tim phổi, điên tâm đồ.
+ Xét nghiệm định lượng HCy: tiến hành định lượng nồng HCy máu trên máy AxSYM của hãng Abbott (Hoa Kỳ) tại khoa Hoá Sinh – Bệnh viện 103.
* Xử lý số liệu: bằng chương trình phần mềm Epi-Info 7.0, Microsoft Excel 2007.
2.3. Các tiêu chuẩn sử dụng trong nghiên cứu
* Chẩn đoán rối loạn lipid máu: Theo khuyến cáo Hội tim mạch Việt Nam (2008).
* Chẩn đoán THA: Theo tiêu chuẩn
JNC VII.
* Đánh giá mức kiểm soát glucose máu dựa vào HbA1c: Theo tiêu chuẩn của Hiệp hội Đái tháo đường châu Á – Thái Bình Dương (2002).
* Đánh giá chỉ số BMI: Theo tiêu chuẩn của WHO (2004) áp dụng cho người châu Á – Thái Bình Dương.
* Đánh giá kiểm soát HA ở BN ĐTĐ: Theo tiêu chuẩn của Hiệp hội Đái tháo đường Hoa Kỳ – ADA (2013): đạt mục tiêu khi HATT < 130mmHg và HATTr < 80mmHg.
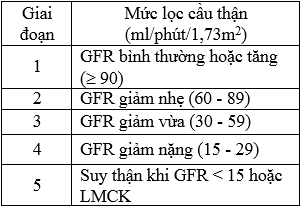
* Chẩn đoán bệnh thận mạn do ĐTĐ: Theo Hiệp hội Đái tháo đường Hoa Kỳ – ADA (2013) khi có MAU (+) hoặc ACR > 30 mg/g. Suy thận mạn khi mức lọc cầu thận < 60ml/phút/1,73m2
Bảng 2.1. Phân chia giai đoạn BTM dựa vào GFR theo KDOQI (2002)
3. KẾT QUẢ NGHIÊN CỨU
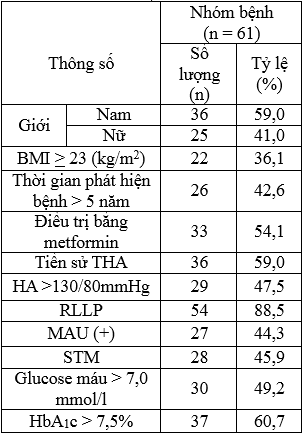
Bảng 3.1. Tỷ lệ bệnh nhân dựa vào một số đặc điểm
Bảng 3.2. Liên quan HCy với một số chỉ số ở nhóm bệnh (n = 61)
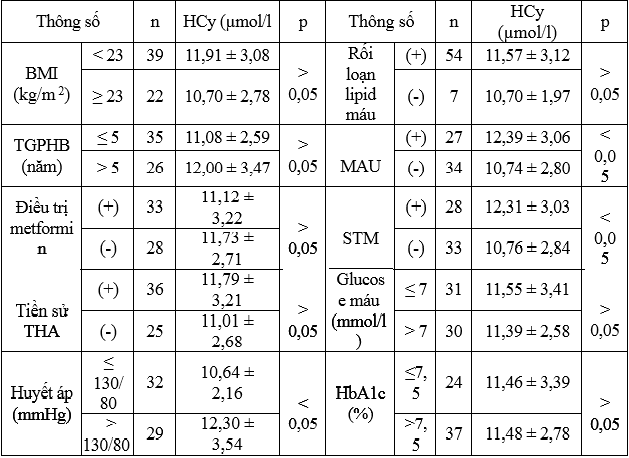
– HCy liên quan không có ý nghĩa thống kê với BMI, thời gian phát hiện bệnh, điều trị bằng metformin, THA, rối loạn lipid máu, kiểm soát glucose máu và HbA1c (p > 0,05).
– Nhóm bệnh kiểm soát HA > 130/80 mmHg, MAU (+), STM có HCy cao hơn có ý nghĩa nhóm bệnh kiểm soát HA ≤ 130/80 mmHg, MAU (-), không STM (p < 0,05).
Bảng 3.3. Liên quan HCy với giai đoạn STM ở nhóm bệnh (n = 28)
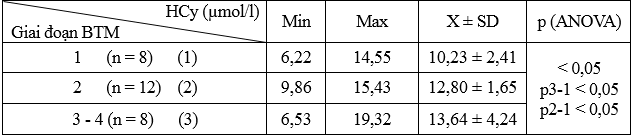
HCy tăng dần có ý nghĩa thống kê theo theo mức độ nặng của STM (p < 0,05).
Bảng 3.4. Liên quan tăng HCy với THA, mức KS huyết áp, MAU, STM ở bệnh nhân (n=61)
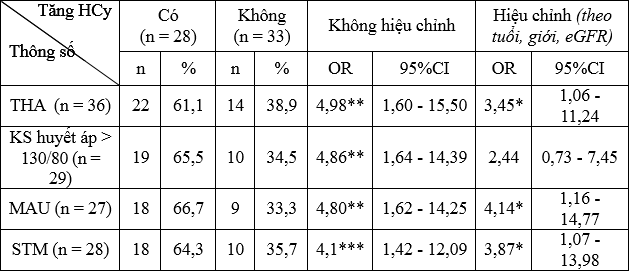
* p < 0,05; ** p < 0,005; *** p < 0,01
– Tỷ lệ tăng HCy ở nhóm BN có THA cao hơn so với nhóm BN không THA.
– Tỷ lệ tăng HCy ở nhóm BN KS huyết áp > 130/80 mmHg cao hơn so với nhóm KS huyết áp ≤ 130/80 mmHg.
– Tỷ lệ tăng HCy ở nhóm BN MAU (+) cao hơn so với nhóm BN MAU (-).
– Tỷ lệ tăng HCy ở nhóm BN có STM cao hơn so với nhóm BN không STM.
Bảng 3.5. Tương quan HCy với một số chỉ số ở bệnh nhân (n = 61)
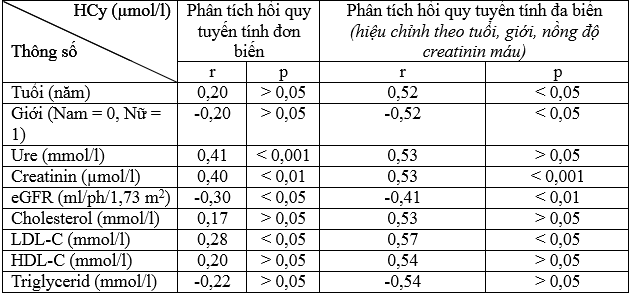
– Không có tương quan có ý nghĩa thống kê giữa HCy với tuổi, giới khi chưa hiệu chỉnh.
Sau hiệu chỉnh, HCy phụ thuộc vào giới (tăng hơn ở nam giới) với r = –0,52, p < 0,05; tương quan thuận mức độ chặt chẽ có ý nghĩa thống kê với tuổi r = 0,52, p < 0,05.
– HCy tương quan thuận mức độ vừa (r = 0,41, p < 0,001) với nồng độ ure máu, tương quan thuận mức độ vừa (r = –0,40, p < 0,01) với nồng độ creatinin máu, tương quan nghịch mức độ vừa (r = –0,30, p < 0,05) với eGFR khi chưa hiệu chỉnh.
Sau khi hiệu chỉnh, không có tương quan có ý nghĩa thống kê giữa HCy với nồng độ ure máu (p > 0,05).HCy tương quan thuận chặt chẽ với nồng độ creatinin máu (r = 0,53, p < 0,001), tương quan nghịch mức độ vừa với eGFR (r = –0,41, p < 0,01).
– HCy tương quan thuận mức độ ít (r = 0,28, p < 0,05) với nồng độ LDL–C máu khi chưa hiệu chỉnh. HCy tương quan thuận chặt chẽ với nồng độ LDL–C máu sau khi hiệu chỉnh (r = 0,57, p < 0,05).
4. BÀN LUẬN
* Liên quan của HCy với tuổi, giới: Kết quả nghiên cứu cho thấy HCy tương quan thuận chặt chẽ với tuổi có ý nghĩa thống kê, phụ thuộc vào giới (tăng hơn ở nam giới) sau khi hiệu chỉnh. Kết luận này tương tự nhận xét rút ra từ nghiên cứu của Looker HC (2003) [9], The NHANES 1999 – 2002 (2005) [6]. Điều này được giải thích do chức năng thận (phản ánh qua MLCT) là yếu tố quyết định quan trọng của HCy và chuyển hóa HCy trong cơ thể, mà chức năng thận , chuyển hóa HCy tại thận và ngoài thận suy giảm dần theo tuổi (ĐTĐ là một nguyên nhân thúc đẩy giảm nhanh MLCT) dẫn đến HCy tích lũy dần trong máu, [8]. Mặt khác nam giới thường có thói quen hút thuốc lá, lạm dụng rượu, café… hay gặp hơn nữ giới, đây là những yếu tố có thể gây tăng HCy do tác động gây mất cân bằng tình trạng vitamin B16, B12, folate (đóng vai trò đặc biệt quan trọng là coenzym và cofactor trong chuyển hóa HCy). Ngoài ra còn do ảnh hưởng của hormon ( androgen, testosteron gây tăng HCy, ngược lại estrogen làm giảm HCy), khối lượng cơ của cơ thể (nam giới thường có khối lượng cơ lớn hơn nữ giới) [8].
* Liên quan HCy với BMI: Qua kết quả HCy ở bệnh nhân có BMI > 23kg/m2 và BMI < 23 kg/m2, sự khác biệt không có ý nghĩa thống kê (p > 0,05). Phạm Quang Thanh (2008) khi so sánh HCy ở 11 BN ĐTĐ týp 2 có BMI > 23 và 45 BN ĐTĐ týp 2 có BMI < 23 cũng rút ra kết luận tương tự [1]. Một số tác giả nước ngoài cũng thấy không có tương quan ý nghĩa thống kê giữa HCy với BMI. [10]. Tuy vậy, một số nghiên cứu khác lại chỉ ra HCy tương quan nghịch có ý nghĩa thống kê với BMI ở BN ĐTĐ týp 2: The NHANES 1999 – 2002 (2005) với r = –0,19, p < 0,05 [6], Looker HC (2003) với r =
–0,23, p < 0,0001 [9]. Có lẽ BMI không phản ánh chính xác hoàn toàn khối lượng cơ của cơ thể mà khối lượng cơ lại tỷ lệ với nồng độ creatin/creatinin máu và do vậy cũng có tương quan nhất định với HCy khi giá trị BMI đủ lớn, trong khi BN ĐTĐ trong nghiên cứu của chúng tôi lại có BMI trung bình là chủ yếu.
* Liên quan HCy với thời gian phát hiện bệnh đái tháo đường: Thời gian mắc bệnh ĐTĐ có vai trò quan trọng thúc đẩy tiến triển biến chứng mạch máu ở BN ĐTĐ týp 2 trong đó có biến chứng tim mạch và tổn thương thận. Kết quả nghiên cứu của chúng tôi cho thấy có sự tăng HCy ở mốc thời điểm mắc bệnh > 5 năm so với < 5 năm nhưng không có ý nghĩa thống kê. Như vậy có sự tích lũy HCy máu theo thời gian bị bệnh trong nghiên cứu của chúng tôi tuy chưa thật rõ nét. Shargorodsky M (2009) nghiên cứu 85 BN ĐTĐ týp 2 cũng thấy HCy tương quan thuận không có ý nghĩa thống kê với thời gian mắc ĐTĐ [11]. Giải thích kết quả này, theo chúng tôi có thể do cỡ mẫu và thời gian mắc bệnh trong nghiên cứu chúng tôi thấp hơn khá nhiều so với những tác giả trên.
* Liên quan HCy với mức kiểm soát glucose máu: Kiểm soát tốt glucose máu và HbA1c giúp ngăn ngừa, làm chậm tiến triển các biến chứng và giảm tỷ lệ tử vong ở BN ĐTĐ. Kết quả nghiên cứucho thấy không có sự khác biệt có ý nghĩa thống kê của HCy giữa nhóm bệnh có glucose máu lúc đói ≤ 7 và > 7 mmol/l, kể cả ở nhóm bệnh kiểm soát đường HbA1c ≤ 7,5% và HbA1c > 7,5%.
Nghiên cứu của chúng tôi phù hợp với một số tác giả trong nước như Phạm Quang Thanh (2008) [1], Dương Thị Tuyết (2008) [2]. Theo chúng tôi, có thể do HCy và chỉ số HbA1c là hai yếu tố không ràng buộc hoàn toàn trong đánh giá tổn thương mạch máu ở BN ĐTĐ và các BN trong nghiên cứu đang được điều trị tích cực nhằm kiểm soát được mức đường máu trong khi HCy chưa được chú ý nhiều. Hơn nữa phương pháp nghiên cứu của chúng tôi và hai tác giả trên là nghiên cứu mô tả cắt ngang nên chưa thể đưa ra kết luận chính xác.
* Liên quan HCy với điều trị bằng metformin: Metformin là thuốc hạ đường máu ưu tiên hàng đầu điều trị ĐTĐ týp 2, cải thiện tiên lượng bệnh do tác dụng tăng nhạy cảm insulin ở tổ chức ngoại vi, cải thiện các chỉ số lipid máu, ngăn ngừa biến chứng mạch máu. Nghiên cứu UKPDS 34 cho thấy điều trị dài hạn metformin giúp giảm cân và giảm nguy cơ hạ đường máu, nhồi máu cơ tim, đột quỵ, giảm tử vong liên quan ĐTĐ và tử vong do mọi nguyên nhân ở BN ĐTĐ thừa cân. Tuy nhiên, nhiều nghiên cứu trên thế giới cũng chỉ ra điều trị ngắn hạn hoặc dài hạn metformin ở BN ĐTĐ týp 2 gây giảm khoảng 10 – 30% nồng độ VitB12 máu, góp phần làm 13 – 52% BN có biểu hiện giảm VitB12 máu [5], có thể dẫn đến tăng HCy. Cơ chế chưa hoàn toàn rõ, có thể metformin gây giảm hấp thu vitamin B12 qua ống tiêu hóa [5].
* Liên quan HCy với rối loạn lipid máu: Bệnh nhân ĐTĐ có tỷ lệ vữa xơ động mạch gấp 2 – 6 lần so với người không ĐTĐ. Rối loạn lipid máu rất phổ biến ở BN ĐTĐ týp 2, cùng với stress oxy hóa, bất thường chức năng tiểu cầu và rối loạn đông máu (tăng thrombin, yếu tố VII, yếu tố tổ chức, PAI–1, giảm thrombomodulin, protein C..) là các YTNC góp phần gia tăng vữa xơ động mạch, dẫn đến biến chứng mạch máu lớn ở người ĐTĐ (bệnh ĐMV, bệnh mạch máu não, bệnh động mạch ngoại vi). Tăng HCy vừa là nguyên nhân, vừa làm tăng tiến triển vữa xơ động mạch thông qua nhiều cơ chế gồm rối loạn chức năng nội mạc, cảm ứng stress oxy hóa, thúc đẩy viêm mạch và huyết khối.
Kết quả nghiên cứu cho thấy nhóm bệnh có rối loạn lipid máu có HCy cao hơn nhóm không rối loạn lipid máu nhưng chưa có ý nghĩa thống kê (p > 0,05). Sau hiệu chỉnh, chúng tôi thấy có mối tương quan thuận chặt chẽ giữa HCy với LDL-C máu.
Phạm Quang Thanh (2008) cũng thấy chỉ số HCy không khác biệt có ý nghĩa ở 33 BN ĐTĐ týp 2 có rối loạn lipid máu và 23 BN ĐTĐ týp 2 không rối loạn lipid máu [1]. Chico A (1998) nghiên cứu 90 BN ĐTĐ týp 2 nhận thấy tương quan thuận yếu có ý nghĩa giữa HCy với nồng độ LDL–C máu (r = 0,26, p < 0,05), triglyceride máu (r = 0,22, p < 0,05) [3]. Emoto M (2001) khảo sát 75 BN ĐTĐ týp 2 thấy có tương quan nghịch yếu có ý nghĩa của HCy với nồng độ HDL–C máu (r = –0,294, p = 0,01) [7]. Davies L (2001) nghiên cứu 260 BN ĐTĐ týp 2 thấy có tương quan nghịch chặt chẽ giữa HCy với nồng độ cholesterol máu (r = –0,656, p = 0,02) [4].
* Liên quan HCy với THA: Kết quả cho thấy nhóm bệnh có THA có HCy cao hơn nhưng chưa có ý nghĩa thống kê so với nhóm bệnh không TH. Khi phân nhóm bệnh theo mục tiêu kiểm soát HA, nhóm bệnh kiểm soát HA không đạt mục tiêu có nồng độ HCy cao hơn có ý nghĩa thống kê so với nhóm bệnh kiểm soát HA đạt mục tiêu. Lý giải kết quả này, chúng tôi cho rằng cả nhóm bệnh THA và kiểm soát HA không đạt mục tiêu đều có chức năng thận phản ánh qua các chỉ số eGFR, nồng độ creatinin máu kém hơn so với nhóm bệnh không THA và kiểm soát HA đạt mục tiêu. THA là bệnh thường gặp đi kèm với ĐTĐ týp 2.
* Liên quan HCy với MAU và BTM: Thận đóng vai trò chính trong chuyển hóa HCy, cùng với gan là hai cơ quan có đầy đủ các enzym xúc tác cho chu trình sulfur (chuyển nhóm sulfur) và con đường tái methyl hóa thứ yếu. Con đường chuyển methyl hóa cung cấp nhóm methyl để tổng hợp tiền chất của creatinin là creatin. Chỉ HCy tự do mới qua được cầu thận, 99% được tái hấp thu, phần lớn chuyển hóa ngay tại thận và khoảng 1% bài tiết qua nước tiểu [12]. Các nghiên cứu lớn trên thế giới chỉ tương quan nghịch mức độ mạnh giữa HCy với GFR hoặc eGFR, độ thanh thải creatinin; tương quan thuận với nồng độ creatinin máu như trong dữ liệu nghiên cứu đoàn hệ Framingham Offspring [8], nghiên cứu NHANES [6].Ở BN ĐTĐ, MAU được coi là dấu ấn chỉ điểm cho sự xuất hiện biến chứng mạch máu nói chung và mạch máu nhỏ nói riêng, đặc biệt là bệnh thận ĐTĐ khi MAU vừa là chỉ dấu sớm tổn thương thận, vừa phản ánh tiến triển suy giảm chức năng thận. Khi chức năng thận kém dần theo các giai đoạn MAU (–) đến MAU (+), protein niệu sẽ làm HCy tăng dần [7].
Qua kết quả, chúng tôi thấy nhóm bệnh MAU (+) có HCy cao hơn nhóm ĐTĐ MAU (–) có ý nghĩa thống kê (p < 0,05). Kết quả tương tự được ghi nhận khi so sánh nhóm bệnh có suy thận và không suy thận. HCy tăng dần có ý nghĩa theo giai đoạn suy thận. Có mối tương quan thuận mức độ vừa giữa HCy với nồng độ ure, creatinin máu, tương quan nghịch mức độ ít giữa HCy với eGFR. Mức tương quan càng mạnh hơn giữa HCy với nồng độ creatinin máu, eGFR sau hiệu chỉnh, không còn tương quan giữa nồng độ ure máu với nồng độ HCy sau hiệu chỉnh. Ở BN ĐTĐ có MAU (+) hoặc BTM đã làm gia tăng tỷ lệ tăng HCy tương ứng lên 4,80 và 4,14 lần khi chưa hiệu chỉnh; 4,14 và 3,87 lần sau khi hiệu chỉnh.
Shargorodsky M (2009) nghiên cứu 86 BN ĐTĐ týp 2 thấy có tương quan nghịch mức độ vừa giữa HCy với nồng độ creatinin máu (r = –0,344, p < 0,001), không có tương quan giữa HCy và nồng độ ure máu (r = 0,205, p = 0,117) [11]. Duncan GE (2005) phân tích 133 BN ĐTĐ týp 2 từ dữ liệu The NHANES 1999 – 2002 nhận thấy HCy tương quan thuận chặt chẽ với nồng độ creatinin máu (r = 0,55, p < 0,0001) và tương quan nghịch mức độ vừa với eGFR (r = –0,46, p < 0,0001) [6].Chico A (1998) cho rằng có mối liên quan giữa tăng HCy với tăng AER ở BN ĐTĐ, đặc biệt người ĐTĐ týp 2 và đề ra giả thiết liên kết giữa tăng HCy và sự xuất hiện MAU, bệnh thận ĐTĐ [3].
5. KẾT LUẬN:
Qua nghiên cứu biến đổi HCy ở 61 BN ĐTĐ týp 2, chúng tôi nhận thấy:
– HCy liên quan không có ý nghĩa thống kê với BMI, thời gian phát hiện bệnh, điều trị bằng metformin, THA, rối loạn lipid máu, kiểm soát glucose máu và HbA1c.
– Bệnh nhân kiểm soát HA > 130/80 mmHg, MAU (+), STM có HCy cao hơn có ý nghĩa so với nhóm bệnh kiểm soát HA ≤ 130/80 mmHg, MAU (-), không STM.
– HCy tăng dần có ý nghĩa thống kê theo theo mức độ nặng của giai đoạn BTM.
– Tỷ lệ tăng homocysteine máu gia tăng 3,45 lần khi kèm theo THA. Sự xuất hiện của MAU (+), STM làm gia tăng nguy cơ tăng homocysteine máu lên 4,14 lần và 3,87 lần.
– HCy tương quan nghịch chặt chẽ có ý nghĩa thống kê với tuổi, phụ thuộc vào giới (tăng hơn ở nam giới); tương quan thuận mức độ vừa có ý nghĩa thống kê với nồng độ ure máu; tương quan thuận chặt chẽ có ý nghĩa thống kê với nồng độ creatinin máu; tương quan nghịch mức độ vừa có ý nghĩa thống kê với mức lọc cầu thận ước tính, tương quan thuận chặt chẽ với nồng độ LDL–C máu.
TÓM TẮT
Biến đổi nồng độ homocysteine máu (HCy – total plasma homocysteine concentration) ở BN ĐTĐ týp 2 liên quan đến một số yếu tố. Mục tiêu: tìm hiểu mối liên quan giữa HCy với tuổi, giới, chỉ số khối cơ thể (BMI), thời gian phát hiện bệnh, điều trị metformin, kiểm soát đường máu, HbA1c, huyết áp, một số yếu tố nguy cơ tim mạch như tăng huyết áp (THA), rối loạn lipid máu, microabumin niệu (MAU), suy thận mạn (STM). Kết quả cho thấy: HCy tăng cao có ý nghĩa thống kê ở BN kiểm soát huyết áp kém, có THA, MAU (+), STM do ĐTĐ. Khi mức độ STM nặng dần thì HCy tăng dần. THA, MAU (+), STM do ĐTĐ sẽ làm gia tăng nguy cơ tăng HCy lên 3,45, 4,14 và 3,87 lần. HCy phụ thuộc giới (tăng hơn ở nam giới), tương quan nghịch với tuổi, mức lọc cầu thận (MLCT) ước tính; tương quan thuận với nồng độ ure, creatinin, LDL–C máu có ý nghĩa thống kê.
Từ khóa: ĐTĐ typ 2, nồng độ vitamin B12, folate, homocysteine.
TÀI LIỆU THAM KHẢO
- Phạm Quang Thanh (2008), “Đánh giá mối liên quan giữa nồng độ homocysteine máu với microalbumin niệu và độ dày lớp trung mạc động mạch cảnh ở bệnh nhân đái tháo đường týp 2”, Luận văn tốt nghiệp Bác sỹ chuyên khoa II, Trường Đại học y Hà Nội, 75 trang.
- Dương Thị Tuyết, Nguyễn Thị Hương, Phạm Thiện Ngọc (2008), “Nồng độ homocystein máu ở bệnh nhân đái tháo đường týp 2”, Tạp chí Nghiên cứu Y học, Tập 53, Số 1 2008, trang 71-76.
- Chico A., Pørez A., Córdoba A. et al (1998), “Plasma homocysteine is related to albumin excretion rate in patients with diabetes mellitus: a new link between diabetic nephropathy and cardiovascular disease?”, 1998 Jun; 41(6): pp.684–93.
- Davies L., Wilmshurst E.G., Mcelduff A. et al (2001), “The Relationship Among Homocysteine, Creatinine Clearance, and Albuminuria in Patients With Type 2 Diabetes”, Diabetes Care.2001 Oct; 24(10): pp.1805-9.
- De Jager J, Kooy A., Lehert P.et al (2010), “Long term treatment with metformin in patiens with type 2 diabetes and risk of vitamin B 12 deficiency: randomised placebo controlled trial”, BMJ 2010; 340: c2181 doi: 10.1136/bmj.c2181.
- Duncan G.E., Li S.M. and Zhou X.H. (2005), “Age and kidney function are the primary correlates of fasting plasma total homocysteine levels in non-diabetic and diabetic adults. Results from the 1999–2002 National Health and Nutrition Examination Survey”,Nutr Metab (Lond). 2005 May 26; 2:13.
- Emoto M., Kanda H., Shuji T. et al (2001), “Impact of Insulin Resistance and Nephropathy on Homocysteine in Type 2 Diabetes”, Diabetes Care.2001 Mar; 24(3): pp.533–8
- Jacques P.F., Bostom A.G., Wilson P.W.F. et al (2001), “Determinants of plasma total homocysteine concentration in the Framingham Offspring cohort1–4”, Am J Clin Nutr.2001 Mar; 73(3): pp.613–
- Looker H.C., Fagot-Campagna A., GunterW. et al (2003), “Homocysteine as a risk factor for nephropathy and retinopathyin Type 2 diabetes”, Diabetologia.2003 Jun; 46(6): pp.766–72.
- Russo G.T., Di Benedetto A., Giorda C. et al (2004), “Correlates of total homocysteine plasma concentration in type 2 diabetes”, Eur J Clin Invest.2004 Mar; 34(3): pp.197-204
- Shargorodsky M., Boaz M., Pasternak S. et al (2009), “Serum homocysteine, folate, vitamin B12 levels and arterial stiffness in diabetic patients: which of them is really important in atherogenesis?”, Diabetes Metab Res Rev.2009 Jan; 25(1): pp.70-5.
- Wijekoon E.P., Brosnan M.E. and Brosnan J.T. (2007), “Homocysteine metabolism in diabetes”, Biochem Soc Trans.2007 Nov; 35(Pt 5): pp.1175-9
Malek-Khosravi S, Kaboudi M, Kaboudi B, Atefi G: Plasma homocysteine
concentrations and insulin resistance in preeclampsia. Hypertens
Pregnancy 2009, 28:13–22.
- Patterson S, Flatt PR, Brennan L, Newsholme P, McClenaghan NH:
Detrimental actions of metabolic syndrome risk factor, homocysteine,
on pancreatic beta-cell glucose metabolism and insulin secretion.
J Endocrinol 2006, 189:301–310.
- Patterson S, Flatt PR, McClenaghan NH: Homocysteine-induced
impairment of insulin secretion from clonal pancreatic BRIN-BD11
beta-cells is not prevented by catalase. Pancreas 2007, 34:144–151.
- Scullion SMJ, Gurgul-Convey E, Elsner M, Lenzen S, Flatt PR, et al: Enhancement
of homocysteine toxicity to insulin-secreting BRIN-BD11 cells in
combination with alloxan. J Endocrinol 2012, 214:233–238.
- Russo GT, Di Benedetto A, Magazzù D, Giandalia A, Giorda CB, et al: Mild
hyperhomocysteinemia, C677T polymorphism on methylenetetrahydrofolate
reductasegene and the risk of macroangiopathy in type 2 diabetes:
a prospective study. Acta Diabetol 2011, 48:95–101.
- Kelly PJ, Rosand J, Kistler JP, Shih VE, Silveira S, et al: Homocysteine, MTHFR
677CT polymorphism, and risk of ischemic stroke: results of a meta-analysis.
Neurology 2002, 59:529–536.
- Ndrepepa G, Kastrati A, Braun S, Koch W, Kolling K, et al: Circulating
homocysteine levels in patients with type 2 diabetes mellitus. Nutr
Metab Cardiovasc Dis 2008, 18:66–73.
- Bluthner M, Bruntgens A, Schmidt S, Strojek K, Grzeszczak W, et al:
Association of methylenetetrahydrofolate reductase gene polymorphism
and diabetic nephropathy in type 2 diabetes? Nephrol Dial Transplant
1999, 14:56–57.
- Benes P, Kankova K, Muzik J, Groch L, Benedik J, et al:
Methylenetetrahydrofolate reductase polymorphism, type II diabetes
mellitus, coronary artery disease, and essential hypertension in the
Czech population. Mol Genet Metab 2001, 73:188–195.
- Yilmaz H, Agachan B, Ergen A, Karaalib ZE, Isbir T: Methylene
tetrahydrofolate reductase C677T mutation and left ventricular
hypertrophy in Turkish patients with type II diabetes mellitus. J Biochem
Mol Biol 2004, 37:234–238.
- Erdogan M, Karadeniz M, Eroglu Z, Tezcanli B, Selvi N, et al: The relationship
of the peroxisome proliferator-activated receptor-gamma 2 exon 2 and
exon 6 gene polymorphism in Turkish type 2 diabetic patients with and
without nephropathy. Diabetes Res Clin Pract 2007, 78:355–359.
- Tutuncu NB, Erbas T, Alikasifoglu M, Tuncbilek E: Thermolabile
methylenetetrahydrofolate reductase enzyme genotype is frequent in
type 2 diabetic patients with normal fasting homocysteine levels. J Intern
Med 2005, 257:446–453.
- Soares AL, Fernandes AP, Cardoso JE, Sousa MO, Lasmar
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam




