VAI TRÒ CỦA VITAMIN D ĐỐI VỚI MÔ MỠ
Nguyễn Trọng Nghĩa
Khoa Nội Nội tiết-ĐTĐ-TK-Hô hấp BV TW Huế
ABSTRACT
Adipose tissue has long been identified as the major site of vitamin D storage. Recent studies have demonstrated that VDR and vitamin D metabolizing enzymes are expressed in adipocytes. Furthermore, it has been shown that vitamin D regulates adipogenic gene expression as well as adipocyte apoptosis. Vitamin D is active in adipocytes at all levels. It interacts with membrane receptors, adaptor molecules, and nuclear coregulator proteins. Several functions of unliganded nVDR were discovered by studying human samples from patients having hereditary vitamin D resistant rickets, transgenic mice overexpressing the VDR and VDR knockout mice. Through its genomic action, vitamin D participates in the regulation of energy metabolism by controlling the expression of uncoupling proteins. In vitro, vitamin D stimulates lipogenesis and inhibits lipolysis by interacting with mVDR. mVDR is present in caveolae of the plasma membrane and is the same as the classic nVDR. In addition, vitamin D affects directly the expression of the appetite regulating hormone, leptin. Some researchers reported also that vitamin D regulates the expression of the insulin sensitizing hormone, adiponectin. Vitamin D reduced cytokine release and adipose tissue inflammation through the inhibition of NF-kB signaling. Scientific research investigating the role of adipose tissue resident immune cells in the pathogenesis of obesity-associated inflammation is scarce. Obesity is associated with vitamin D deficiency. However there is no scientific evidence to prove that vitamin D deficiency predispose to obesity. Vitamin D supplementation may prevent obesity but it does not lead to weight loss in obese subjects.
TÓM TẮT
Mô mỡ đã được xác định từ lâu là nơi lưu trữ chính củavitamin D. Các nghiên cứu gần đây có đã chứng minh rằng thụ thể vitamin D và các enzyme chuyển hóa vitamin D được biểu hiện trong các tế bào mỡ. Hơn nữa, người ta đã chứng minh rằng vitamin D điều hòa biểu hiện gen hình thành mô mỡ cũng như quá trình chết tế bào mỡ được lập trình. Vitamin D hoạt động trong các tế bào mỡ ở mọi cấp độ. Nó tương tác với các thụ thể màng, phân tử bộ chuyển đổi, và các protein điều hòa nhân tế bào (coregulator). Một số chức năng của nVDR không có ligand đã được phát hiện bởi các nghiên cứu từ ngườimắc bệnh còi xương kháng vitamin D di truyền, chuột biến đổi gen biểu hiện quá mức VDR và chuột bị loại bỏ VDR. Thông qua hoạt động di truyền, vitamin D tham gia trong việc điều hòa chuyển hóa năng lượng bằng cách kiểm soát sự biểu hiện của protein tách cặp. Trong ống nghiệm (in vitro), vitamin D kích thích quá trình tạo lipid và ức chế quá phân giải lipid bằng cách tương tác với mVDR. mVDR hiện diện ở bè lipid của màng sinh chất và giống như nVDR cổ điển. Ngoài ra, vitamin D trực tiếp ảnh hưởng đến biểu hiện của hormone điều hòa sự thèm ăn, leptin. Một số nhà nghiên cứu cũng đã báo cáo rằng vitamin D điều hòa sự biểu hiện của hormone nhạy cảm với insulin, adiponectin. Vitamin D làm giảm giải phóng cytokine và viêm mô mỡ thông qua sự ức chế tín hiệu NF-kB. Nghiên cứu khoa họckhám phá vai trò của các tế bào miễn dịch cư trú mô mỡ trong cơ chế bệnh sinh của viêm liên quan đến béo phì là khan hiếm. Béo phì có liên quan đến thiếu hụt vitamin D. Tuy nhiên, không có bằng chứng khoa học để chứng minh rằng thiếu hụt vitamin D có thể dẫn đến béo phì. Bổ sung vitamin D có thể ngăn ngừa béo phì nhưng nó không dẫn đến giảm cân ở những người béo phì.
Chịu trách nhiệm chính: Nguyễn Trọng Nghĩa
Ngày nhận bài:
Ngày phản biện khoa học:
Ngày duyệt bài:
1. Giới thiệu
Vitamin D3 được tổng hợp từ 7-dehydrocholesterol ởda khi chiếu tia cực tím. Để được hoạt động, vitamin D3 trải qua 2 lần hydroxyl hóa. Đầu tiên, nó được chuyển đổi thành 25-hydroxyvitamin D3 (25-OH-D) ở gan. Sau đó, thành1,25-dihydroxyvitamin D3 (1,25-(OH)2-D hay calcitriol) ở thận. Chức năng cổ điểncủa 1,25-(OH)2-D là điều hòa cân bằng nội môi calci. Tuy nhiên, VDR còn được biểu hiện trong các mô không tham gia vào quá trình chuyển hóa calci. Điều này cho thấy 1,25-(OH)2-D có liên quan trong điều hòa của nhiều chức năng không calci. Mô mỡ là một cơ quan chuyển hóa quan trọng và có một vai trò thiết yếu trong cân bằng năng lượng và nội môi glucose. Mô mỡ là nơi lưu trữ chính cho vitamin D và cũng biểu hiện VDR vàcác enzyme liên quan đến chuyển hóa vitamin D [5]. Nghiên cứu gần đây đã chứng minh rằng vitamin D3 hoạt động trong các tế bào mỡ và tương tác với các thụ thể màng, phân tử bộ chuyển đổi, phosphatases và các protein thụ thể hạt nhân. Do đó, nó tham gia vàosự kiểm soát biểu hiện gen cũng như tín hiệu tế bào [25].
1.1. Mô mỡ là nơi lưu trữ chính và các chất chuyển hóa của vitamin D3
Vitamin D là một secosteroid tan trong chất béo. Sử dụng nhãn phóng xạ vitamin D3 dùng đường uống cho chuột cai sữa thiếu vitamin D, đã được chứng minh rằng một lượng phân rã phóng xạ đáng kể xuất hiện trong mô mỡ trong vòng 24 giờ sau khi dùng. Việcgiảm phân rã phóng xạ mô mỡ sau đó rất chậm. Sau 6 tuần dùng vitamin D3, 80% tổng lượng phóng xạ đã có mặt trong mô mỡ. Năm mươi phần trăm của tổng số phóng xạ trong mô mỡ là do sự hiện diện của vitamin D3 không được chuyển hóa và nửa còn lại thành dạng chuyển hóa phân cực và este của vitamin D. Khi chuột điều trị vitamin D ngừng lại, mô mỡ giải phóng vitamin D rất chậm. Lượng vitamin D được giải phóng tương ứng với nồng độ vitamin D hiện diện trong mô mỡ. Điều này cho thấymô mỡ có đặc điểm là một kho để lưu trữ và giải phóng vitamin D. Kho này tích lũy vitamin D tương ứng với nồng độ của nó trong huyết tương và giải phóng nó ở một tốc độ chậm hơn nhiều tương ứng với nồng độ của nó trong chất béo [1].
Ở người, khoảng 17% liều vitamin D dùng đường uống được lưu trữ trong mô mỡ và phần còn lại được tiêu thụ hoặc chuyển hóa. Sự phân phối vitamin D và các chất chuyển hóa của nó trong các mô của người được nghiên cứu sử dụng cholecalciferol phóng xạ. Mô mỡ và cơ vân là các nơi chính để lưu trữ vitamin D. Người ta cho rằng mô mỡ có chức năng như một hệ thống đệm vitamin D giúp ngăn chặn sự tổng hợp không kiểm soát của 25-OH-D3 ở gan. Việc giải phóng chậm vitamin D từ mô mỡ trong điều kiện nhịn ăn có thể hạn chế độc tính tiềm tàng của lượng vitamin dư thừa [1].
Các phương pháp phân tích khác nhau đã được sử dụng để đo nồng độ vitamin D trong mô mỡ. Sắc ký chất lỏng hiệu năng cao (HPLC) được sử dụng với độ nhạy dưới 1 ng/g của mô để đo vitamin D trong trong mỡ người được khám nghiệm tử thi sau khi chết đột ngột. Nồng độ vitamin D trong các mẫu của mô mỡ quanh thận người là 45,3 ng/g ± 22,2 và trong các mẫu của mô náchlà 115,6 ng/g ± 52,4. Phương pháp quang phổ học khối sắc ký lỏng (LC/MS) được sử dụng để đo vitamin D trong mỡ bụng dưới da ở người trưởng thành béo phì. Nồng độ vitamin D ở mô mỡ dưới da (SAT) trung bình thu được bởi cách giá trị tham khảo bằng phương pháp này gần như tương tự với kết quả trong các mẫu mô chất béo quanh màng ngoài tim và thận nhưng thấp hơn trong mô mỡ nách [1].
Gần đây, một kỹ thuật mới gọi là quang phổ học khối ion thứ phát time-of-flight [TOF-SIMS] đã được sử dụng để đo vitamin D và chất chuyển hóa của nó trong mô mỡ. TOF-SIMS có lợi thế của việc sử dụng mảnh mô mỡ rất nhỏ nhưng nó cần chuẩn bị mẫu tinh vi. Nó không chỉ được sử dụng để đo vitamin D trong các khoang cơ thể khác nhau, nhưng nó cũng xác định nội địa hóa lớp dưới tế bào. Vitamin D chủ yếu gặp ở các giọt lipid trong tế bào mỡ [17].
1.2. Sản xuất hoạt chất 1,25-dihydroxyvitamin D3 bởi mô mỡ
Vitamin D3 là một tiền hormone được kích hoạt bởi các enzyme ở gan và thận. Hai nhóm hydroxyl được thêm vào để tạo thành hormone hoạt động 1,25-(OH)2-D3. Quá trình hydroxyl hóa đầu tiên xảy ra ở gan để tạo ra 25-OH-D3. Quá trình hydroxyl hóa thứ hai cần enzyme 1α-hydroxylase ở thận và chuyển đổi 25-OH-D3 thành 1,25-(OH)2-D3. Sự biểu hiện và hoạt động của 1α-hydroxylase thận (CYP27B1 ty thể) được điều hòa chặt chẽ bởi calci, phosphorus, calcitonin, hormone tuyến cận giáp và 1,25-(OH)2-D3 huyết thanh [5].
Ở người, bốn enzyme cytochrom P450 (CYP2R1, CYP3A4, CYP27A1 và CYP2J2) có hoạt tính 25-hydroxylase, với CYP2R1 là đặc hiệu nhất. Ba trong số các enzyme này là: CYP2R1, CYP2J2 và CYP27A1 đã được tìm thấy biểu hiện trong SAT và mô mỡ nội tạng (VAT). Enzyme thứ tư CYP3A4 đã được biểu hiện trong một số mô mỡ khác [30]
Biểu hiện của 25-vitamin-D-1α-hydroxylase ngoài thận (CYP27B1) đã được báo cáo trong một số mô bao gồm mô mỡ chuột và VAT người và SAT. Trong các tiền tế bào mỡ 3T3-L1 nuôi cấy, 1α-hydroxylase được biểu hiện và các tế bào có thể chuyển đổi 3H 25-OH-D3 sang 3H 1α,25-(OH)2-D3. 1α-hydroxylase mô mỡ không được điều hòa bởi calci và vitamin D trong chế độ ăn như 1α-hydroxylase ở thận. Điều hòa 1α-hydroxylase mô mỡ bởi phosphorus, hormone tuyến cận giáp, calcitonin, estradiol, các cytokine tiền viêm, phytoestrogen hoặc các yếu tố khác là một chủ đề thú vị cho nghiên cứu [1].
1.3. Sự thoái hóa của hoạt chất 1α,25-dihydroxyvitamin D3 bởi mô mỡ
Sự thiết lập 1,25-(OH)2-D3 (hay 1,25-(OH)2-D) tốt kích thích sự thoái hóa của chính nó bằng cách tạo ra 24-hydroxylase (CYP24A1). Enzyme này dị hóa 25-OH-D3 và 1,25-(OH)2-D thành acid calcitroic và các chất chuyển hóa không hoạt động khác. CYP24A1 dị hóa được biểu hiện ở cả SAT và VAT người. Sự biểu hiện quá mức của CYP24A1 mô mỡ trong các bệnh chuyển hóa và sự liên quan của nó với các cơ chế sinh lý bệnh của chúng cần được nghiên cứu thêm. Ngoài ra sự ức chế phiên mã gen của enzyme này bởi isoflavone trong chế độ ăn uống đại diện cho một lĩnh vực nghiên cứu mới [1].
1.4. Biểu hiện của VDR trong mô mỡ
Sự biểu hiện của gen VDR đã được báo cáo trong các tế bào mỡ 3T3-L1, các tiền tế bào mỡ người và các tế bào mỡ biệt hóa trong nuôi cấy. Ngoài ra, VDR được biểu hiện ở SAT và VAT người và các tế bào mỡ tuyến vú người [1].
1.5. Tác động bộ gen của 1,25-dihydroxyvitamin D3
VDR hạt nhân (nVDR) là thành viên của siêu họ thụ thể hạt nhân điều hòa biểu hiện gen. Chức năng thụ thể hạt nhân hoạt động như ligand cảm ứng các yếu tố phiên mã. Khoảng 3% các gen trong bộ gen người được điều hòa bởi 1,25-(OH)2-D [4]. Ligand VDR thu hút một trong các thụ thể X retinoid (RXR), thụ thể hạt nhân cho acid retinoic 9-cis, thành một heterodimer gọi là các yếu tố đáp ứng vitamin D (VDRE) trong vùng lân cận của gen mục tiêu. Sau khi hình thành một dimer đơn với RXR, các phức hợp điều chế được tuyển dụng. Tác động là cảm ứng hoặc ức chế gen mục tiêu [23].
Bảng 1. Một số gen được điều hòa bởi 1,25-(OH)2-D thông qua gắn với nVDR trong tế bào mỡ[1].
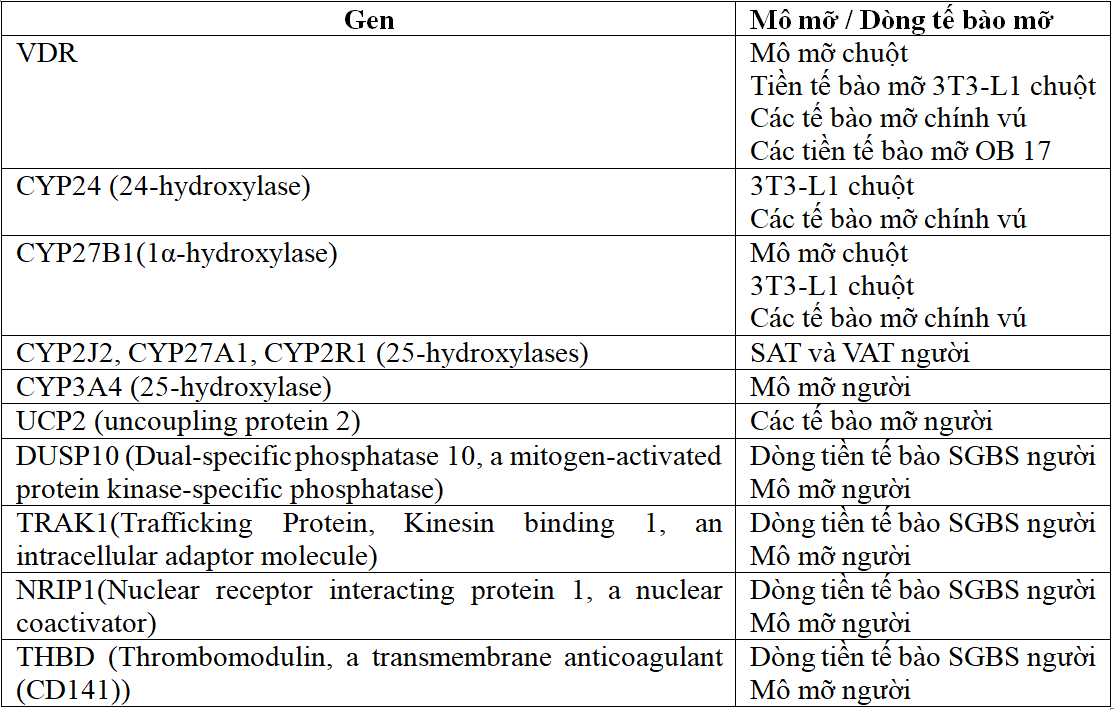
SGBS: Hội chứng Simpson–Golabii–Beymel
1.6. Các chức năng của VDR không có ligand
Thụ thể vitamin D chủ yếu ở tế bào chất khi không hiện diện 1,25-(OH)2-D. Tuy nhiên, một số nhà nghiên cứu đã chứng minh rằng VDR nằm trong các hạt nhân tế bào khi không có 1,25-(OH)2-D và được tích lũy trong các hạt nhân nhiều hơn khi ligand 1,25-(OH)2-D được thêm vào.
Các quan sát này trái ngược với các thụ thể hạt nhân khác như thụ thể glucocorticoid hoặc estrogen. Các thụ thể glucocorticoid ở tế bào chất và chuyển từ tế bào chất vào hạt nhân chỉ với sự hiện diện của ligand, trong khi các thụ thể estrogen nằm trong nhân bất kể ligand.
Có hai cơ chế khác nhau để vận chuyển VDR vào hạt nhân: con đường phụ thuộc và độc lập với ligand. Các vùng khác nhau của VDR được tham gia vào từng con đường. Trình tự địa phương hóa hạt nhân 4 có liên quan đến sự chuyển vị hạt nhân độc lập của VDR [1].
Khả năng sinh nhiệt của mô mỡ nâu (BAT) là do biểu hiện của UCP1. UCP1 là một protein xuyên màng có bên trong màng ty thể tạo ra rò rỉ proton. UCP1 tăng cường tiêu hao năng lượng bằng cách tách rời quá trình phosphoryl oxy hóa từ quá trình tổng hợp ATP tạo nhiệt [11].
Do đó, việc tăng biểu hiện của UCP1 trong BAT sẽ làm tăng tiêu hao năng lượng.
Trước đây, người ta cho rằng BAT chỉ có ở trẻ sơ sinh. Tuy nhiên, gần đây người ta đã chứng minh rằng BAT cũng có ở người trưởng thành đặc biệt ở vùng thượng đòn, thượng thận, cạnh cột sống (liên sườn) và vùng cổ.
Ở người, BAT giảm dần theo tuổi, ngoài ra, nữ giới có khối lượng BAT lớn hơn nam giới.
Một lĩnh vực nghiên cứu rất thú vị là phát hiện ra một loại tế bào mỡ riêng biệt gọi là tế bào mỡ màu be có khả năng áp dụng kiểu hình mỡ nâu.
Các tế bào này được cho là có nguồn gốc từ các tiền tế bào mỡ đa nhân nằm trong mô mỡ trắng (WAT) hoặc từ sự tái lập trình dòng của tế bào mỡ trắng thành tế bào mỡ màu be. Chúng có khả năng duy nhất để biểu hiện UCP1.
Do đó, chúng điều hòa tiêu hao năng lượng trong cơ thể người trưởng thành. Câu hỏi ở đây là liệu vitamin D có kiểm soát sự biểu hiện của UCP1 trong các tế bào này hay không và liệu nó có ảnh hưởng đến quá trình biệt hóa của các tiền tế bào mỡ hay tế bào mỡ trắng thành kiểu hình màu be [1].
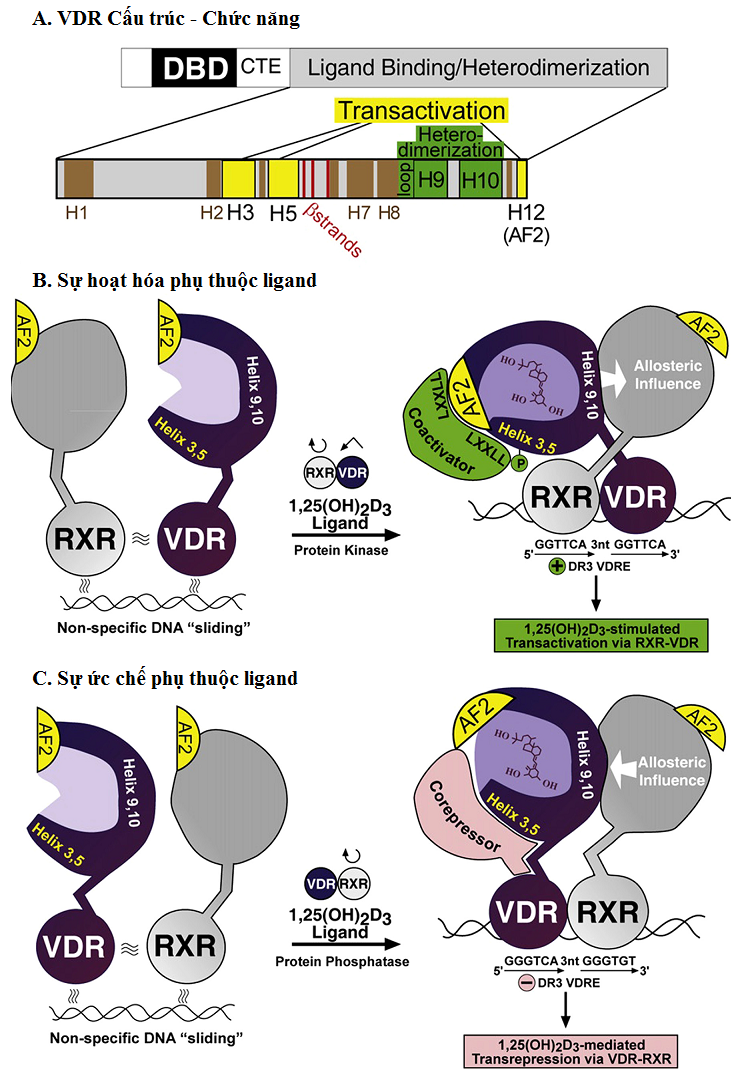
Hình 1.Mối liên quan cấu trúc-chức năng và các cơ chế của cảm ứng và ức chế gen bởi VDR[10].
1.7. Sự liên quan sinh lý của các đáp ứng màng tế bào nhanh (không qua bộ gen) của 1,25-(OH)2-D chưa được xác nhận trong mô mỡ
Trái ngược với các đáp ứng gen mất vài giờ đến vài ngày, các đáp ứng qua trung gian màng nhanh của 1,25-(OH)2-D là ngắn. Ví dụ, mất vài giây để mở kênh ion hoặc 10-60 phút để hoạt hóa phosphatidylinositol 3-kinase hoặc tổng hợp nitric oxide nội mô.
Cho đến nay, các phản ứng không gen qua trung gian VDR chỉ được nghiên cứu trong nuôi cấy tế bào. Người ta vẫn chưa biết liệu các hoạt động này có chức năng sinh lý hay không trong cơ thể sống. Một nghiên cứu duy nhất được thực hiện trong ống nghiệm đã chứng minh rằng các đáp ứng nhanh điều hòa tế bào mỡ tạo và phân giải mỡ. Trong nghiên cứu đó, 1,25-(OH)2-D làm tăng mức calci nội bào và theo sau hoạt động tổng hợp acid béo (FAS). Hiệu ứng này được bắt chước bởi các chất chủ vận mVDR và bị chặn bởi các chất đối kháng mVDR. Hơn nữa, 1,25-(OH)2-D có tác dụng ức chế quá trình phân giải mỡ cơ bản của tế bào mỡ trong nuôi cấy tế bào mỡ của người.
Người ta đã chứng minh rằng VDR màng (mVDR), nằm trong bè lipid ở màng sinh chất, giống như VDR cổ điển được tìm thấy trong nhân tế bào và chất lỏng nội bào. Sử dụng chuột loại bỏ VDR, người ta đã chứng minh rằng hoạt động nhanh chóng (không gen) của 1,25-(OH)2-D trên kênh ion nguyên bào xương đòi cần sự hiện diện của thụ thể vitamin D trên bè lipid nhân tế bào có chức năng. Việc gắn 1,25-(OH)2-D với VDR trên bè lipid dẫn đến việc hoạt hóa các hệ thống báo tin thứ hai kích hoạt các đáp ứng ngắn hạn. Thuộc tính steroid duy nhất của 1,25-(OH)2-D để gắn cả nVDR và mVDR là cấu trúc linh hoạt của nó. Trên thực tế, nó có thể tương tác với hai miền gắn ligand (một VDR-GP, bộ gen và VDR-AP, bộ gen thay thế) trên VDR cổ điển. Màng VDR (mVDR) gắn với các ligand có cấu trúc (6-s-cis) trong khi nVDR gắn với các ligand có cấu trúc (6-s-trans). Trong năm hệ thống không bao gồm mô mỡ, hormone tự nhiên 1α,25-(OH) 2-D3 (hay 1,25-(OH)2-D) là chất chủ vận đầy đủ cho mVDR trong khi 1β,25-(OH)2-D3 là chất đối vận. VDR màng được hoạt hóa bởi 1α,25-(OH)2-lumisterol3, hoạt động như một chất chủ vận đầy đủ cho cả nVDR và mVDR nhưng nó không bị ức chế bởi chất đối vận đáp ứng bộ gen (23S)-25-dehydro-1α–OH–D3-26,23-lactone [1].
Nghiên cứu trong tương lai có thể khám phá nhiều chức năng của vitamin D trong mô mỡ bằng cách (1) nghiên cứu sự tương tác giữa mVDR với các protein khác nằm trên bè lipid của tế bào mỡ như protein disulfide isomerase family A, member 3 (Pdia3). Sự tương tác giữa Pdia3 và mVDR đã được báo cáo là tồn tại trong dòng tế bào nguyên bào xương. (2) Nghiên cứu nếu có sự tồn tại tương tác giữa mVDR và tín hiệu insulin do các thụ thể insulin nằm trên bè lipid trong tế bào mỡ. (3) Nghiên cứu tác dụng của vitamin D đối với quá trình phân giải lipid và tổng hợp triglyceride ở chuột Caveolin-1 và Caveolin-2-null. Gần đây, người ta đã chứng minh rằng Caveolin-1 tương tác với mVDR trong dòng nguyên bào xương. (4) Nghiên cứu vai trò có thể có của mVDR trong lưu lượng acid béo trong và ngoài tế bào mỡ và vận chuyển tích cực qua bè lipid. (5) Nghiên cứu khả năng của hệ thống vitamin D/nVDR để điều hòa sự biểu hiện của protein bè lipid tế bào mỡ.
1.8. Điều hòa quá trình tạo mỡ bởi Vitamin D
1.8.1. Quá trình tạo mỡ và tầm quan trọng của nó đối với sức khỏe và bệnh tật
Quá trình tạo mỡ là giai đoạn biệt hóa liên tiếp để tạo thành các tế bào mỡ trưởng thành. Một tế bào gốc trung mô phát triển trước tiên thành tiền tế bào mỡ và sau đó thành tế bào mỡ trưởng thành thông qua quá trình biệt hóa đầu cuối. Các tiền tế bào mỡ trải qua các thay đổi hình thái và sinh hóa cho đến khi trở thành một tế bàomỡ có chức năng. Tế bào mỡ trưởng thành có thể thực hiện nhiều chức năng bao gồm tổng hợp lipid, lưu lượng acid béo qua màng, đáp ứng với tín hiệu insulin và tiết adipokine.
Sự hiểu biết về sự biệt hóa tế bào mỡ sẽ giúp hiểu được các cơ chế sinh lý bệnh của bệnh béo phì và các bệnh chuyển hóa khác.VDR được biểu hiện trong giai đoạn sớm nhất của quá trình biệt hóa tế bào mỡ. Thay đổi gen VDR sử dụng siRNA trong các tế bào 3T3-L1 đã ức chế quá trình tạo mỡ. Sự biệt hóa của nguyên bào sợi phôi chuột VDR+/+ và VDR-/- đã được nghiên cứu. Điều trị 1,25-(OH)2-D đã ngăn chặn quá trình tạo tế mỡ trong các tế bào VDR+/+ nhưng không thực hiện được trong các tế bào VDR-/-. Kết quả của các nghiên cứu này chỉ ra rằng nVDR gắn ligand có liên quan đến sự ức chế quá trình tạo mỡ [1].
1.8.2. Liệu vitamin D kích thích hay ức chế quá trình tạo mỡ?
Các kết quả mâu thuẫn thu được bởi các nhà nghiên cứu khác nhau khi nghiên cứu ảnh hưởng của 1,25-(OH)2-D đối với quá trình tạo mỡ. Trái ngược với tác dụng ức chế của nó trong dòng tế bào tạo tiền tế bào mỡ chuột 3T3-L1, 1,25-(OH)2-D thúc đẩy quá trình tạo mỡ ở chuột sơ cấp và các tiền tế bào mỡ người. Điều này được chứng minh bằng sự gia tăng của các dấu hiệu hình thành mô mỡ và tích lũy lipid. Mặt khác, 1,25-(OH)2-D ức chế biệt hóa tế bào mỡ nâu.Sự khác biệt về kết quả của các nghiên cứu khác nhau về tác dụng của 1,25-(OH)2-D đối với quá trình tạo mỡ có thể được quy cho sự khác nhau về phương pháp nghiên cứu bên cạnh sự khác biệt về chức năng sinh lý của mô mỡ ở các loài khác nhau. Ngoài ra, người ta cho rằng tác dụng 1,25-(OH)2-D đối với sự biệt hóa tế bào mỡ là nhạy cảm với thời gian. VDR được biểu hiện sớm trong quá trình tạo mỡ và mức độ VDR giảm theo quá trình biệt hóa. Điều này cho thấy rằng 1,25-(OH)2-D chỉ ức chế các sự kiện ban đầu của chương trình tạo mỡ ở các tế bào 3T3-L1 [1].
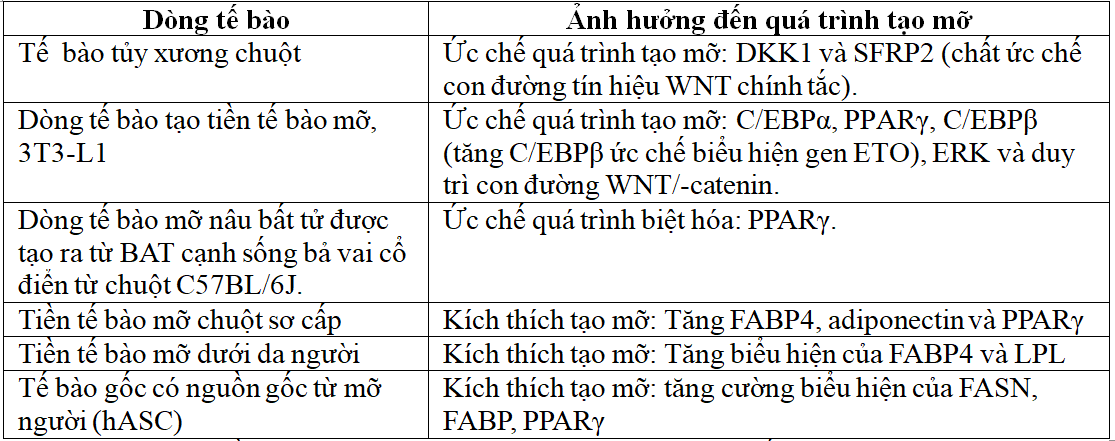
Bảng 2. Ảnh hưởng của vitamin D3 đến quá trình tạo mỡ[1].
1,25-(OH)2-D điều hòa quá trình tạo mỡ ở các cấp độ khác nhau của quá trình biệt hóa. Trong quá trình biệt hóa tiền tế bào, một số phân tử tín hiệu như các thành viên của gia đình WNT được giải phóng. Tác dụng chống tạo mỡ của 1,25-(OH)2-D đã được phát huy thông qua việc duy trì con đường WNT/-catenin, thường được điều hòa giảm trong quá trình tạo mỡ. Ngoài ra, 1,25-(OH)2-D đã ức chế sự biểu hiện mRNA và sự phosphoryl hóa của kinase được điều hòa ngoại bào (ERK), một trong các tín hiệu MAPK và do đó nó ức chế sự biệt hóa tế bào mỡ [1].
Các nghiên cứu sâu hơn về quá trình tạo mỡ có thể: (1) Cơ chế gen và không gen cụ thể của 1,25-(OH)2-D ảnh hưởng đến sự trưởng thành của tiền tế bào mỡ và tích lũy lipid. (2) Tiết lộ sự khác biệt về sự hình thành mỡ giữa các đối tượng nạc và béo phì bởi nghiên cứu gần đây cho thấy sự khác biệt tồn tại giữa hai nhóm này. (3) Có một nhu cầu nhất định phải tuân theo các tác động tạm thời của việc bổ sung 1,25-(OH)2-D trong quá trình tạo mỡ do các yếu tố phân tử nhất định có thể rất quan trọng ở pha một của quá trình biệt hóa. (4) Xác định vai trò của vitamin D đối với quá trình tạo mỡ trong cơ thể sống.
1.9. Tác dụng và cơ chế của 1,25-(OH)2-D đối với quá trình chết tế bào mỡ được lập trình
Phân tích microarray biểu hiện gen của tế bào mỡ dưới da người đã chứng minh sự ức chế đáng kể quá trình chết tế bào được lập trìnhbởi 1,25-(OH)2-D. Mặt khác, trong mô hình chuột béo phì do chế độ ăn chất béo cao, việc tăng lượng vitamin D3 có liên quan nghịch đến trọng lượng WAT gây ra cảm ứng quá trình chết tế bào được lập trình. Người ta đã chứng minh rằng liều thấp 1,25-(OH)2-D ức chế chết tế bào được lập trình ở tế bào 3T3-L1 được biệt hóa, trong khi liều cao lại kích thích ức chế chết tế bào được lập trình.
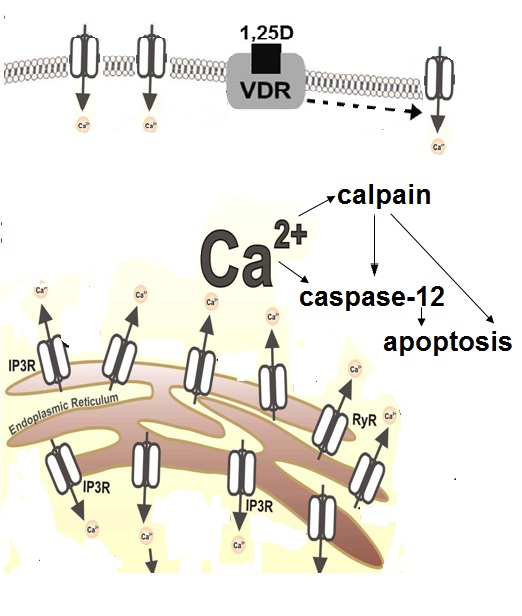
Liều vitamin D3 sinh lý (thấp) ức chế UCP2, tăng tiềm năng ty thể và năng suất ATP và do đó ức chế chết tế bào được lập trình. Mặt khác, tác dụng gây chết tế bào của liều vitamin D3 dược lý (cao) qua trung gian tín hiệu Ca2+.
Sự gia tăng bền vững của calci nội bào bắt đầu quá trình chết tế bào được lập trình bằng cách hoạt hóa calpain protease phụ thuộc Ca2+ và do đó hoạt hóa caspase-12 phụ thuộc Ca2+/calpain. Ở các tế bào mỡ trưởng thành, 1,25-(OH)2-D kích thích phụ thuộc kênh ion cũng như và hoạt hóa dòng Ca2+ không nhạy cảm với kênh ion và kích hoạt giải phóng Ca2+ từ lưu trữ mạng lưới nội chất qua các kênh IP3R và RyR.
Tính mẫn cảm của các tế bào mỡ trưởng thành đối với tăng tác dụng Ca2+ của 1,25-(OH)2-D phụ thuộc vào khả năng đệm Ca2+ của các tế bào này [1].
Hình 2. 1,25-(OH)2-D gây cảm ứng quá trình chết tế bào mỡ được lập trình [1].
1.10. Tác dụng của vitamin D đối với tiết adipokine
Các tế bào mỡ tiết ra nhiều adipokine như leptin, adiponectin và resistin. Các chất hóa học này có liên quan đến chức năng nội tiết và cân bằng nội môi. Nghiên cứu gần đây đã chứng minh rằng vitamin D điều chỉnh sự tiết của nhiều loại adipokine này [24].
1.10.1. Tác dụng của vitamin D đối với tiết adiponectin
Adiponectin là một protein huyết thanh được sản xuất đặc biệt bởi sự biệt hóa các tế bào mỡ. Đây là một loại hormone chống viêm và nhạy cảm với insulin. Nhiều đồng phân của adiponectin tồn tại do điều chỉnh sau phiên mã như quá trình hydroxyl và glycosyl hóa. Điều này dẫn đến sự hình thành các cấu trúc trimer và oligomeric bậc cao. Do đó, các hoạt tính sinh học của adiponectin phụ thuộc vào nồng độ trong huyết thanh, típ của các đồng phân hiện diện cũng như phân típ thụ thể hiện diện đặc hiệu mô. Trái ngược với các adipokine khác, adiponectin lưu hành có tương quan nghịch với BMI [29].
Ở trẻ béo phì bị thiếu hụt vitamin D, các adiponectin đa dạng, đặc biệt là dạng HMW, được điều hòa giảm [29]. Trong một nghiên cứu khác, doogh (một loại sữa chua Ba Tư) được tăng cường vitamin D đã được dùng cho bệnh nhân ĐTĐ típ 2. Kết quả dẫn đến sự gia tăng đáng kể nồng độ adiponectin trong huyết thanh của họ [12]. Trong ống nghiệm, điều trị bằng vitamin D3 gây điều hòa tăng adiponectin và DsbA-L, protein điều hòa đa năng adiponectin [29]. Mặt khác, không tìm thấy ảnh hưởng của 1,25-(OH)2-D đối với biểu hiện adiponectin trong nuôi cấy tế bào mỡ người [27].
1.10.2. Vitamin D ảnh hưởng đến biểu hiện leptin
Tình trạng bão hòa hormone leptin, được tiết ra bởi các tế bào mỡ, có mối tương quan tích cực với khối mỡ cơ thể. Nồng độ leptin trong huyết thanh tăng cao báo hiệu việc lưu trữ năng lượng cao lên não để ức chế sự thèm ăn và tăng tiêu hao năng lượng. Leptin có tác dụng tự và cận tiết mô mỡ ảnh hưởng tế bào mỡ để kiểm soát chuyển hóa lipid thông qua ức chế tổng hợp lipid và kích thích phân giải lipid [1].
Người ta đã quan sát thấy chuột bỏ gen Cyp27b1, chuột thiếu enzyme 1α-hydroxylase tổng hợp 1,25-(OH)2-D, bị hạ leptin máu và tiêu thụ nhiều thực phẩm hơn so với các loại tương ứng hoang dã. Ngoài ra, chuột VDRKO có kiểu hình nạc, hạ leptin máu và tăng thèm ăn bất thường do nồng độ leptin huyết thanh thấp [20].
Do nồng độ leptin trong huyết thanh được xác định bởi khối mô mỡ, nên không rõ liệu chứng hạ leptin máu này là do hàm lượng chất béo trong cơ thể thấp của chuột VDRKO hay do tác dụng trực tiếp của hệ thống vitamin D/VDR đối với biểu hiện leptin. Gần đây, người ta đã phát hiện ra rằng 1,25-(OH)2-D kích thích trực tiếp sự biểu hiện mRNA và tiết leptin trong nuôi cấy mô mỡ từ chuột hoang dã nhưng không phải từ chuột không VDR. Hơn nữa, sự điều hòa tăng leptin gây ra bởi 1,25-(OH)2-D rõ hơn ở các mô mỡ thu được từ chuột biến đổi gen VDR biểu hiện vượt trội VDR ở tế bào mỡ so với chuột hoang dã. Trái ngược với kết quả tham khảo [15], người ta đã báo cáo rằng 1,25-(OH)2-D ức chế biểu hiện mRNA leptin bởi ít nhất 84% trong các tế bào mỡ 3T3-L1 chuột. Mặt khác, vitamin D gây ra leptin trong tế bào u nguyên bào thần kinh đệm (U87) ở người cũng như trong não chuột có thể tạo ra hiệu ứng no [13]. Kết quả của các nghiên cứu này chỉ ra rằng ảnh hưởng của 1,25-(OH)2-D đối với biểu hiện leptin là đặc hiệu mô. Tóm lại, vitamin D ảnh hưởng đến cân bằng nội môi năng lượng bằng cách điều hòa trực tiếp biểu hiện leptin. Tuy nhiên, tác dụng trên cơ thể sống chính xác của 1,25-(OH)2-D đối với biểu hiện leptin ở người cần được nghiên cứu thêm trong điều kiện sức khỏe và bệnh tật.
1.10.3. Con đường tín hiệu giữa leptin và 1,25-(OH)2-D
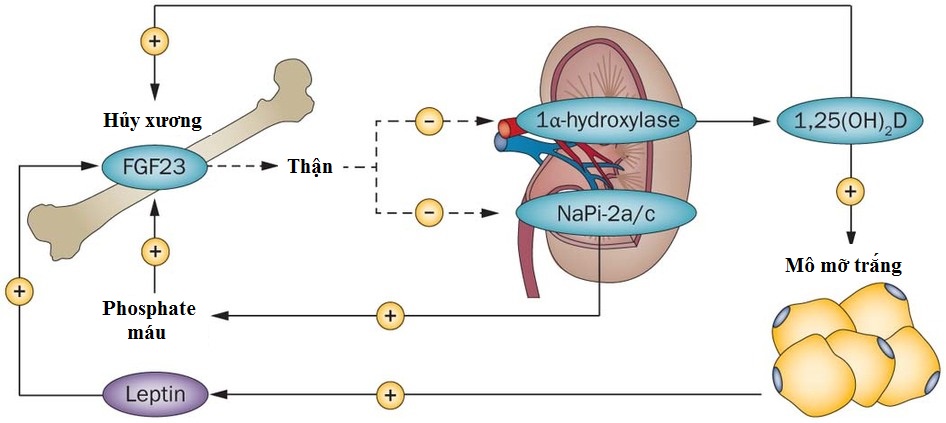
Sự hiện diện của con đường tín hiệu giữa leptin và 1,25-(OH)2-Dvà/hoặc phosphate đã được đề xuất. Sự tương tác này có thể xảy ra trong tế bào chất thông qua mạng lưới các con đường phosphoryl hóa. Mặt khác, nó có thể xảy ra ở mức độ của gen FGF23 thông qua các yếu tố đáp ứng chồng chéo hoặc lặp lại cho leptin (STAT3), vitamin D (VDRE) và phosphate (gọi là PO4RE). Leptin ngăn chặn sự chuyển đổi ở thận của vitamin D3 thành 1,25-(OH)2-D gián tiếp bằng cách kích thích quá trình tạo xương và/hoặc sản xuất FGF23 tế bào xương. FGF23, lần lượt, ức chế tổng hợp 1,25-(OH)2-D bằng cách ức chế 1α-hydroxylase ở thận. Mặt khác, sự vắng mặt của tín hiệu qua trung gian VDR, như trong Vdr-/- và Cyp27b1-/- chuột, làm suy yếu sự phát triển của WAT và do đó tiết leptin [1].
Hình 3. Vòng phản hồi nội tiết giữa hệ thống nội tiết vitamin D và tế bào mỡ[4].
1.10.4. Vitamin D đóng vai trò nền tảng trong việc điều chỉnh đáp ứng viêm mô mỡ
Mô mỡ có một bộ tế bào miễn dịch duy nhất đôi khi thể hiện các chức năng bất thường. Các tế bào miễn dịch thường trú này đóng một vai trò rất quan trọng trong mô mỡ và cân bằng nội môi miễn dịch [16]. Một số nghiên cứu trong ống nghiệm đã chứng minh rằng 1,25-(OH)2-Dcó tác dụng chống viêm ở tế bào mỡ. Vitamin D3 làm giảm giải phóng chemokine và cytokine bởi các tế bào mỡ và hóa hướng động bạch cầu đơn nhân [7]. Trong nuôi cấy mô mỡ, 25-OH-D và 1,25-(OH)2-D hạ thấp giải phóng cytokine từ mô mỡ mạc nối ruột nhưng không SAT. Đáng ngạc nhiên, hiệu ứng này chỉ được tạo ra ở nuôi cấy nữ chứ không phải ở nam giới [24].
Trong cơ thể sống, vitamin D làm giảm các cytokine và chemokine tiền viêm ở chuột được tiêm LPS (viêm cấp tính) và chuột béo phì do chế độ ăn (viêm chuyển hóa) [14]. Trong một nghiên cứu trong cơ thể sống khác, một mối liên quan nghịch giữa nồng độ IL-6 và TNF-α trong huyết tương và nồng độ 25-OH-D3 trong huyết thanh đã được tìm thấy ở các đối tượng có cân nặng bình thường [6]. Tuy nhiên, vitamin D không có ảnh hưởng đến các dấu ấn sinh học gây viêm trong huyết thanh hoặc mô mỡ ở các đối tượng béo phì. Kết quả tham khảo cần xác nhận thêm vì nó dựa trên số lượng nhỏ người tham gia (chỉ có 22 đối tượng nhận vitamin D và 18 giả dược) [31]. Ngoài ra, giới tính của các người tham gia không được đề cập trong nghiên cứu đó. Do đó, các nghiên cứu trong cơ thể sống lớn hơn nhằm giải quyết sự khác biệt về giới là cần thiết để nghiên cứu ảnh hưởng của 1,25-(OH)2-Dđối với dấu ấn sinh học gây viêm trong mô mỡ và huyết thanh của các đối tượng béo phì.
Sự kích thích mạn tính của các tế bào miễn dịch có thể dẫn đến tình trạng viêm và bệnh sinh liên quan đến béo phì. Thay đổi miễn dịch trong bệnh béo phì và các tình trạng bệnh như đái tháo đường phải được xem xét trong bất kỳ nghiên cứu nào về tác dụng của vitamin D đối với hệ thống miễn dịch. Các tế bào lympho cư trú mô mỡ chống viêm như các tế bào iNKT đôi khi bị suy giảm trong béo phì [16]. Hơn nữa, hoạt động của tế bào lympho T được điều chỉnh trong béo phì [22]. Một tập hợp con của tế bào lympho T được gọi là tế bào Treg đã giảm đáng kể trong VAT ở chuột béo phì [33].
Gần đây, hai cơ chế riêng biệt cơ bản về kháng insulin đã được báo cáo. Đầu tiên là tình trạng kháng insulin liên quan đến béo phì được cho là do viêm thúc đẩy đại thực bào [21]. Thứ hai là tình trạng kháng insulin liên quan đến tuổi, độc lập với béo phì được điều hòa bởi tế bào fTreg (thường trú trong chất béo) [2]. Vitamin D3 làm giảm viêm thông qua việc tăng cường ức chế hoạt động của Tregs [33]. Tuy nhiên, tác dụng của vitamin D đối với fTreg cần nhiều nỗ lực hơn để hiểu được [19].
Các tác dụng chống viêm của vitamin D qua trung gian bằng cách ức chế các con đường truyền tín hiệu NFkB và MAPK. Ngoài ra, vitamin D làm giảm biểu hiện TLR, tăng ở cả tế bào miễn dịch và mô mỡ từ các đối tượng thừa cân và béo phì. TLR là một protein xuyên màng khởi xướng các tầng tín hiệu cổ điển dẫn đến việc hoạt hóa các yếu tố phiên mã gen, chẳng hạn như sản xuất NFκB và cytokine. Hoạt hóa con đường tín hiệu NF-kB là điều cần thiết trong sự truyền tín hiệu của các cytokine tiền viêm trong tế bào mỡ. 1,25-(OH)2-D làm tăng biểu hiện IκBα và giảm quá trình phosphoryl hóa và chuyển vị trí của NFκB p65 vào nhân tế bào. Ngoài ra, việc bổ sung 1,25-(OH)2-Ddẫn đến sự khử phospho của p38 [1].
1.11. Sự tham gia của hệ thống vitamin D/VDR và VDR không có ligand trong chuyển hóa năng lượng
Mô mỡ tham gia vào quá trình chuyển hóa năng lượng trong cơ thể. Nó không chỉ liên quan đến việc lưu trữ năng lượng, mà còn tiết ra các adipokine điều hòa sự thèm ăn. Hơn nữa, mô mỡ kiểm soát sinh nhiệt. Hai loại mô mỡ được công nhận: WAT nằm ở dưới da và nội tạng và BAT là một loại mô mỡ duy nhất ở động vật có vú có chức năng điều hòa nhiệt độ cơ thể. Mỡ nâu được cho là chỉ tìm thấy ở người trong giai đoạn sơ sinh, tuy nhiên, gần đây nó đã được chứng minh rằng có mặt trong suốt cuộc đời người trưởng thành [1].
Nhiều nghiên cứu ủng hộ sự tham gia của hệ thống 1,25-(OH)2-D/VDR trong điều chỉnh chuyển hóa lipid tế bào mỡ và cân bằng nội môi năng lượng. Chuột bị loại bỏ VDR có kiểu hình nạc và có khả năng chống lại bệnh béo phì do chế độ ăn.
Ngoài ra, chuột loại bỏ VDR tích lũy ít chất béo theo tuổi và để đáp ứng với chế độ ăn nhiều chất béo. Biểu hiện mục tiêu của VDR người ở các tế bào mỡ làm giảm quá trình phân giải lipid, oxy hóa β acid béo và gây béo phì ở chuột.
Trong các mô hình loại bỏ và chuyển gen này, kiểu hình không nhất thiết là do tương tác ligand/thụ thể, nhưng có thể là do hoạt động của VDR không có ligand [1].
Sự điều chỉnh vitamin D của chuyển hóa lipid tế bào mỡ và cân bằng nội môi năng lượng liên quan đến các hoạt động bộ gen và không bộ gen. Một cơ chế là thông qua điều hòa biểu hiện UCP. UCP hiện diện trong màng trong của ty thể. Chúng kích thích rò rỉ proton và do đó có vai trò quan trọng trong quá trình sinh nhiệt. UCP1 là protein chính để tách cặp oxy hóa acid béo trong mỡ nâu. UCP2 được biểu hiện ở khắp nơi với mức cao nhất trong WAT. Sự đa hình trên nhiễm sắc thể UCP2-UCP3 ở người có mối liên hệ di truyền mạnh mẽ với tốc độ chuyển hóa khi nghỉ ngơi. Điều này hỗ trợ sự tham gia của UCPs trong sinh nhiệt cơ bản[1].
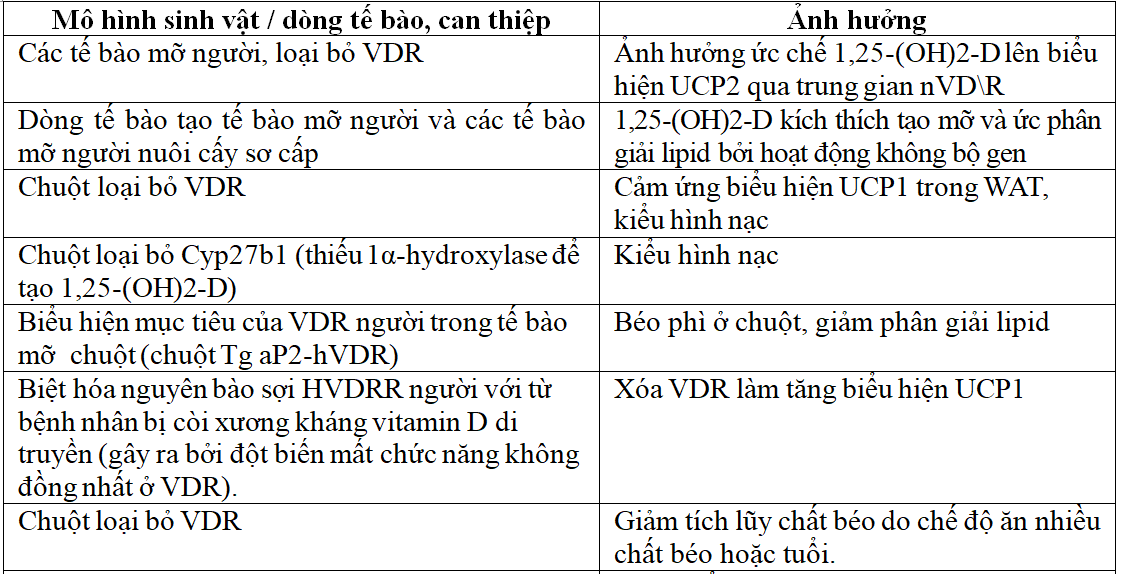
Bảng 3. Sự tham gia của hệ thống Vitamin D3/VDR trong cân bằng nội môi năng lượng[1].
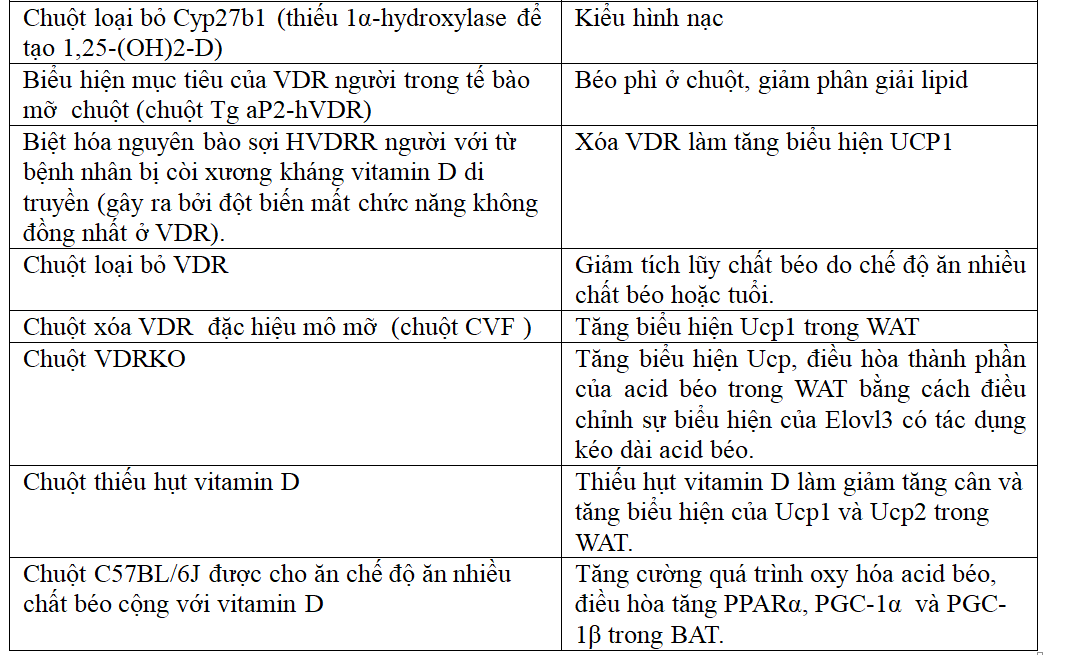
1.11.1. Chức năng của VDR trong mô mỡ trên chuyển hóa năng lượng có thể đặc trưng cho giới tính
Một nghiên cứu gần đây đã điều tra các ảnh hưởng của việc cho chuột CVF (chuột bị xóa VDR đặc hiệu tế bào mỡ tuyến vú) ăn chế độ nhiều chất béo [18]. Tương tự như chuột VDRKO, sự gia tăng đáng kể biểu hiện của gen Ucp1 điều hòa VDR đã được báo cáo ở WAT của chuột CVF. Mặt khác, VAT; nhưng không phải SAT động vật có vú, trọng lượng đã tăng lên ở chuột cái CVF so với nhóm chứng. Các tác giả kết luận rằng VDR trong tế bào mỡ trưởng thành ngăn chặn tăng cân. Tuy nhiên, không có lời giải thích nào được đưa ra cho sự khác biệt giữa mô hình VDRKO toàn cầu; trong đó biểu hiện teo mỡ [32] và mô hình xóa VDR đặc hiệu tế bào mỡ động vật có vú. Đáng ngạc nhiên, chỉ chuột cái CVF có tốc độ tăng trưởng cao hơn so với chuột đối chứng. Các phát hiện cho thấy tín hiệu VDR của tế bào mỡ ảnh hưởng đến trọng lượng cơ thể và khối lượng mỡ ở giống cái nhưng không ở giống đực có thể có ý nghĩa đối với các nghiên cứu lâm sàng điều tra về tác dụng của vitamin D đối với cân nặng trong bệnh béo phì [18].
Sự hiểu biết về các cơ chế phân tử làm cơ sở cho sự khác biệt giới tính trong việc tăng cân là một lĩnh vực nghiên cứu hấp dẫn mới cần được nghiên cứu thêm. Gần đây, sự khác biệt về giới tính trong biểu hiện của một số protein trong WAT và BAT đã được báo cáo khi chuột được cho ăn chế độ ăn nhiều chất béo. Trong số các protein này có một protein gọi là Pdia3 có nồng độ cao hơn ở giống cái so với đực. Pdia3 là một protein đa chức năng có trong bè lipid của màng sinh chất. Nó liên quan đến tín hiệu tế bào và điều hòa chuyển hóa acid béo trong các mô khác. Trong nuôi cấy tế bào xương, Pdia3 đã được báo cáo là tương tác với mVDR để gây ra đáp ứng nhanh. Tuy nhiên, chức năng của Pdia3 và liệu nó có tương tác với mVDR trong tế bào mỡ hay không vẫn chưa được biết [1].
1.12. Vitamin D và béo phì
Béo phì là kết quả của sự mất cân bằng giữa hấp thu và tiêu hao năng lượng. Sự gia tăng khối lượng chất béo ở người béo phì là do sự gia tăng số lượng tế bào mỡ (tăng sản) và kích thước tế bào mỡ (phì đại). Béo phì là một vấn đề sức khỏe toàn cầu. Nó được coi là một yếu tố nguy cơ quan trọng đối với đái tháo đường, ung thư, bệnh tim mạch và tăng huyết áp. Các đa hình ở VDR có liên quan đến sự nhạy cảm với béo phì ở người bình thường và làm khởi phát sớm đái tháo đường típ 2. Tuy nhiên, một nghiên cứu di truyền gần đây cho thấy các gen di truyền tín hiệu vitamin D không có bất kỳ vai trò nào trong các đặc điểm liên quan đến béo phì [1].
1.12.1. Tại sao người béo phì có nồng độ 25-OH-D3 lưu hành thấp hơn?
Một số lượng lớn các nghiên cứu đã xác nhận sự hiện diện của thiếu hụt vitamin D ở người béo phì. Mối tương quan nghịch giữa 25-OH-D3 huyết thanh và phần trăm mỡ cơ thể mạnh hơn ở người da trắng so với người da đen cùng tuổi. Trong cùng một chủng tộc, mối tương quan mạnh hơn ởngười trẻ tuổi so với người lớn tuổi. Hơn nữa, một số nghiên cứu đã chỉ ra rằng việc giảm trọng lượng cơ thể và phần trăm khối lượng chất béo làm tăng nồng độ 25-OH-D3 lưu hành ở người trưởng thành béo phì mặc dù không phải như vậy trong các nghiên cứu khác [1].
Các cách giải thích khác nhau đã được đề xuất cho tình trạng thiếu vitamin D liên quan đến béo phì bao gồm: 1) Pha loãng thể tích có nghĩa là nồng độ vitamin D trong huyết thanh giảm khi kích thước cơ thể và do đó lượng mỡ dự trữ tăng [9]. 2) Sự khác biệt trong lối sống giữa người béo phì và người gầy: Người béo phì có thể nhạy cảm về hình thể, tham gia các hoạt động ngoài trời ít hơn, che đậy và mặc nhiều quần áo hơn người gầy và điều này làm giảm tiếp xúc với ánh nắng mặt trời. 3) Sự khác biệt về khả năng hoạt hóa vitamin D giữa người béo phì và người gầy: Mức độ biểu hiện của các enzyme hoạt hóa vitamin D, 25-hydroxylase CYP2J2 và CYP27B1 1α-hydroxylase, thấp hơn trong SAT ở phụ nữ béo phì so với gầy [30]. 4) Sự cô lập vitamin D trong mô mỡ: Sự cô lập có nghĩa là hấp thu vitamin D qua uống và tổng hợp ở da được liên kết chặt chẽ trong các kho chứa chất béo và do đó không được giải phóng thích hợp vào tuần hoàn để cung cấp cho 25-OH-D3 lưu hành trong huyết thanh. Các báo cáo cho rằng các đối tượng béo phì có đáp ứng yếu hơn với liều bức xạ UV-B tiêu chuẩn so với người có cân nặng bình thường. Cần lưu ý rằng các cơ chế kiểm soát sự lắng đọng và giải phóng vitamin D từ mô mỡ vẫn chưa được biết [17].
1.12.2. Liệu thiếu hụt vitamin D có phải là yếu tố nguy cơ độc lập gây béo phì?
Ở vĩ độ cao với nhiệt độ lạnh, sự thay đổi theo mùa ở vitamin D hoạt động như một cơ chế tín hiệu để giúp động vật lưu trữ nhiều chất béo hơn cho quá trình sinh nhiệt. Nếu điều này áp dụng cho con người, thì cơ thể sẽ tích trữ nhiều chất béo hơn khi mức vitamin D giảm. Người ta đã đề xuất rằng thiếu vitamin D là nguyên nhân gây ra dịch béo phì. Mặc dù có sự hỗ trợ đáng kể cho vai trò của vitamin D trong chuyển hóa năng lượng, các nghiên cứu điều tra vai trò của vitamin D đối với bệnh béo phì ở người là không thuyết phục [1].
Về mặt lý thuyết, vitamin D thấp có thể gây béo phì thông qua các cơ chế sau: 1) Bệnh cường tuyến cận giáp thứ phát do tình trạng giảm vitamin D. Nồng độ hormone tuyến cận giáp tăng làm tăng calci nội bào trong tế bào mỡ. Điều này dẫn đến tăng tổng hợp lipid và tăng cân. 2) Điều hòa sự tăng trưởng và tái tạo mô mỡ người bằng cách điều chỉnh quá trình tạo mỡ và chết tế bào mỡ được lập trình. Liều thấp 1,25-(OH)2-Dức chế chết tế bào mỡ được lập trình ở các tế bào 3T3-L1 được biệt hóa. Hơn nữa, chết tế bào mỡ được lập trình kích thích tạo mỡ trong các tiền tế bào mỡ dưới da người [1].
Mặc dù gợi ý rằng thiếu hụt vitamin D là một yếu tố nguy cơ độc lập đối với bệnh béo phì, các phát hiện của một số nhà nghiên cứu đã bác bỏ tuyên bố này. Chuột thiếu vitamin D tăng cân ít hơn, có VAT thấp hơn và tiêu hao năng lượng cao hơn do tăng biểu hiện UCP [3].
Trong một nghiên cứu di truyền, người ta đã phát hiện ra rằng béo phì là yếu tố gây ra sự thiếu hụt vitamin D nhưng không có bằng chứng nào cho thấy thiếu vitamin D đóng vai trò là yếu tố gây ra sự phát triển của béo phì [28]. Tương tự, trong một nghiên cứu liên quan đến 7000 phụ nữ Trung Quốc, các biến thể di truyền trong gen di truyền vitamin D không được tìm thấy có vai trò chính trong bệnh béo phì [8].
1.12.3. Liệu vitamin D có thể bảo vệ chống lại và/hoặc điều trị bệnh béo phì do chế độ ăn?
Một thử nghiệm kiểm soát ngẫu nhiên gần đây cho thấy bổ sung vitamin D 25µg/ngày cho phụ nữ thừa cân và béo phì trong 12 tuần gây ra mất khối lượng mỡ mà không ảnh hưởng đến trọng lượng cơ thể và vòng bụng [26]. Tương tự như vậy, trong một mô hình chuột béo phì do chế độ ăn, vitamin D cao, calci cũng như sự kết hợp của vitamin D cao/calci cao làm giảm tình trạng thừa cân – béo phì. Tuy nhiên, giảm cân không bị ảnh hưởng đáng kể khi bổ sung vitamin D trong các thử nghiệm khác [1].
Tác dụng phòng ngừa của việc bổ sung vitamin D3 khi bắt đầu béo phì trong mô hình chuột béo phì do chế độ ăn đã được nghiên cứu. Bổ sung vitamin D hạn chế tăng cân do chế độ ăn nhiều chất béo, tăng cường oxy hóa acid béo, giải phóng insulin và cải thiện tình trạng kháng insulin. Hơn nữa, Vitamin D cải thiện sự hấp thu glucose do insulin kích thích trong tế bào mỡ. Có ý kiến cho rằng 1,25-(OH)2-D đã củng cố sự hấp thu 2-deoxyglucose trong điều kiện cơ bản và kích thích TNF trong các tiền tế bào mỡ 3T3-L1 thông qua điều chỉnh tín hiệu insulin. Do đó, người ta đã đề xuất rằng bổ sung vitamin D3 có thể được sử dụng để ngăn ngừa sự khởi phát của béo phì và các rối loạn chuyển hóa liên quan [1].
TÀI LIỆU THAM KHẢO
- Abbas MA. Physiological functions of Vitamin D in adipose tissue. The Journal of Steroid Biochemistry and Molecular Biology. 2017;165:369-81.
- Bapat SP,Myoung Suh J, Fang S, Liu S, Zhang Y, Cheng A, Zhou C, Liang Y, LeBlanc M, Liddle C, Atkins AR, Yu RT, Downes M, Evans RM, Zheng Y. Depletion of fat-resident Treg cells prevents age-associated insulin resistance. 2015;3528(7580):137-141.DOI: 10.1038/nature16151.
- Bhat M, Noolu B, Qadri S, Ismail A. Vitamin D deficiency decreases adiposity in rats and causes altered 2 expression of uncoupling proteins and steroid receptor coactivator. J Steroid Biochem Mol Biol. 2014;144 part B:304–312. DOI: 1016/j.jsbmb.2014.08.005.
- Bouillon R, Carmeliet G, Lieben L, Watanabe M, Perino A, Auwerx J, Schoonjans K, Verstuyf A. Vitamin D and energy homeostasis: of mice and men. Nat Rev Endocrinol. 2014;10 (2):79–87. DOI: 1038/nrendo.2013.226.
- Combs, Gerald F, and James P. McClung.The Vitamins: Fundamental Aspects in Nutrition and Health. , 2017. Internet resource.
- De Souza WN, Norde MM, Oki É, Rogero MM, Marchioni DML, Fisberg RM, et al. Association between 25-hydroxyvitamin D and inflammatory biomarker levels in a cross-sectional population-based study, São Paulo, Brazil. Nutrition Research. 2016;36(1):1-8.
- Ding C, Wilding JPH, Bing C. 1,25-dihydroxyvitamin D3 protects against macrophage-induced activation of NFκB and MAPK signalling and chemokine release in human adipocytes. PloS one. 2013;8(4):e61707-e.
- Dorjgochoo T, Shi J, Gao YT, Long J, Delahanty R, Xiang Y-B, Cai Q, Shu XO. Genetic variants in vitamin D metabolism-related genes and body mass index: analysis of genome-wide scan data of approximately 7000 Chinese women. Int J Obes (Lond). 2012; 36:1252–1255. DOI: 10.1038/ijo.2011.246.
- Drincic AT, Armas LA, Van Diest EE, Heaney RP. Volumetric dilution, rather than sequestration best explains the low vitamin D status of obesity. Obesity. 2012;20:1444-1448. DOI: 10.1038/oby.2011.404.
- Haussler MR, Jurutka PW, Mizwicki M, Norman AW. Vitamin D receptor (VDR)-mediated actions of 1α,25(OH)2vitamin D3: genomic and non-genomic mechanisms. Best Pract Res Clin Endocrinol Metab. 2011;25(4):543-559. DOI: 10.1016/j.beem.2011.05.010.
- Honek J, Lim S, Fischer C, Iwamoto H, Seki T, Cao Y. Brown adipose tissue, thermogenesis, angiogenesis: pathophysiological aspects. Hormone Molecular Biology and Clinical Investigation 2014. p.5.
- Kalayi A, Nikooyeh B, Zahedirad M, Shariatzadeh N, Tayebinejad N, Salekzamani S, et al. Improvement of Vitamin D Status via Daily Intake of Fortified Yogurt Drink Either with or without Extra Calcium Ameliorates Systemic Inflammatory Biomarkers, including Adipokines, in the Subjects with Type 2 Diabetes. The Journal of Clinical Endocrinology & Metabolism. 2012;97(6):2005-11.
- Kaneko I, Sabir MS, Dussik CM, Whitfield GK, Karrys A, Hsieh J-C, et al. 1,25-Dihydroxyvitamin D regulates expression of the tryptophan hydroxylase 2 and leptin genes: implication for behavioral influences of vitamin D. The FASEB Journal. 2015;29(9):4023-35.
- Karkeni E, Peiretti F, Tourniaire F, Marcotorchino J, Astier J, Darmon P, et al. Vitamin D Limits Chemokine Expression in Adipocytes and Macrophage Migration In Vitro and in Male Mice. Endocrinology. 2015;156(5):1782-93.
- Kong J, Chen Y, Zhu G, Zhao Q, Chun Li Y. 1,25-Dihydroxyvitamin D3 Up-regulates Leptin Expression in Mouse Adipose Tissue 2012.
- Lynch L. Adipose invariant natural killer T cells. Immunology. 2014;142(3):337-46.
- Malmberg P, Karlsson T, Svensson H, Lönn M, Carlsson N-G, Sandberg A-S, et al. A new approach to measuring vitamin D in human adipose tissue using time-of-flight secondary ion mass spectrometry: A pilot study. Journal of Photochemistry and Photobiology B: Biology. 2014;138:295-301.
- Matthews DG, D’Angelo J, Drelich J, Welsh J. Adipose-specific Vdr deletion alters body fat and enhances mammary epithelial density. J Steroid Biochem Molecul Biol. 2015. DOI.org/10.1016/j.jsbmb.2015.09.035.
- Mocanu V, Oboroceanu T, Zugun-Eloae F. Current status in vitamin D and regulatory T cells-immunological implications. Rev Med Chir Soc Med Nat Iasi. 2013;117(4):965-73. DOI:10.1007/s12026-014-8499-y.
- Narvaez CJ, Matthews D, Welsh J, Chan M, Broun E. Lean Phenotype and Resistance to Diet-Induced Obesity in Vitamin D Receptor Knockout Mice Correlates with Induction of Uncoupling Protein-1 in White Adipose Tissue. Endocrinology. 2009;150(2):651-61.
- Olefsky JM,Glass CK. Macrophages, inflammation, and insulin resistance. Annu Rev Physiol. 2010;72:219-246. DOI: 10.1146/annurev-physiol-021909-135846.
- MS, Marjorie P, Marie-Christine A, Jean-François L, A. NJ. Modulation of T Cell Activation in Obesity. Antioxidants & Redox Signaling. 2017;26(10):489-500.
- Pike JW, Meyer MB. Fundamentals of vitamin D hormone-regulated gene expression. The Journal of Steroid Biochemistry and Molecular Biology. 2014;144:5-11.
- Roy P, Nadeau M, Valle M, Bellmann K, Marette A, Tchernof A, et al. Vitamin D reduces LPS-induced cytokine release in omental adipose tissue of women but not men. Steroids. 2015;104:65-71.
- Ryynänen J, Neme A, Tuomainen T-P, Virtanen JK, Voutilainen S, Nurmi T, de Mello VDF, Uusitupa M, Carlberg C. Changes in vitamin D target gene expression in adipose tissue monitor the vitamin D response of human individuals. Mol Nutr Food Res. 2014; 58:2036–2045. DOI: 10.1002/mnfr.201400291.
- Salehpour A, Hosseinpanah F, Shidfar F, Vafa M, Razaghi M, Dehghani S, Hoshiarrad A, Gohari M. A 12-week double-blind randomized clinical trial of vitamin D(3) supplementation on body fat mass in healthy overweight and obese women. Nutr J. 2012;11:78-85. DOI: 1186/1475-2891-11-78.
- Sun X, Zemel MB. Calcium and 1,25-Dihydroxyvitamin D3 Regulation of Adipokine Expression. Obesity. 2007;15(2):340-8.
- Vimaleswaran KS, Berry DJ, Lu C, Tikkanen E, Pilz S, Hiraki LT, et al. Causal relationship between obesity and vitamin D status: bi-directional Mendelian randomization analysis of multiple cohorts. PLoS medicine. 2013;10(2):e1001383-e.
- Walker GE, Ricotti R, Roccio M, Moia S, Bellone S, Prodam F, et al. Pediatric Obesity and Vitamin D Deficiency: A Proteomic Approach Identifies Multimeric Adiponectin as a Key Link between These Conditions. PLOS ONE. 2014;9(1):e83685.
- Wamberg L, Christiansen T, Paulsen SK, Fisker S, Rask P, Rejnmark L, et al. Expression of vitamin D-metabolizing enzymes in human adipose tissue – the effect of obesity and diet-induced weight loss. International Journal Of Obesity. 2012;37:651.
- Wamberg L, Cullberg KB, Rejnmark L, Richelsen B, Pedersen SB. Investigations of the Anti-inflammatory Effects of Vitamin D in Adipose Tissue: Results from an In Vitro Study and a Randomized Controlled Trial. Horm Metab Res. 2013;45(06):456-62.
- Weber K, Erben RG. Differences in triglyceride and cholesterol metabolism and resistance to obesity in male and female vitamin D receptor knockout mice. J Anim Physiol Anim Nutr.2013;97(4):675–683. DOI: 10.1111/j.1439-0396.2012.01308.x.
- Zeng H, Chi H. Metabolic control of regulatory T cell development and function. Trends in immunology. 2015;36(1):3-12.
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam