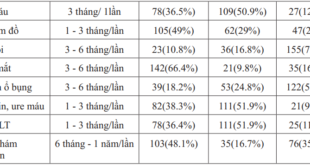
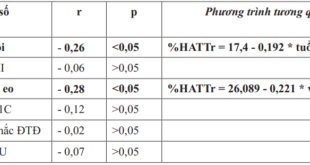
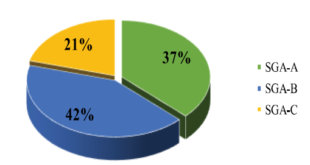
ALZHEIMER VÀ ĐÁI THÁO ĐƯỜNG TÍP 2
Nguyễn Văn Vy Hậu1, Nguyễn Hải Thủy2, Hoàng Minh Lợi, Nguyễn Đình Toàn2
1.BV Gia Đình Đà Nẵng
2.Trường Đại học Y Dược Huế
DOI: 10.47122/vjde.2021.47.27
SUMMARY
Alzheimer and type 2 diabetes
Nowadays, the role of magnetic resonance imaging in dementia diagnosis such as: Alzheimer, Vascular dementia, Dementia Lewi bodies and Pakinson disease…. MRI may support the diagnosis of specific neurodegenerative disorders and sometimes MRI are necessary to confirm the diagnosis. It is a challenge for neuroimaging to contribute to the early diagnosis of neurodegenerative diseases such as Alzheimer’s disease. Early diagnosis includes recognition of pre-dementia conditions, such as mild cognitive impairment (MCI). In addition, early diagnosis allows early treatment using currently available therapies or new therapies in the future. Neuroimaging may also be used to assess disease progression and is adopted in current trials investigating MCI and AD. The coronal image shows the hippocampus, the main structure involved in many forms of dementia.
1. ĐẶT VẤN ĐỀ
Suy giảm thần kinh nhận thức là một hội chứng có thể do nhiều bệnh lý khác nhau tác động đến, có thể hồi phục hoặc không hồi phục được. Hội chứng lâm sàng này có đặc trưng là một tình trạng suy thoái mắc phải dai dẳng ít nhất trong ba lĩnh vực chức năng: ngôn ngữ, trí nhớ, giảm hoặc mất thị giác, định hướng không gian và thời gian, khả năng điều hành cảm xúc và hoạt động xã hội. Sa sút trí tuệ thường nối tiếp sau suy giảm thần kinh nhận thức nhẹ và nặng nhất là Alzheimer. Tiến trình này không hồi quy nhưng có thể làm chậm được sự tiến triển đến các giai đoạn nặng.
Đái tháo đường là một rối loạn chuyển hóa glucose máu mạn tính tình trạng thiếu hụt insulin hoặc không tiếp nhận insulin tại mô đích. Sự gia tăng nồng độ đường máu kéo dài đã ảnh hưởng lên quá trình sống của tế bào trong đó có tế bào thần kinh, hệ thống mạch máu lớn và mạch máu nhỏ và gây ngộ độc bởi các sản phẩm đường hóa bậc cao, các quá trình stress oxy hóa. Song song với sự ảnh hưởng glucose máu, các rối loạn khác song hành với các tiến trình viêm do cường insulin máu, rối loạn lipid máu, đã đẩy nhanh tốc độ hủy hoại tế bào khắp nơi trong cơ thể.
Quá trình ảnh hưởng của đái tháo đường lên hoạt động não bộ đã nghiên cứu từ trước những năm 80 thế kỷ trước. Gần đây các nhà khoa học đã minh chứng những liên quan mật thiết giữa đái tháo đường với sự gia tăng các mảng bám amyloid β và các chuỗi protein tau gây phá hủy cấu trúc tế bào thần kinh và sợi trục. Tiến trình ảnh hưởng đến tế bào thần kinh của đái tháo đường âm ỉ và không triệu chứng, đến khi các triệu chứng suy giảm chức năng nhận thức vận động xuất hiện thì tình trạng bệnh lý đã diễn tiến nặng, khó khả năng phục hồi.
Đái tháo đường đã làm gia tăng nguy cơ tiến triển đến Alzheimer gấp ba lần so với những người không mắc đái tháo đường. Một số nhà khoa học thần kinh còn đặt ra vấn đề có nên xem bệnh Alzheimer là đái tháo đường type 3 hay không?. Việc chăm sóc và điều trị bệnh nhân vừa có bệnh lý sa sút trí tuệ đã tốn kém nay lại càng tốn kém hơn và tỷ lệ từ vong ở các nhóm đối tượng này thường sau 10 năm kể từ khi có triệu chứng bệnh.
Những năm gần đây ADA, IDF hay WHO đã nhìn nhận đái tháo đường là một trong những nguyên nhân dẫn đến tỷ lệ tử vong tim mạch hàng đầu so với các nguyên nhân khác. Quan trọng nhất, các tổ chức đều nhấn mạnh đến vai trò kiểm soát đường máu an toàn để có thể ngăn ngừa tiến trình phát triển biến chứng.
Quản lý và tầm soát các biến chứng trong đó có biến chứng sa sút trí tuệ đã trở thành chủ đề thời sự hiện nay. Với các tiến bộ của chuyên ngành chẩn đoán hình ảnh đặc biệt là MRI sọ não đã giúp chúng ta có thể phát hiện sớm các tổn thương não do bệnh đái tháo đường gây ra nói riêng và các yếu tố nguy cơ tim mạch khác gây ra nói chung. Song song với các bài kiểm tra chức năng thần inh nhận thức như Mini-Cog hay MMSE, MoCa sẽ giúp chúng ta có thể chẩn đoán sớm từ khi bệnh nhân có giai đoạn suy giảm nhận thức nhẹ (MCI), hay ngăn ngừa tốc độ phát triển thành sa sút trí tuệ thật sự ở các nhóm rối loạn chức năng nhận thức này.
Trong phạm vi bài báo cáo này, chúng tôi xin được phép trình bày đại cương về cơ chế bệnh sinh của đái tháo đường ảnh hưởng đến bệnh Alzheimer. Song song chúng tôi cũng làm rõ hình ảnh học MRI sọ não của các thể suy giảm thần kinh nhận thức trên.
2. CƠ CHẾ BỆNH SINH ALZHEIMER VÀ ĐÁI THÁO ĐƯỜNG TYPE 2
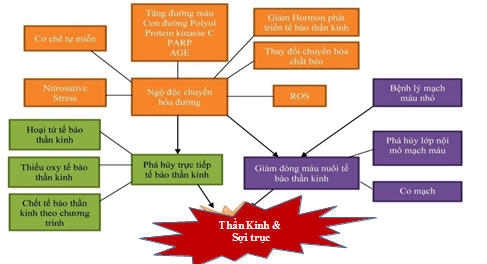
Biểu đồ 1. Tổng quan cơ chế bệnh sinh sự chết tế bào não
Sự phá hủy cấu trúc tế bào thần kinh xảy ra qua 3 quá trình: (1): rối loạn chuyển hóa; (2): cơ chế mạch máu làm giảm tưới máu mô; (3) cơ chế miễn dịch
1.1. Cơ chế rối loạn chuyển hóa và đáp ứng viêm hệ thống
Tế bào thần kinh không dự trữ oxygen, nó được cung cấp năng lượng qua các hoạt động chuyến hóa mô xảy ra ngay trong tế bào thần kinh qua hệ thống ty thể tại nguyên sinh chất. Não chiếm 2% trọng lượng cơ thể người trưởng thành nhưng cần đến 15% năng lượng toàn bộ cơ thể hàng ngày cung cấp để hoạt động bình thường, nguồn năng lượng này nhiều hơn bất cứ cơ quan nào khác trong cơ thể kể cả cơ bắp. Quá trình tiêu thụ năng lượng cao nhất trong hoạt động tinh thần và kích thích giác quan kể cả khi giấc ngủ hoạt động cung cấp năng lượng vẫn tiếp diễn. Hầu hết
năng lượng này dùng để duy trì trạng thái nghỉ của tế bào thần kinh và khôi phục lại nồng độ ion sau khi truyền qua synap [9].
1.1.1 Tăng glucose máu và các sản phẩm đường hóa bậc cao
Tăng glucose máu làm gia tăng sản xuất các sản phẩm đường hóa bậc cao AGEs, các rối loạn qua con đường polyol, gia tăng hoạt hóa protein kinase C, PARP và chuyển hóa glucose theo con đường hexosamine ở bệnh nhân đái tháo đường đã đẩy nhanh tiến trình phá hủy cấu trúc tế bào, tăng tính thấm thành mạch, rối loạn chức năng nội mô mạch máu và tăng đông máu [1], [14].
Bình thường quá trình trao đổi chất và lão hóa tự nhiên sản xuất các sản phẩm đường hóa bậc cao (AGEs) từ protein chuyển hóa chậm. Các thụ thể của AGEs có nhiều tế bào trong cơ thể (nội mô mạch máu, gan, phổi, thận và mạch máu ngoại vi), AGEs kích hoạt đáp ứng viêm và tiết các cytokine như IL6, Il12, TNFα và gia tăng quá trình oxy hoá tại tế bào đích. Tăng glucose máu kéo dài trong bệnh ĐTĐ type 2 làm gia tăng sản xuất AGEs vượt quá mức bình thường và stress oxy hóa, giảm tín hiệu insulin tại tế bào thần kinh, gia tăng quá trình glycosylated các amyloid β và phosphoryl hóa protein tau, gây ngộ độc và phá hủy tế bào thần kinh và ảnh hưởng đến chức năng nhận thức [5], [8], [11], [17].
1.1.2 Đáp ứng viêm, stress oxy hóa và vai trò trí nhớ miễn dịch ở bệnh nhân ĐTĐ
Phản ứng viêm là một hiện tượng phổ biến mặc dù không phải duy nhất của sinh lý bệnh ĐTĐ type 2 và RLTKNT.
Viêm cũng xảy ra trong bối cảnh của sự lão hóa tự nhiên, nhưng phản ứng này tăng lên được xem là nền tảng cho các bệnh thoái hóa mạn tính như bệnh Alzheimer và các loại RLTKNT khác, cũng như trong các bối cảnh như viêm khớp, đau xơ cơ, xơ vữa động mạch và đột quỵ. Các phản ứng từ các tế bào miễn dịch được kích hoạt sẽ giải phóng các cytokine tiền viêm như TNF-α, Interleukin-6. Đặc biệt các mô mỡ ở vùng bụng cũng tham gia vào đáp ứng viêm và tăng phóng thích các cytokine tiền viêm ở bệnh nhân ĐTĐ type 2 [15]
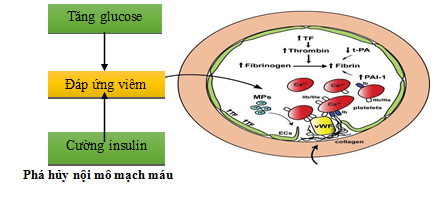
Hình 1.1. Tổn thương nội mạc mạch máu do quá trình viêm dưới tác động của tình trạng cường insulin và tăng glucose máu [5]
Viêm được cho là đóng vai trò quan trọng trong RLTKNT thông qua các tác động trực tiếp vào tế bào não (cytokine có thể vượt qua hàng rào máu não) và/ hoặc đẩy nhanh các tổn thương lên hệ thống mạch máu như: rối loạn lớp nội mô mạch máu, gây tăng đông và cuối cùng là tắc nghẽn mạch máu do tình trạng co cứng mạch và tổn thương xơ vữa.. Ở bệnh nhân ĐTĐ type 2, có mối tương quan nghịch giữa nồng độ cao của các cytokine tiền viêm với mức điểm số thấp về nhận thức thần kinh, chức năng điều hành và trí nhớ ảnh hưởng nhiều nhất [5].
Quá trình viêm và tres oxy hóa không chỉ ảnh hưởng trực tiếp lên hệ thống thần kinh mà còn kích thích một chuỗi trí nhớ miễn dịch gây các phá hủy tế bào qua trung gian tế bào lympho TCD4 và tế bào diệt tự nhiên. Phản ứng thực bào trung tâm (central adipocity) cũng liên quan đến giảm thể tích vùng đồi thị và tăng nguy cơ RLTKNT ở bệnh nhân ĐTĐ lớn tuổi, ngay cả khi nồng độ cytokine tiền viêm TNF-α thấp (vì tình trạng đa hình của gen TNF-α đã làm giảm nồng độ chất này) [5], [15].
1.1.3 Cường insulin và rối loạn tín hiệu insulin trong nhu mô não
Thụ thể insulin có nhiều ở vùng não chiến lược về nhận thức (vùng đồi thị, hạch đáy, vỏ não, hạch hạnh nhân, hồi hải mã), và kích hoạt các con đường gia tăng tín hiệu insulin là cần thiết cho chức năng nhận thức não bộ. Bất thường tín hiệu insulin và giảm độ nhạy của thụ thể tiếp nhận insulin ở tế bào thần kinh đuôi gai trong bệnh Alzheimer ảnh hưởng rất nhiều đến trí nhớ và teo hồi hải mã, đã đưa đến giả thuyết rối loạn chức năng trao đổi chất ảnh hưởng đến chức năng của thụ thể insulin. Tín hiệu insulin giúp tăng cường trí nhớ và giúp cho các khớp nối thần kinh dẻo dai hơn ở hồi hải mã. Insulin cũng điều chỉnh nồng độ của một số chất dẫn truyền thần kinh có vai trò trong việc hình thành trí nhớ chẳng hạn như acetylcholin, norepinephrine và epinephrine và thúc đẩy sự tích tụ thụ thể GABA trên màng tế bào. Vi vậy, tín hiệu insulin có vai trò quan trọng trong duy trì chức năng thần kinh nhận thức, liên quan đến thụ thể tiếp nhận insulin hơn là nồng độ insuslin máu. Do đó việc điều trị insulin không ngăn ngừa tiến trình suy giảm chức năng TKNT.
Cụ thể hơn, sự hấp thu của insulin qua hàng rào máu não giảm trong khi đối mặt với insulin ở ngoại vi tăng là điều dễ nhận thấy ở bệnh nhân đái tháo đường tpye 2. Điều này tạo ra một trạng thái giảm insulin não, mà kết quả của quá trình này làm giảm men phân hủy insulin và giảm men phân hủy amyloid-β. Tiến trình này kéo dài làm tích tụ amyloid-β trong não, góp phần lắng đọng và sự hình thành mảng bám amyloid-β. Giảm tín hiệu insulin não cũng ức chế các enzym tham gia trong chuỗi phosphoryl hóa protein tau, mà cuối cùng góp phần vào sự hình thành của các đám rối xơ hóa tế bào thần kinh [20],[3], [5],[15], [21].
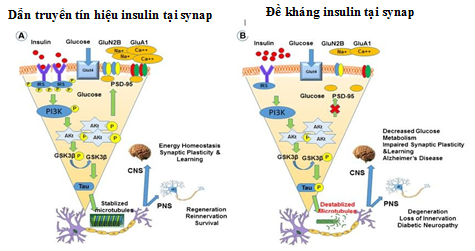
Hình 1.3. Đề kháng insulin và suy giảm tín hiệu insulin tại màng synap [16]
Hình 1.3 cho thấy tín hiệu insulin ở tế bào thần kinh của người bình thường (A) và người ĐTĐ (B). trong điều kiện sinh lý bình thường insulin liên kết với các thụ thể IRS tại các khớp thần kinh và kích hoạt quá trình phosphoryl hóa tế bào, từ đó kích hoạt phosphoionsitide 3- kinase (PI3K), phosphoryl hóa GluTA1 và GluN2B tại các khớp synapses thần kinh. Trong não đối tượng ĐTĐ, tình trạng kháng insulin làm giảm tín hiệu insulin nội bào do insulin không kết nối với các thụ thể tại màng sau synap thần kinh. Điều này dẫn đến tình trạng giảm quá trình phosphoryl hóa GluN2B và GluA1 hệ quả là làm giảm tính dẻo thần kinh và ảnh hưởng đến trí nhớ.
Tình trạng đề kháng insulin và giảm tín hiệu insulin dẫn đến giảm giải phóng glutamate ở hồi hãi mã là cơ chế quan trọng trong bệnh sinh Alzheimer. Giảm hoạt động thụ thể insulin đã tạo nhiều sản phẩm như ceton gây ảnh hưởng đến quá trình lưu trữ và tiếp nhận thông tin tại hồi hãi mã. Vì vậy, rối loạn nồng độ insulin não và giảm tín hiệu insulin não ở những người có bệnh ĐTĐ type 2 góp phần vào RLTKNT [10], [11], [21].
Cholerton Brenna và cộng sự (2016) và Manuel Rodriguez Perdigon và cộng sự (2016) cho thấy tình trạng đề kháng insulin đã thúc đẩy quá trình tạo các mảng bám amyloid β và tăng phosphoryl hóa protein tau có liên quan đến sự phát triển Alzheimer [7], [13].
Nghiên cứu Bell GA (2017) đã kích thích thụ thể insulin bằng cách tiêm trực tiếp insulin vào đồi thị đã cải thiện khả năng học tập của các con chuột bình thường. Mark DR (2009) nghiên cứu trên con chuột bị ĐTĐ thì hiệu quả kém hơn. Hay RLTKNT không chỉ có mỗi cơ chế giảm tín hiệu dẫn truyền của insulin qua thụ thể. Biessels và cộng sự (2005) đã nghiên cứu cách điều trị tăng độ nhạy của thụ thể insulin tại não ở cho thấy nồng độ amyloid β và phosphoryl hóa protein tau cũng đã giảm ở các con chuột mắc bệnh Alzheimer [Error! Reference source not found.].
Tóm lại, cường insulin, kháng insulin, suy giảm tín hiệu dẫn truyền của thụ thể insulin ở màng synap đã thúc đẩy RLTKNT đặc biệt là bệnh Alzheimer [5], [10], [22]. Hiện nay các sản phẩm như acid α lipoic có vai trò quan trong trong việc điều trị đề kháng insulin và tăng axit béo, làm gia tăng thụ thể GluA1, GluN2B có ý nghĩa trong điều trị bệnh lý Alzheimer [13].
Cơ chế mạch máu và rối loạn tưới máu mô
Cơ chế mạch máu tham gia vào quá trình phá hủy tế bào thần kinh này được biết đến sau hàng loạt các rối loạn chuyển hóa ảnh hưởng đến bệnh lý mạch máu nhỏ, rối loạn nội mô mạch máu gây phá hủy cấu trúc mạch máu, rối loạn sự đàn hồi thành mạch và tình trạng co mạch hệ quả làm giảm sự lưu thông dòng tưới máu não. Tăng glucose máu gây giảm các chất giãn mạch nitric oxide (NO) và tăng các chất co mạch endothelin-1 làm giảm sự giãn nở của các mạch máu. Theo thời gian, hiện tượng này làm thay đổi cấu trúc trong thành mạch mà kết quả là sự hình thành mảng xơ vữa động mạch [8].
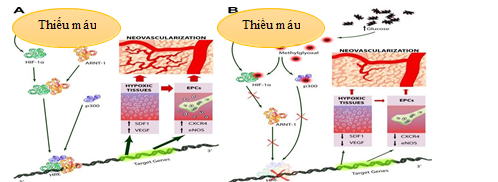
Hình 1.3. Sự khác nhau trong cơ chế tạo ra trường tái tưới máu mô não ở đối tượng đái tháo đường và người bình thường [8]
Theo Ferdinando Giacco (2010), ghi nhận vai trò của phân từ ARNT-1 và P300 như một coenzym trong quá trình kết hợp với tín hiệu HIF-1a khi có tình trạng thiếu máu mô xảy ra và kích hoạt chuỗi phản ứng của gen hoạt hóa phân tử EPCs có vai trò kích thích tạo ra trường tái tưới máu nuôi khi có sự tắc nghẽn xảy ra [8].
Tuy nhiên, chính nồng độ glucose máu tăng ở bệnh nhân ĐTĐ đã kích hoạt tạo ra các phân tử methylglyoxal ức chế hoạt động các coenzyme ARNT-1 và P300 và không kích thích được tủy xương giải phóng các yếu tố EPCs [4], [8].
Trong giai đoạn đầu của bệnh, tăng glucose máu kéo dài gây giảm nồng độ nitric oxide (NO), một chất giãn mạch phụ thuộc nội mô mạch máu và tăng nồng độ của endothelin-1 một chất gây co mạch. Điều này dẫn đến giảm khả năng giãn mạch máu để thích ứng với nhu cầu gia tăng lưu lượng máu cho não bộ. Trong giai đoạn sau của bệnh, với nồng độ các endothelin-1 tăng cao và giảm nồng độ NO mãn tính làm giảm độ đàn hồi mạch máu và thay đổi cấu trúc trong thành mạch mà kết quả là sự hình thành mảng xơ vữa động mạch.
Nghiên cứu khám nghiệm tử thi các bệnh nhân bị bệnh ĐTĐ type 1 hoặc type 2 phụ thuộc insulin đã cho thấy những thay đổi liên quan đến bệnh lý mạch máu não bao gồm thoái hóa não lan tỏa, giả vôi hóa, hủy myelin lan tỏa của dây thần kinh sọ não, tủy sống và xơ hóa thần kinh. Dày lớp đáy mao mạch màng tế bào, các dấu hiệu của tổn thương vi mạch ĐTĐ cũng được tìm thấy trong não của bệnh nhân ĐTĐ.
Các tác giả cũng ghi nhận tỷ lệ tưới máu não giảm rõ rệt đo được khi sử dụng chất phóng xạ xenon và mức độ giảm tương quan với thời gian mắc bệnh ĐTĐ. Tỷ lệ tưới máu não ở những bệnh nhân mắc bệnh ĐTĐ cũng tương tự trong bệnh Alzheimer với RLTKNT [12]. Thật vậy, người lớn bị bệnh ĐTĐ cho thấy giảm lưu lượng máu não ở cả hai bán cầu, đặc biệt là ở các vùng trán và giảm sự giãn nở mạch máu sau các đáp ứng với các kích thích giãn mạch (như cho hít CO2) [12]
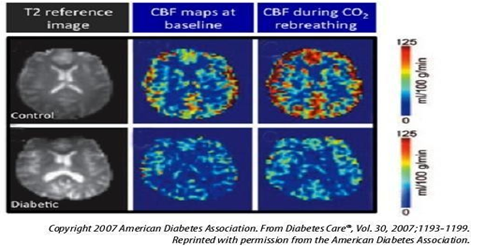
Hình 1.4. Mối liên quan giữa ĐTĐ type 2 với giảm lưu lượng máu não (CBF) khi nghỉ ngơi và sau khi gây kích thích giãn mạch bằng hít CO2 [12]
Việc giảm lưu lượng máu não, cùng với sự kích thích của các thụ thể thromboxane A2 xảy ra trên bệnh nhân ĐTĐ, gây đáp ứng co mạch và làm tăng thiếu máu cục bộ trên não. Tác động song hành của thiếu máu cục bộ và tăng glucose máu có thể gây tổn thương cấu trúc não, gây tích lũy lactate, nhiễm toan, tình trạng này kéo dài sẽ ảnh hưởng ra nhiều khu vực kế cận trong nhu mô não [5].
Một cơ chế khác là sự tích lũy của glutamate trong sự kết hợp của tăng glucose máu và thiếu máu cục bộ. Glutamate là một amino acide kích thích chất dẫn truyền thần kinh đã được chứng minh là gây tổn thương tế bào thần kinh trong não [5].
Theo Jeremy J. Pruzin và cộng sự (2018), chứng minh ĐTĐ type 2 thường dẫn đến RLTKNT mạch máu và Alzheimer do tổn thương teo não và vi mạch máu não: thoái hóa chất trắng, nhồi máu não đa ổ, nhồi máu não vùng chiến lược… sự hình thành mảng bám amyloid β và các chuỗi protein tau trong tế bào sợi trục dưới tác động của các rối loạn chuyển hóa glucose, đề kháng insulin, gia tăng cytokin tiền viêm và stress oxy hóa gây phá hủy hàng rào máu não và thoái hóa tế bào thần kinh [10].
Cơ chế tổn thương cấu trúc tế bào thần kinh
Cơ chế tổn thương cấu trúc tế bào thần kinh cũng được biết đến qua các thay đổi như thiếu oxy mô não, hoại tử tế bào thần kinh và chết tế bào theo chương trình tác động trực tiếp làm hủy tế bào thần kinh. Quá trình phân hủy ATP trong não là nguồn cung cấp năng lượng quan trọng cho tế bào thần kinh và tế bào đệm thần kinh. Do đó bộ não như một pin hoá học của ATP phải được sạc lại liên tục. Não không có kho dự trữ năng lượng trừ tế bào hình sao có lượng nhỏ glycogen, không có nguồn năng lượng dự phòng như creatine phosphat. Phần lớn ATP được cung cấp nhờ quá trình phosphoryl hóa glucose qua các kênh vận chuyển nằm ở chân tế bào hình sao quanh mạng lưới mao mạch não. Axit béo cũng tham gia vào quá trình chuyển hóa tạo ra cetone cung cấp năng lượng cho tế bào. Quá trình chuyển hóa kỵ khí glycolysis của glycogen cũng cung cấp năng lượng cho tế bào não nhưng không đáng kể.
1.1.4 Rối loạn chức năng ty thể ở tế bào thần kinh
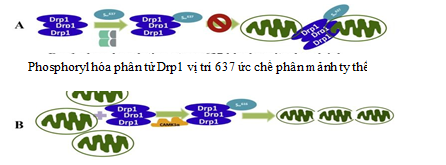
Ty thể trong tế bào thần kinh tạo thành một mạng lưới hoạt động diễn ra thường xuyên quá trình phân chia và tổng hợp để cung cấp năng lượng cho các hoạt động tế bào thần kinh. Sự hoạt động của ty thể liên quan đến nguyên phân và giảm phân có sự tham gia của một số protein trong đó có phân tử Drp1.
Rối loạn hoạt động phân tử Drp1 có liên quan trực tiếp đến bệnh lý ty thể. Sự phosphoryl hóa Drp1 gây ra bởi GK3β và ức chế sự phân chia ty thể, gây ra sự chết do theo chương trình trong bệnh lý Alzheimer [20].
Các nghiên cứu gần đây cũng đã chứng minh được vai trò của các chất ức chế GSK3β trong điều trị bệnh lý Alzheimer có liên quan đến vai trò hai phân tử microARN 30 và microARN 499 trong việc duy trì hoạt động tế bào thần kinh. Tác động trực tiếp của hai phân tử này lên quá trình phosphoryl hóa Drp1 và từ đó ngăn chặn được phân mảnh ty thể, cung cấp đầy đủ năng lượng cho tế bào thần kinh hoạt động. Tuy nhiên, nếu quá trình stress oxy hóa tiếp tục diễn ra thì con đường chuyển hóa này vẫn bị ức chế khiến tế bào thần kinh hình sao và sợi trục bị phá vỡ do thiếu năng lượng [18], [19].
Yan và cộng sự (2015) đã nghiên cứu vai trò GSK3β trong quá trình phosphoryl hóa Drp1 làm tăng quán trình phân mảnh ty thể và gia tăng mảng bám các chuỗi amyloid β. Phân tử TAT-Drp1-SpS có vai trò ức chế hoạt động của phân tử GSK3β và do đó có tác dụng điều trị bệnh Alzheimer [5], [18], [20].
1.1.5 Rối loạn chuyển hóa glutamate:
Cơ chế bệnh sinh qua các rối loạn chuyển hóa glutamate, sự hình thành mảng bám amyloid β, rối loạn hoạt động thụ thể bề mặt các cúc synap thần kinh là NMDARs và AMPARs cũng như rối loạn chuyển hóa qua các kênh Ca++ chất truyền tin thứ hai tại lưới nội bào và gia tăng quá trình phosphoryl hóa GSK3β. Tất cả các quá trình này được hoạt hóa bởi quá trình viêm và stress oxy hóa. Hệ quả là các tế bào hình sao và các tế bào sợi trục bị thay đổi cấu trúc và chết tế bào theo chương trình, ảnh hưởng đến chức năng thần kinh nhận thức [6]. Chính sự tham gia của phân tử NLRP3 đã kích hoạt quá trình viêm trong bệnh lý Alzheimer, Parkinson và RLTKNT khác, sau khi ghi nhận sự tồn tại phân tử này rất nhiều trong tế bào thần kinh tại đồi thị [18], [19],
[Error! Reference source not found.]. Tiến trình thoái hóa não được chặn đứng qua một thử nghiệm thành công ở động vật thí nghiệm bởi phân tử MCC950, một phân tử ức chế hoạt động NLRP3 [18], [19], [20].Rối loạn chuyển hóa không chỉ ảnh hưởng trực tiếp lên hệ thống thần kinh mà còn kích thích một chuỗi trí nhớ miễn dịch gây các rối loạn phá hủy tế bào qua cơ chế đáp ứng tự miễn qua trung gian tế bào lympho T CD4 và tế bào diệt tự nhiên.
Các con đường chuyển hóa cũng góp phần làm thương tổn hệ thống mạch máu nuối tế bào thần kinh, đặc biệt là hệ thống mạch máu nhỏ, quá trình phản ứng viêm qua trung gian TNF a, IL6, IL12…rối loạn lớp nội mô mạch máu, gây nguy cơ tăng đông và cuối cùng là tắc nghẽn mạch máu do tình trạng co cứng mạch và tổn thương xơ vữa.
Theo Yadong Zhai và cộng sự (2018), đái tháo đường là yeus tố nguy cơ độc lập của bệnh não đái tháo đường, đay là một biến chứng của đái tháo đường mà đặc trung là sự suy giảm chức năng thần kinh nhận thức và phá hủy cấu trúc tế bào não.
Cơ chế bệnh sinh là sự cộng gộp các rối loạn và chức năng mạch máu, rối loạn chuyển hóa đường, thiếu hụt insulin và quá trình viêm… tác giả cũng chứng minh phan tử IL-1β tham gia vào tiến trình viêm mạn tính ở bênh nhân đái tháo đường.
Chính sự tham gia của phân tử NLRP3 đã kích hoạt quá trình viêm trong bệnh lý Alzheimer, Parkinson và sa sút trí tuệ khác sau khi ghi nhận sự tồn tại phân tử này rất nhiều trong tế bào thần kinh tại đồi thị. Và nếu ức chế được phân tử NLRP3 sẽ chặn đứng được tiến trình thoái hóa não trên một thử nghiệm thành công ở động vật thí nghiệm qua phân tử MCC950, một phân tử ức chế hoạt động NLRP3
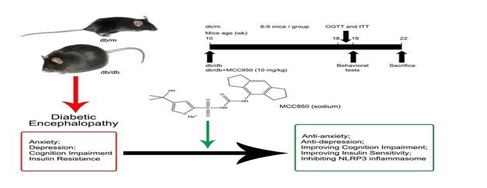
Hình 1.6. Sơ đồ thử nghiệm phân tử MCC950 ức chế hoạt động viêm của NLRP3 trên chuột thí nghiệm
Theo Jeremy J. Pruzin và cộng sự (2018), đề cập đến mối tương quan giữa ĐTĐ type 2 với suy giảm thần kinh nhận thức và chứng minh bệnh lý mạch máu nhỏ và các tổn thương mạch máu nói chung. Đái tháo đường type 2 thường dẫn đến sa sút trí tuệ mạch máu và Alzheimer do hình thành các nhồi máu não đa ổ, nhồi máu não vùng chiến lược… Rối loạn chuyển hóa glucose, cường insulin máu đã góp phần rối loạn dòng protein qua hàng rào máu não, rối loạn hệ thống bạch huyết trong não và trong tế bào thần kinh đệm là những cơ chế quan trọng trong hình thành mảng bám amyloid β và các chuỗi protein tau trong tế bào sợi trục của bệnh Alzheimer.
Như vậy với ba cơ chế tuy khác nhau nhưng có tác động cộng gộp và đẩy nhanh các tiến trình phá hủy cấu trúc tế bào thần kinh. Sự chết tế bào theo chương trình có thể là dấu chấm hết cho sự phục hồi tế bào não khi quá trình thoái hóa bắt đầu lan rộng.
3.ĐÁNH GIÁ SA SÚT TRÍ TUỆ QUA HÌNH ẢNH HỌC CỘNG HƯỞNG TỪ
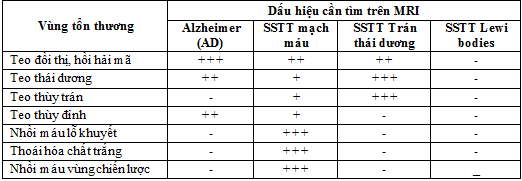
Bảng 1. Các dấu hiệu sa sút trí tuệ cần tìm trên MRI
Bảng 2. Các tiêu chí quan trọng đánh giá sa sút trí tuệ
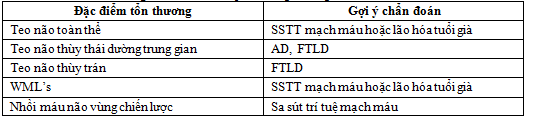
Tiêu chí quan trong trong đánh giá sa sút trí tuệ theo các tiêu chuẩn sau:
- Bệnh Alzheimer: teo thùy thái dương trung gian và teo thùy đỉnh.
- Thoái hóa thùy trán thái dương (Frontotemporal Lobar: FTLD): teo thùy trán và teo thùy thái dương không đối xứng.
- Sa sút trí tuệ mạch máu: teo toàn bộ não, tổn thương chất trắng lan tỏa, nhồi máu não vùng chiến lược có liên quan đến chức năng nhận thức, nhồi máu não lỗ khuyết.
- Sa sút trí tuệ thể Lewy bodies (DLB): trái với các thể sa sút trí tuệ khác thường không có bất thường cụ thể.
Vì vậy, khi nghiên cứu về hình ành học cộng hưởng từ sọ não, bác sĩ cần ghi các điểm số một cách có hệ thống như trên bảng 4 đối với các tổn thương như: teo não toàn bộ, teo não khu trú và bệnh mạch máu (nhồi máu não, nhồi máu não lỗ khuyết, nhồi máu não vùng chiến lược).
Các thang điểm tiêu chuẩn để đánh giá các rối loạn nhận thức trên MRI bao gồm các bước sau:
- Thang điểm GCA đánh giá teo não toàn bộ
- Thang điểm MTA đánh giá theo thùy trán thái dương
- Thang điểm Kodeam đánh giá teo thùy đỉnh
- Thang điểm Fazekas đánh giá tổn thương não chất trắng
- Tìm kiếm các nhồi máu não vùng chiến lược
Tìm hiểu về các thang điểm đánh giá tổn thương não
Thang điểm GCA
Thang đo GCA là điểm trung bình đánh giá teo vỏ não như sau:
0: Không teo vỏ não
1: Teo nhẹ: mở vùng sulci
- Teo vừa: mất thể tích của gyri
- Teo nặng (giai đoạn cuối): teo lưỡi dao Teo vùng võ não được đánh giá tốt nhất trên thì
FLAIR: trong một số rối loạn thoái hóa thần kinh, teo không đối xứng và xảy ra ở các vùng cụ thể.
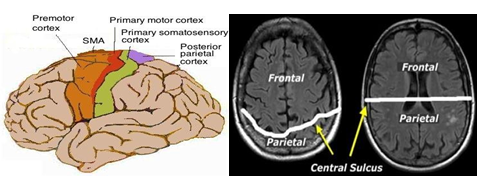
Hình 3.1. Rãnh trung tâm phân định ranh giới các vùng vận động thùy trán và chẩm
Khi đánh giá các vùng teo não việc quan sát rãnh trung tâm có ý nghĩa quan trong để phân vùng tổn thương.
Thang điểm MTA đánh giá theo thùy trán thái dương
Thang điểm MTA nên được khảo sát trên mặt phẳng coronal ở thì T1W. Trên một nghiên cứu 222 đối tượng bằng thang điểm thị giác không gian nhóm bệnh và nhóm chứng bị sa sút trí tuệ để đánh giá teo thùy thái dương cho thấy độ nhạy và độ đặc hiệu 85%, có thể đạt được tỷ lệ cao hơn ở bệnh nhân Alzheimer. Điểm số được đánh giá trực quan về chiều rộng của vùng choroid fissure, chiều rộng của sừng thái dương và chiều cao của đồi thị.
>75 tuổi: nếu thang điểm MTA ≥ 3 là bất thường (điều đó nếu là 2 điểm ở độ tuổi này vẫn bình thường)
< 75 tuổi: nếu MTA ≥ 2 là bất thường
Bảng 3. Thang điểm MTA trong đánh giá tổn thương não
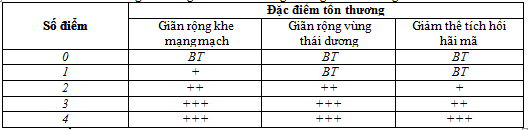 Thang điểm MTA được phân độ qua hình ảnh như sau:
Thang điểm MTA được phân độ qua hình ảnh như sau:
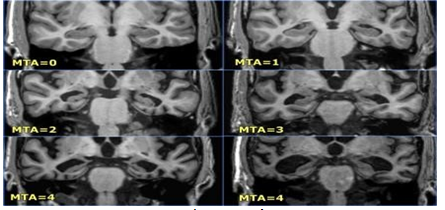 Hình 3.2. Phân độ teo não bằng thang điểm MTA trên MRI sọ não
Hình 3.2. Phân độ teo não bằng thang điểm MTA trên MRI sọ não
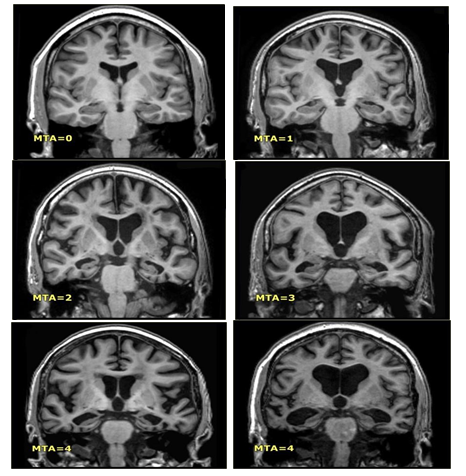
Hình 3.3. Phân độ các tổn thương teo não theo MTA
Thang điểm MTA được phân độ như sau:
điểm: không teo não
1 điểm: chỉ giãn rộng vết nứt choroid fissure
2 điểm: giãn sừng thái dương của não thất bên
3 điểm: giảm thể tích vùng đồi thị mức độ trung bình
4 điểm: giảm thể tích vùng hồi hải mã mức độ nặng
Bảng 4. Độ nhạy và đặc hiệu của MTA trong chẩn đoán Alzheimer và các thể SSTT khác
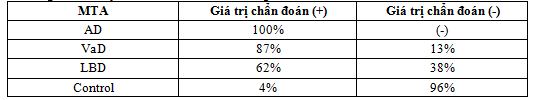 Thang điểm MTA có độ nhạy cao trong chẩn đoán Alzheimer và đại đa số bệnh nhân mắc Alzheimer đều có MTA (+), ngược lại MTA (+) hầu như không có ở nhóm chứng. Tuy nhiên, MTA (+) còn xuất hiện trong các dạng sa sút trí tuệ khác như sa sút trí tuệ mạch máu (87%), sa sút trí tuệ thể Lewy body 62%. Nếu bệnh nhân bị suy giảm thần kinh nhận thức nhẹ thì MTA có thể chẩn đoán (-), rất có thể bệnh nhân phát triển thành Alzheimer độ nhạy cao mang lai giá trị chẩn đoán (-) cao. Nếu nghi ngờ bệnh lý Alzheimer, thang điểm MTA giúp đánh giá có teo thùy thái dương hay không.
Thang điểm MTA có độ nhạy cao trong chẩn đoán Alzheimer và đại đa số bệnh nhân mắc Alzheimer đều có MTA (+), ngược lại MTA (+) hầu như không có ở nhóm chứng. Tuy nhiên, MTA (+) còn xuất hiện trong các dạng sa sút trí tuệ khác như sa sút trí tuệ mạch máu (87%), sa sút trí tuệ thể Lewy body 62%. Nếu bệnh nhân bị suy giảm thần kinh nhận thức nhẹ thì MTA có thể chẩn đoán (-), rất có thể bệnh nhân phát triển thành Alzheimer độ nhạy cao mang lai giá trị chẩn đoán (-) cao. Nếu nghi ngờ bệnh lý Alzheimer, thang điểm MTA giúp đánh giá có teo thùy thái dương hay không.
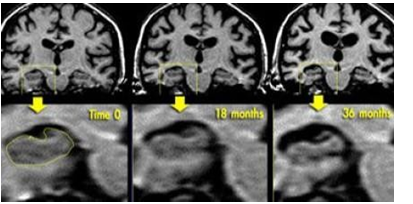
Hình 3.6. Tiến trình teo não trên bệnh nhân mắc Alzheimer được theo dõi trong 3 năm
Đánh giá tiến trình teo não ở một bệnh nhân có nguy cơ mắc Alzheimer có tính gia đình, cho thấy sự tiến triển của bệnh. Khảo sát SPECT hoặc PET để đánh giá thay đổi trong tưới máu và chuyển hóa của vùng vỏ não thùy thái dương vì những thay đổi này diễn ra trước sự phát triển của teo não.
3.1.1Thang điểm Koedam trong đánh giá teo não vùng đỉnh
Ngoài teo thùy thái dương, teo thùy đính cũng có giá trị dự đoán cao bệnh lý Alzheimer.
Vùng precuneus là một phần của thùy đỉnh, nó liên quan đến trí nhớ, trực giác của bản và các khía cạnh của ý thức. Khi teo vùng Precuneus này thường là chỉ điểm đặc trung cho bệnh Alzheimer. Tổn thương vùng này rất hay gặp ở người trẻ mắc Alzheimer (hoặc tiền Alzheimer) ngay cả thang điểm MTA có thể bình thường. Thang điểm Koedamcos thể đánh giá trên các mặt phẳng coronal, sagital, axial đánh giá được tình trạng teo não vùng đỉnh chẩm tương tự như teo não vùng đỉnh.
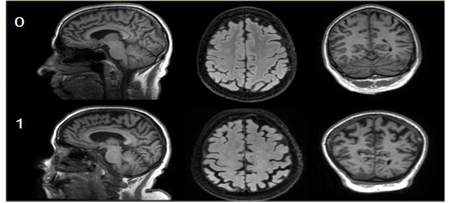
Hình 3.7. Phân độ 0-1 theo thang điểm Koedam
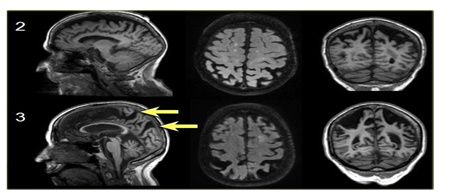
Hình 3.8. Phân độ 2-3 theo thang điểm Koedam
Các mũi tên màu vàng chỉ sự giãn rộng rất lớn vùng đỉnh- chẩm. Teo não cấp độ 3 theo Koedam.
CÁC TỔN THƯƠNG ĐIỂN HÌNH CỦA CÁC NHÓM SA SÚT TRÍ TUỆ
4.1 Suy giảm thần kinh nhân thức mức độ nhẹ: MCI: Mig Cognitive Impairment
Thang điểm MTA đánh giá sớm các tổn thương vùng thái dương có ý nghĩa quan trọng và được khuyến cáo trong tầm soát các rối loạn suy giảm thần kinh nhận thức nhẹ. Những đối tượng có rối loạn về bộ nhớ nhưng những vùng chức năng khác có thể bình thường. Các đối tượng thuộc nhóm này có thể ở trong giai đoạn tiền Alzheimer hoặc các rối loạn thần kinh nhận thức khác giai đoạn sớm.
Alzheimer
Bệnh Alzheimer chiếm tỷ lệ 50-70% các trường hợp sa sút trí tuệ ở người lớn tuổi. Độ tuổi có liên quan nhiều đến tiền trình bệnh Alzheimer, khoảng 8% ở người > 65 tuổi và 30% ở những người trên 85 tuổi. Sự phát triển bệnh Alzheimer từ từ và thường sống trung bình 10 năm sau khi có triệu chứng. Với tỷ lệ người cao tuổi ngày càng tăng, dự đoán số người mắc bệnh Alzheimer dự kiến tăng gấp 3 lần trong 50 năm tới.
Theo tiến trình sự teo não lan rộng xuất hiện trong giai đoạn cuối của bệnh Alzheimer và các thể sa sút trí tuệ khác. Do đó việc chẩn đoán sớm có giá trị quan trọng trong việc quản lý bệnh nhân sa sút trí tuệ tiến đến giai đoạn nặng và phụ thuộc. Việc chẩn đoán Alzheimer trong giai đoạn sớm tập trung vào vùng thái dương và đồi thị đây là hai khu vực AD bắt đầu. Vai trò MRI sọ não có hai ý nghĩa như sau:
+ Loại trừ các nguyên nhân khác gây suy giảm thần kinh nhận thức
+ Xác định AD khởi phát sớm để có thể tư vấn chăm sóc và điều tị tích cực
Một ví dụ về Alzheimer giai đoạn cuối:
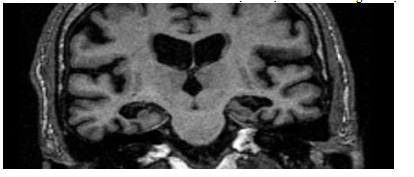
Hình 3.9. Tổn thương não phù hợp với chẩn đoán Alzheimer
Trên hình ảnh này cho thấy sự teo nặng hồi hải mã và thùy thái dương MTA =4. Teo não toàn bộ GCA =3. Tuy nhiên, hình ảnh này không phải là đặc hiệu cho bệnh Alzheimer vì thang điểm GCA nặng cũng thấy ở tổn thương sa sút trí tuệ giai đoạn cuối khác.
Một ví dụ khác về tiền Alzheimer:
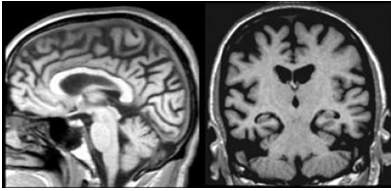
Hình 3.10. Tổn thương dạng tiền Alzheimer
Hình ảnh trên cho thấy hồi hải mã bình thường nhưng đã có dấu hiệu teo thùy đỉnh nặng với hai khu vực là posterior cingulum và precuneus.
Sa sút trí tuệ mạch máu (VaD: Vascular dementia)
Sa sút trí tuệ mạch máu là nguyên nhân sa sút trí tuệ xếp hàng thứ 2 sau bệnh Alzheimer. Đôi khi có thể phân biệt được Alzheimer bởi sự khởi phát đột ngột và liên quan đến các yếu tố nguy cơ mạch máu.
Những kiểu tổn thương hay gặp là bệnh lý mạch máu nhỏ, các rối loạn kiểu này không thay đổi nhiều chức năng vận động nhưng làm thay đổi nhanh chóng chức năng nhận thực của bệnh nhân.
Những tổn thương mạch máu máu lớn như đột quỵ nhồi máu não, xuất huyết não sẽ ảnh hưởng tức thì đến chức năng vận động cảm giác nhưng cũng thay đổi từng bước các chức năng năng thần kinh nhận thức khác.
Các nghiên cứu gần đây chứng minh vai trò kiểm soát các yếu tố nguy cơ mạch máu như: thuốc lá, đường máu, huyết áp, mỡ máu có ý nghĩa ngăn chặn tiến trình nặng lên của sa sút trí tuệ mạch máu. Tuy nhiên thuốc ức chế men cholinesterase cho thấy sự cải thiện sa sút trí tuệ mạch máu.
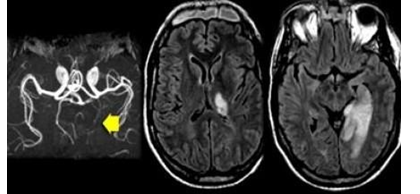
Hình 3.11. Hình ảnh tổn thương cho thấy nhồi máu chiến lược vùng cấp máu động mạch não sau liên quan đến hồi hải mã. Loại nhồi máu này có thể dẫm đến chứng sa sút trí tuệ đột ngột nếu nằm ở bán cầu ưu thế và không xảy ra chứng mất trí nhớ nếu xảy ra ở bán cầu không ưu thế
Hầu hết các bệnh nhân bị sa sút trí tuệ mạch máu đều có tổn thương bệnh não chất trắng lan tỏa với các tổn thương dạng dãi và Fazekas 3 điểm trở lên.
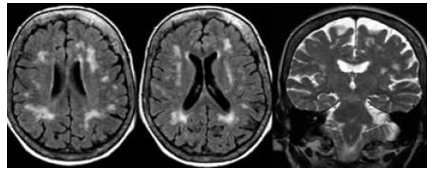
Hình 3.12. Sa sút trí tuệ mạch máu nhưng thùy thái dương bình thường.
Tổn thương sa sút trí tuệ mạch máu với tổn thương chất trắng lan tỏa dạng dãi dọc theo cạnh não thất (Fazekas 3 điểm). Ở một số bệnh nhân có tổn thương não chất trắng có thể có giãn thể tích não thất do teo não toàn bộ (GCA 3 điểm trở lên) và cũng bị teo thùy thái dương trung gian.
Một vài trường hợp thùy thái dương có thể thình thường nhưng đã có xuất hiện tổn thương chất trắng lan tỏa.
Rối loạn chức năng nhận thức trong VaD có thể là kết quả của:
+ Bệnh lý mạch máu lớn:
*Vùng cấp máu động mạch não trước hay các khu vực kết hợp: thái dương- đỉnh và thái dương chẩm của bán cầu ưu thế.
- Nhồi máu vùng cấp máu động mạch não
sau: vùng cạnh giữa hồi hải mã và phần dưới thùy thái dương của bán cầu não ưu thế.
- Nhồi máu ở động mạch chính của bán cầu não ưu thế: thùy trán và thùy đỉnh)
+ Bệnh lý mạch máu nhỏ:
*Nhiều ổ nhồi máu não lỗ khuyết trong chất trắng thùy trán (> 2 ổ nhồi máu) và hạch nền (> 2 ổ nhồi máu)
- Tổn thương não chất trắng ít hơn 25% của chất trắng toàn não
- Hai bên hồi hải mã
Gần đây người ta quan tâm và nghiên cứu nhiều về bệnh lý mạch máu nhỏ, nó được xem như là yếu tố dự báo của suy giảm thần kinh nhận thức và sa sút trí tuệ. Hơn nữa, nó còn làm tăng thêm tác động trong vòng xoắn cơ chế bệnh sinh của Alzheimer.
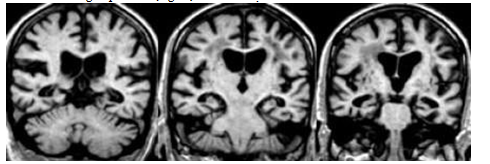
Hình 3.13. MTA ở bệnh nhân có sa sút trí tuệ mạch máu
Hình 17 ghi nhận những tổn thương chất trắng quanh não thất, ngoài ra bệnh nhân còn có MTA 3-4 điểm, khả năng bệnh nhân này vừa có VaD và AD, sự kết hợp hai loại tổn thương này thường gặp ở bệnh nhân cao tuổi.
Dù thế nào đi nữa, những tổn thương này nên được mô tả riêng để có hướng tiếp cận điều trị hiệu quả. Tuy nhiên, quá trình lão hóa tự nhiên cũng có theer ghi nhận tăng tín hiệu chất trắng và teo não nhưng không bị mất trí nhớ. Để khắc phục nhược điểm này, các nhà nghien cứu quốc tế về bệnh sa sút trí tuệ NINDS- AIREN đã xây dựng các tiêu chí cụ thể giúp chẩn đoán VaD và AD….
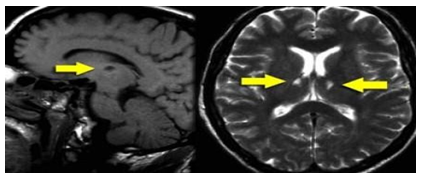
Hình 3.14. Nhồi máu lỗ khuyết hai bên vùng hồi hải mã
Các hạt nhân trung gian của hồi hải mã có vai trò quan trọng trong học tập và ghi nhớ. Tổn thương nhồi máy não lớn hay nhồi máu não lỗ khuyết hai bên quanh hồi hải mã đều có thể dẫn đến sa sút trí tuệ. Và do đó rất cần phải chú ý để tìm ra các nhồi máu nhỏ này.
Trên hình ảnh FLAIR có thể dễ dàng bỏ sót các tổn thương nhồi máu lỗ khuyết này vì đễ nhầm lẫn với các cấu trúc giải phẫu hiện diện ở đây. Do đó cần có thì T2WI có độ phân giải cao hơn để phát hiện các tổn thương vùng hồi hải mã.
Thì T1 kéo dài hoặc FLAIRcũng hạn chế đánh giá các tổn thương ở vùng dưới lều và tủy sống vì nó triệt tiêu tín hiệu của nước. Hiện tượng này cũng có thể bỏ sót bệnh đa xơ cứng rải rác ở vùng dưới lều và tủy sống.
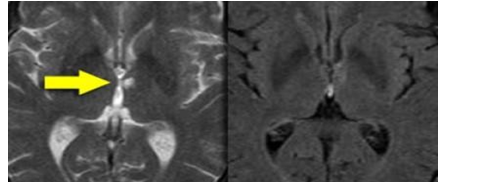
Hình 3.15. Thì FLAIR bỏ sót tổn thương nhồi máu lỗ khuyết vùng hồi hải mã
Thoái hóa thùy trán thái dương
Thoái hóa thùy trán thái dương trước đây gọi là bệnh PICK, là một bệnh lý sa sút trí tuệ tiến triển chiếm khoảng 5-10% các trường hợp sa sút trí tuệ và thường xảy ra ở đối tượng tiền mãn kinh.
FTLD đặc trưng trên lâm sàng với các rối loạn hành vi và ngôn ngữ có thể xảy ra trước hoặc trội hơn các rối loạn sa sút về trí nhớ. Không có điều trị đặc hiệu cho bệnh lý này.
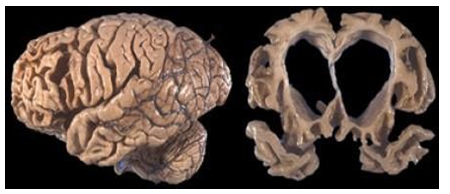
Hình 3.16. Thoái hóa FTLD với teo não tập trung vùng thái dương và trán, không có teo não vùng đỉnh chẩm
Hình ảnh đặc trưng trên MRI sọ não là tình trạng teo não tiến triển vùng trước trán và/ hoặc thùy thái dương và tình trạng teo có thể xảy ra không đối xứng. Ví dụ nhóm bệnh rối loạn ngôn ngữ tiến triển thường teo não ưu thế ở vùng thái dương bên trái.
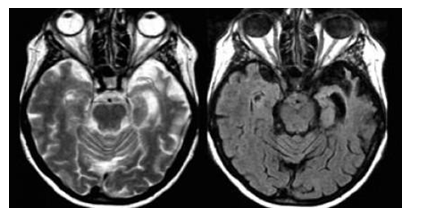
Hình 3.17. Hình ảnh T2WI và FLAIR với teo não dạng lưỡi dao “ knife blade” ở thùy thái dương bên trái trong khi thùy thái dương phải teo nhẹ
Hình 3.17 ghi nhận ở bệnh nhân có triệu chứng mất khả năng ngôn ngữ tiến triển, phát hiện nội bật nhất là teo não không đối xứng tập trung chủ yếu thùy thái dương trái một phần nhỏ thùy thái dương phải mà còn teo não ở vùng đồi thị. Tình trạng teo não này xuất hiện hình ảnh “knife blade”.
Ngoài ra còn ghi nhận hình ảnh tăng tín hiệu ở thì FLAIR có thể do bệnh lý Gliosis.
Tình trạng teo não thùy thái dương trái có thể nhân ra do chứng mất ngôn ngữ, rối loạn vận ngôn, nhưng nếu xảy ra tình trạng teo thùy thái dương bên phải sẽ khó nhận ra bởi vì chỉ xuất hiện các rối loạn tinh tế trong việc nhận diện khuôn mặt.
KẾT LUẬN
Cơ chế bệnh sinh khá rõ ràng ở bệnh nhân đái tháo đường type 2 với sa sút trí tuệ thể Alzheimer và sa sút trí tuệ mạch máu Tiến triển từ suy giảm thần kinh nhận thức nhẹ đến suy giảm thần kinh nhận thức thật sự cần được theo dõi sát và đánh giá sớm tổn thương não bằng MRI sọ não. Từ đó mới có các phương pháp phân loại chẩn đoán và điều trị hiệu quả.
Các thang điểm đánh giá tổn thương và xác định vị trí tổn thương là công cụ hữu ích giúp định danh chính xác và phân loại mức độ tổn thương não. Tổn thương não trên bệnh nhân đái tháo đường không phải là một dạng tổn thương đơn thuần mà kết hợp nhiều loại tổn thương. Trong đó bệnh lý thoái hóa não chất trắng, nhồi máu não lỗ khuyết, nhồi máu vùng chiến lược là tổn thương vi mạch máu thường gặp trong bệnh lý sa sút trí tuệ mạch máu, FLTD, LBD và Alzheimer ở bệnh nhân đái tháo đường type2.
TÀI LIỆU THAM KHẢO
- Nguyễn Hải Thủy (2009), Bệnh tim mạch trong đái tháo đường, Nhà xuất bản Đại Học Huế, 29-81
- ADA (2019), “Glycemid Target: Standards of Medical Care in Diabetes- 2019”, Diabetes Care 2019, Vol 42: S 61- S70.
- Abbott MA, Wells DG, Fallon JR (1999), “The insulin receptor tyrosine kinase substratep58/53and the insulin receptor are components of CNS synapses”, J Neurosci, 19(17):7300–8. 44
- Biessels J, Luchsinger JA et all (2015), “Diabetes and the brain”, Humana Press, New York
- Biessels J., & Despa, F. (2018), “Cognitive decline and dementia in diabetes mellitus: mechanisms and clinical implications”, Nature Reviews Endocrinology, vol 14 (10), pp. 591-604.
- Choi J, Chandrasekaran K, Demarest TG, Kristian T, Xu S, Vijaykumar K, et al (2014), “Brain diabetic neurodegeneration segregates with low intrinsic aerobic capacity’, Ann Clin Transl Neurol, 1(8), p.589–604. 37.
- Cholerton, B., Baker, D., Montine, T. J., & Craft, S. (2016),”Type 2 Diabetes, Cognition, and Dementia in Older Adults: Toward a Precision Health Approach.”, Diabetes Spectrum, 29(4), pp. 210–219.
- Ferdinando Giacco, and Michael Brownlee (2010), “The role HRE of genes required for neovascularisation”, Circulation Research. Vol: 107, pp. 1058- 1070.
- Fernando Gomez-Pinilla (2012), “How does the brain use food as energy?”, BrainFacts/ SfN
- Jeremy J. Pruzin MD, Peter Nelson MD PhD, et all (2018), Relationship of Type 2 Diabetes to Human Brain Pathology.
- Kodl, C. , & Seaquist, E. R, (2008), “Cognitive Dysfunction and Diabetes Mellitus”, Endocrine Reviews, 29(4), PP. 494–511
- Last, D., Alsop, D. C., Abduljalil, A. M., Marquis, R. , et all. (2007), “Global and Regional Effects of Type 2 Diabetes on Brain Tissue Volumes and Cerebral Vasoreactivity”, Diabetes Care, 30(5), pp. 1193–1199.
- Manuel Rodriguez-Perdigon (2016), “Lipoic acid improves neuronal insulin signalling and rescues cognitive function regulating VGlut1 expression in high-fat-fed rats: Implications for Alzheimer’s disease”, Biochimica et Biophysica Acta, Elsevier, Volume 1862, Issue 4, 511-517.
- Masayuki Yagi, Yoshikazu Yonei (2019), “Glycative stress and anti-aging: 12. Glycative stress and dementia”, Glycative Stress Research; 6 (2): 087- 092
- Sara Nunes, Edna Soares, Frederico Pereira, Flávio Reis (2012), “ Diabetic encephalopathy: the role of oxidative stress and inflammation in type 2 diabetes, International Journal of Interferon”, Cytokine and Mediator Research, vol 4, pp. 75-85.
- Spinelli, M., Fusco, S., & Grassi, C. (2019), “Brain Insulin Resistance and ippocampal Plasticity: Mechanisms and Biomarkers of Cognitive Decline”, Frontiers in Neuroscience, 13.
- Umegaki Hiroyuki (2014), “Type 2 diabetes as a risk factor for cognitive impairment: current insights”, Clinical Interventions in Aging,
- Ward, , Li, W., Abdul, Y., Jackson, L. et all (2019), “NLRP3 Inflammasome Inhibition with MCC950 Improves Diabetes-Mediated Cognitive Impairment and Vasoneuronal Remodeling After Ischemia”, Pharmacological Research, Volume 142, pp. 237-250.
- Yadong Zhai; Xiangbao Meng; Tianyuan Ye; Weijie Xie; Guibo Sun, et all (2018), “Inhibiting the NLRP3 Inflammasome Activation with MCC950 AmelioratesDiabetic Encephalopathy in db/db Mice”, Molecules, Volume 23, Number 3, pp.522-522
- Yan, , Liu, X.-H., Han, M.-Z., Wang, Y.- M., Sun, X.-L., Yu, N., … Chen, Z.-Y. (2015), “Blockage of GSK3β-mediated Drp1 phosphorylation provides neuroprotection in neuronal and mouse models of Alzheimer’s disease”, Neurobiology of Aging, 36(1), 211–227.
- Zilliox, L. A., Chadrasekaran, K., Kwan,
- Y.. (2016), “Diabetes and Cognitive Impairment”, Current Diabetes Reports, 16(9). 38
- Zilliox, A., Chadrasekaran, K., Kwan,
- Y., & Russell, J. W. (2016). Diabetes and Cognitive Impairment. Current Diabetes Reports, 16(9).
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam