BƯỚC ĐẦU ĐÁNH GIÁ MỘT SỐ VACCINE PHÒNG NGỪA COVID-19
Nguyễn Hải Quý Trâm1, Huỳnh Lê Thái Bão2
1Trường Đại học Y-Dược, Đại học Huế, Thừa Thiên Huế
2Trường Đại học Duy Tân, Đà Nẵng
DOI: 10.47122/vjde.2021.50.17
SUMMARY
Initiative evaluation of Covid-19 vaccinations effectiveness
At the end of 2019, the COVID-19 disease caused by SARS-CoV-2 first appeared in Wuhan, China, and quickly spread to become a global pandemic. Not long after, the World Health Organization (WHO) officially declared the outbreak of the COVID-19 pandemic as an international public health emergency. According to Worldometer, by September 30, the world had 234.093.937 Coronavirus cases, 4,788,725 deaths, and 210,903,247 recovered [2]. To control the pandemic, the unified world needs to carry out 23 basic steps: Preventing the spread by 5K; Active treatment to reduce mortality; and Prevention of infection by active immunization with Vaccin.With the trend of “living with COVID” in the “new normal”, vaccination for herd immunity is the most basic and extremely important step. In Vietnam, it also follows the general trend of pandemic control. Currently, it is actively mobilizing, purchasing, exchanging, transferring technology and producing domestically to have enough vaccine supply needed for the entire population to soon quell the pandemic. At the same time, provide the latest scientific information to prove the effectiveness of vaccine to create trust, consensus, and cooperation with the government in vaccination to bring peace, health and happiness to all families.
Keywords: vaccine, COVID-19, evaluation
Tác giả liên hệ: Nguyễn Hải Quý Trâm Email: [email protected] Ngày nhận bài: 1/11/2021
Ngày phản biện khoa học: 10/11/2021 Ngày duyệt bài: 15/12/2021
TÓM TẮT
Bệnh COVID-19 do một loại coronavirus có tên là SARS-CoV-2 gây ra, chủ yếu lây lan qua tiếp xúc gần. Không chỉ ảnh ưởng đến đường hô hấp, các cơ quan khác trong cơ thể cũng bị ảnh hưởng ở các mức độ từ nhẹ đến nặng. Những người mắc COVID-19 biểu hiện với các triệu chứng từ nhẹ đến nặng và thậm chí tử vong.
Cho đến nay, ngành y tế của nhiều nước trên thế giới thống nhất chung phương cách kiểm soát đại dịch COVID-19 gồm 3 khâu chính: (1) Tránh lan truyền bằng 5K; (2) Điều trị tích cực các ca nhiễm, các ca F0, cố gắng giảm thấp tử vong; và (3) Ngừa lây nhiễm bằng tiêm phòng vaccine diện rộng, ít nhất 80% dân số; trong đó tiêm vaccine phòng ngừa COVID-19 là biện pháp tích cực và hữu hiệu nhất. Từ vaccine ngừa bệnh đậu mùa do bác sĩ Edward Jenner (1749-1823), nước Anh, phát minh năm 1798, nhân loại phát triển rất nhiều loại vaccine phòng bệnh lây nhiễm khác.
Đến nay, Tổ chức Y tế thế giới (WHO) đã công nhận tiêm vaccine là phương thức bảo vệ hiệu quả nhất nhằm giúp nhân loại tránh được các bệnh truyền nhiễm. Nhiễm SARS-CoV-2 gây COVID-19 với nhiều mức độ từ không triệu chứng đến nhẹ, nặng thậm chí tử vong [10]. Ngay từ khi bệnh khởi phát, các nhà khoa học đã nghiên cứu phát triển các vaccine phòng COVID-19. Các thử nghiệm lâm sàng trên người (clinical trial) đã bắt đầu tiến hành ngay trong năm 2020 tại Hoa Kỳ và một số các nước Châu Âu và Trung Quốc [15],[16], và đã có một số quốc gia tiêm chủng trước khi có kết quả lâm sàng.
Theo thống kê của WHO, cho đến tháng 7/2021 hiện có 330 loại vaccine ngừa COVID-19 đang được thử nghiệm tiền lâm sàng trên động vật và lâm sàng trên người [1]. Trong đó có 102 đang trong nghiên cứu lâm sàng gồm 30 giai đoạn I, 30 trong giai đoạn I – II, 25 trong giai đoạn III, và 8 trong giai đoạn phát triển IV [1].
Một số vaccine Covid-19 đã được phê duyệt sử dụng khẩn cấp [16],[24] và nhiều vaccine còn đang trong giai đoạn thử nghiệm lâm sàng cuối cùng [17].
Hiện nay, chỉ có 6 vaccine đã được WHO đưa vào danh sách sử dụng khẩn cấp [9]. Nhiều loại vaccine ngừa COVID-19 ở Việt Nam và trên thế giới đã được chứng minh là có hiệu quả hạn chế lây nhiễm và mức độ bệnh nặng.
1. PHÂN LOẠI VACCINE
Tùy theo chất làm kháng nguyên (immunogen), chất liệu kích thích miễn dịch, vaccine được phân ra 6 loại sau [5], [22-23]:
1.1. Vaccine tiểu đơn vị (subunit vaccin)
Vaccine tiểu đơn vị cũng không chứa tác nhân gây bệnh còn sống như vaccine bất hoạt toàn thể.
Điểm khác biệt ở đây là chỉ lấy tiểu phần kháng nguyên cần thiết từ tác nhân gây bệnh để tạo đáp ứng miễn dịch. Tiểu phần có thể là protein (protein-based subunit vaccin), polysaccharide (polysaccharide vaccin), hay đơn vị liên hợp (conjugate subunit vaccin).
Vì không chứa tác nhân gây bệnh còn sống nên vaccine tiểu đơn vị hoàn toàn an toàn khi sử dụng trên người, kể cả các trường hợp suy giảm miễn dịch.
Các vaccine tiểu đơn vị hiện có gồm vaccine ho gà, phế cầu, màng não cầu, Hib, viêm gan B, HPV, zona.
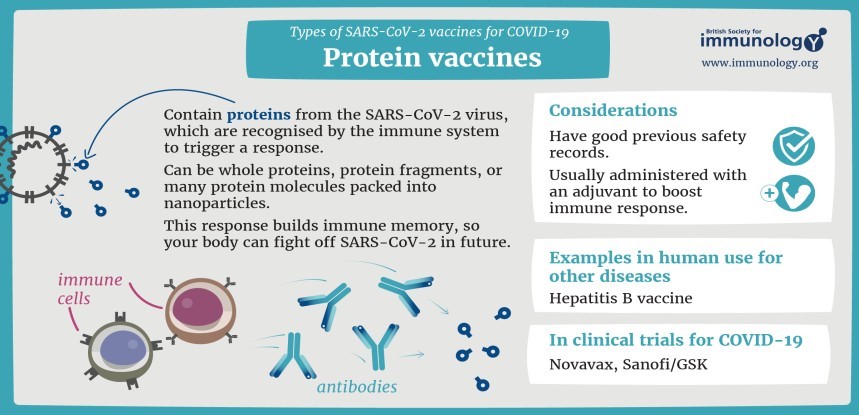
Hình 1. Cơ chế hoạt động của vaccine tiểu đơn vị
1.2. Vaccine bất hoạt (inactivated vaccin)
Vaccine bất hoạt được sản xuất bằng cách nuôi cấy SARS-CoV-2 trong nuôi cấy tế bào sau đó bất hoạt vi rút về mặt hóa học [22,23].
Virus bất hoạt thường được kết hợp với phèn chua hoặc một chất bổ trợ khác trong vaccinđể kích thích phản ứng miễn dịch. Vaccinbất hoạt thường được tiêm bắp.
Họ yêu cầu cơ sở cấp 3 an toàn sinh học để sản xuất. Các phản ứng miễn dịch đối với vaccinbất hoạt SARS-CoV-2 sẽ không chỉ nhắm vào protein đột biến mà còn nhắm vào các thành phần khác của vi rút.
Hai vaccine bất hoạt đặc trưng là vaccine Sinopharm, Coronavax, là loại vaccine phòng COVID-19 đầu tiên đã được WHO cho phép sử dụng khẩn cấp.

Hình 2. Cơ chế hoạt động của vaccine bất hoạt virus
1.3. Vaccine biến độc tố (toxoid vaccin)
Là một dạng vaccine tiểu đơn vị, được sản xuất dựa trên độc tố mà vi khuẩn sản sinh ra, như độc tố của vi khuẩn uốn ván hay bạch hầu.Vaccine giải độc tố được sử dụng phòng các bệnh gián tiếp gây ra qua độc tố của vi khuẩn như bệnh uốn ván, bạch hầu. Độc tố bản chất là protein được xử lý thành không còn độc, vô hại, sử dụng làm kháng nguyên trong các vaccine này. Hai vaccine biến độc tố hiện dùng là giải độc tố bạch hầu và giải độc tố uốn ván.
1.3.1. Vaccine giảm độc lực (attenuated vaccine)
Các mầm gây bệnh như virus, vi khuẩn được làm suy yếu, giảm độc lực bằng nhiều cách khác nhau, phổ biến nhất là nuôi cấy lặp đi lặp lại rất nhiều lần (có thể lên tới 200 lần), khiến các mầm bệnh này chỉ nhân lên trong môi trường nuôi cấy và yếu, giảm khả năng nhân lên trong cơ thể con người, do đó an toàn để sử dụng.
Vì vaccine sống giảm độc lực còn khả năng nhân lên trong cơ thể người được tiêm chủng, việc sử dụng loại vaccine này thực chất là đưa một liều rất nhỏ mầm bệnh đã giảm hoặc mất độc lực vào trong cơ thể, để chúng nhân lên và khởi động đáp ứng miễn dịch. Miễn dịch đạt được từ vaccine sống giảm độc lực gần hoàn toàn giống với khi mắc bệnh tự nhiên, nên đây là loại vaccine tạo đáp ứng miễn dịch hiệu quả nhất.
Các tác nhân ánh sáng, nhiệt độ, hóa chất…ảnh hưởng lên quá trình nhân lên bên trong cơ thể đều khiến vaccine giảm hoặc mất hiệu quả.
Do đó, việc lưu trữ, vận chuyển phải rất nghiêm ngặt, có trang thiết bị chuyên dụng phù hợp. Một số vaccine sống giảm độc lực được sản xuất và đưa ra thị trường dưới dạng bột đông khô, trước khi sử dụng cần phải hòa tan với dung dịch được chỉ định theo hướng dẫn của nhà sản xuất.
Đồng thời nhiều vaccine sống giảm độc lực yêu cầu phải bảo quản lạnh để đảm bảo chất lượng.
Các vaccine sống giảm độc lực hiện có gồm vaccine sởi, quai bị, rubella, bại liệt (Sabin uống), đậu mùa, thủy đậu, BCG, thương hàn (uống), sốt vàng, rota virus, và cúm..

Hình 3. Cơ chế hoạt động của vaccine giảm độc lực
1.3.2. Vaccine vector virus (viral vector- based vaccines)
Khác với hầu hết các loại vaccine thông thường, vaccine vector virus sử dụng chính tế bào cơ thể con người để sản xuất kháng nguyên. Một hạn chế đối với vaccine vectơ là khả năng miễn dịch đã có từ trước đối với vectơ có thể làm giảm khả năng sinh miễn dịch của vaccine. Các hãng dược phẩm sử dụng một loại virus đã được sửa đổi (vector) cung cấp mã di truyền của kháng nguyên vào tế bào người, chỉ đạo tế bào sản sinh một lượng
lớn kháng nguyên, các kháng nguyên này trở lại kích hoạt hệ thống miễn dịch, kích hoạt cả tế bào T (ký ức miễn dịch) cũng như tế bào B (sản xuất kháng thể), bắt chước những gì xảy ra trong quá trình lây nhiễm tự nhiên với một số mầm virus gây bệnh.
Vaccine vectơ virus đầu tiên là vaccine rVSV-ZEBOV chống lại bệnh Ebola. Các vaccine vector virus đang được sử dụng hiện nay gồm: AstraZeneca, Johnson&Johnson, Nanovac, Sputnik V.

Hình 4. Cơ chế hoạt động của vaccine vector virus
1.3.3. Vaccine gene di truyền (genetic vaccins)
Sử dụng những tiến bộ sinh học phân tử và miễn dịch học mới nhất để chỉnh lý phản ứng miễn dịch tế bào, thể dịch, hoặc cả hai chống
lại các kháng nguyên gây bệnh.
ARN là vaccine đầu tiên cho SARS-CoV- 2 được sản xuất và đại diện cho một cách tiếp cận vaccine hoàn toàn mới. Sau khi được sử dụng, RNA được dịch mã thành
protein đích, nhằm mục đích tạo ra phản ứng miễn dịch. mRNA vẫn còn trong tế bào chất của tế bào và không đi vào nhân; vaccine mRNA không tương tác hoặc tích hợp vào DNA của người nhận.
Công nghệ vaccine này sử dụng một hoặc nhiều gen mã hóa các protein mầm bệnh cần phòng ngừa. Sau khi được tiêm vaccine gene di truyền, tế bào cơ thể sử dụng vật liệu di truyền từ vaccine để tạo ra protein đặc hiệu của mầm bệnh giúp hệ thống miễn dịch nhận
diện và kích hoạt phản ứng miễn dịch cụ thể để chống lại đúng mầm bệnh này trong tương lai.Các vaccine này được sản xuất hoàn toàn trong ống nghiệm, tạo điều kiện thuận lợi cho việc sản xuất. Tuy nhiên, một số vaccine phải được duy trì ở nhiệt độ rất thấp, gây phức tạp cho việc bảo quản.
Hai vaccine đầu tiên sử dụng công nghệ mRNA là Moderna, và Pfizer/BioNTech (Mỹ). Một vaccine đầu tiên sử dụng công nghệ DNA là ZyCoV-D (Ấn Độ).
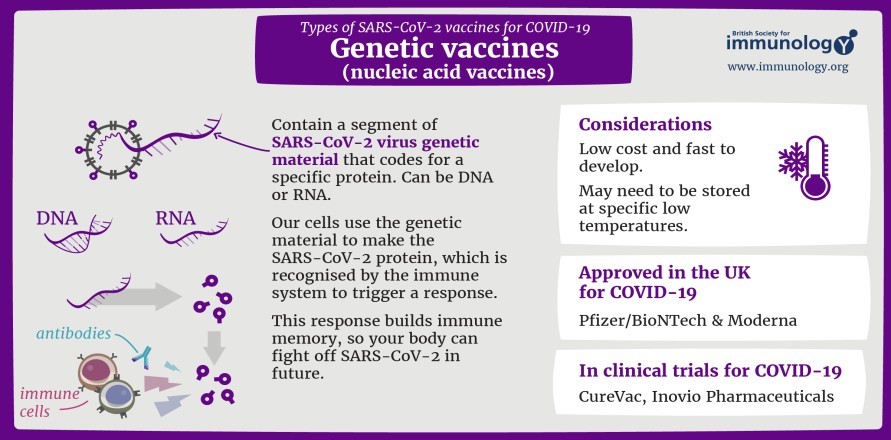
Hình 5. Cơ chế hoạt động của vaccine gene di truyền
2. ĐÁNH GIÁ KẾT QUẢ
Theo khảo sát đa trung tâm, đa quốc gia cho thấy, dù có khác biệt nhau, nhưng nói chung các vaccine đã được sử dụng, có phép khẩn cấp hay không, đều có 3 tác dụng rõ rệt:
- Giảm số người nhiễm bệnh;
- Giảm số lượng nhập viện; và
- Giảm tỷ lệ tử
Giá các vaccine COVID-19 ở Việt Nam: Vaccine AstraZeneca 2.4 USD, Vaccine Johnson & Johnson 10 USD, Vaccine Sputnik V:13 USD, Vaccine Vero Cell:13.6 USD, vaccine Pfizer/BioNTech: 19.5 USD, Vaccine Moderna: 25-30 USD.
Gần đây đã có những tin tức đầy phấn khởi về các vaccine chống COVID-19 với một số thử nghiệm thành công được ghi nhận. Một số loại vaccine có sẵn để sử dụng ở các quốc gia khác nhau chúng đại diện cho các phương pháp tiếp cận vaccine khác nhau, bao gồm vaccine RNA, vaccine vectơ không có khả năng sao
chép, vaccine protein tái tổ hợp và vaccine bất hoạt; các tính năng chung của các nền tảng khác nhau này được mô tả ở phần khác.
Khả năng sinh miễn dịch, hiệu quả và độ an toàn của các loại vaccin cụ thể được thảo luận dưới đây. Các vấn đề chung liên quan đến nhiễm trùng đột phá, tác động đến sự lây truyền, hiệu quả chống lại các biến thể cần quan tâm và thời gian ảnh hưởng được thảo luận ở những nơi khác.
1. BNT162b2 (Vaccin Pfizer-BioNTech COVID-19)
- Vaccine mRNA này được cung cấp trong một hạt nano lipid để biểu hiện một protein đột biến có chiều dài đầy đủ. Nó được tiêm bắp với hai liều cách nhau ba tuần. BNT162b2 đã được phép sử dụng ở một số địa điểm, bao gồm Hoa Kỳ, Vương quốc Anh (Anh), Liên minh Châu Âu và Canada [25,34-36]. Việc sử dụng vaccine trên lâm sàng được thảo luận ở những nơi khác.
● Tính sinh miễn dịch
- Ở người lớn khỏe mạnh từ 18 đến 85 tuổi, các phản ứng kháng thể liên kết và trung hòa đã được chứng minh là tương đương với các phản ứng trong huyết tương điều trị từ những bệnh nhân không có triệu chứng hoặc nhiễm SARS-CoV-2 mức độ trung bình [37]. Đáp ứng ở những người tham gia ≥65 tuổi nhìn chung thấp hơn ở những đối tượng trẻ hơn, nhưng vẫn có thể so sánh với hiệu giá trong huyết tương dưỡng bệnh. Hiệu giá kháng thể trung hòa ở những người nhận từ 12 đến 15 tuổi cao hơn đáng kể so với hiệu giá được tạo ra ở những người từ 16 đến 25 tuổi [38].
- Các nghiên cứu cho thấy rằng huyết tương từ những cá nhân được tiêm chủng BNT162b2 vẫn giữ được hoạt tính trung hòa chống lại các biến thể cần quan tâm, mặc dù mức độ kháng thể trung hòa được tạo ra thấp hơn đối với Beta (B.1.351) [39-42] và ở mức độ thấp hơn đối với Delta (B.1.617.2) [40,41,43] so với mức chống lại các chủng đã lưu hành trước đó.
● Tính hiệu quả
- Trong một thử nghiệm lớn ở giai đoạn III có đối chứng với giả dược, vaccine này có hiệu quả 95% (KTC 95% 90,3-97,6) trong việc ngăn ngừa COVID-19 có triệu chứng vào hoặc sau ngày thứ 7 sau liều thứ hai [44,45]. Hiệu quả này được đánh giá sau khi phân tích 170 trường hợp COVID-19 được xác nhận (8 trường hợp ở nhóm vaccinvà 162 trường hợp ở nhóm giả dược) trong số hơn 000 người tham gia từ 16 tuổi trở lên với thời gian theo dõi trung bình là hai tháng sau khi tiêm chủng. Trong số những người lớn ≥65 tuổi có các bệnh đi kèm hoặc béo phì khác, hiệu quả của vaccine là 91,7% (KTC 95% 44,2- 99,8). Trong số toàn bộ dân số thử nghiệm, tỷ lệ COVID-19 trong nhóm vaccine bắt đầu giảm so với tỷ lệ ở nhóm giả dược khoảng hai tuần sau liều đầu tiên. Hiệu quả của vaccine sau hai liều cũng cao trong số 1983 người tham gia thử nghiệm vị thành niên từ 12 đến 15 tuổi mà không có bằng chứng về nhiễm trùng trước đó, với 0 và 16 trường hợp có triệu chứng ở những người nhận vaccine và giả dược [38].
- Dữ liệu quan sát từ các quốc gia khác nhau [28,46-57]. Trong một nghiên cứu từ Israel sử dụng dữ liệu giám sát quốc gia từ hơn 6,5 triệu cá nhân, trong đó 72% đã được tiêm BNT162b2, hiệu quả vaccine ước tính trong bảy ngày hoặc hơn sau liều thứ hai là 92% đối với trường hợp nhiễm SARS-CoV-2 được ghi nhận, 97% đối với COVID-19 có triệu chứng, 97% trường hợp nhập viện liên quan đến COVID-19 và 97% trường hợp tử vong do COVID-19 46].
- Hiệu quả của vaccine đối với những kết quả này là cao như nhau ở tất cả các nhóm tuổi. Vaccine này cũng có hiệu quả chống lại các biến thể SARS-CoV-2 đã trở nên phổ biến kể từ lần thử nghiệm đầu tiên. Trong một nghiên cứu trên 23.000 nhân viên y tế ở Vương quốc Anh, bao gồm khung thời gian khi biến thể Alpha (B.1.1.7) phổ biến, hiệu quả của vaccine chống lại nhiễm trùng SARS- CoV-2 (cả không có triệu chứng và có triệu chứng) được ước tính là 85 phần trăm 7 ngày trở lên sau liều thứ hai [49]. Ngoài ra, trong một nghiên cứu về cơ sở dữ liệu quốc gia COVID-19 ở Qatar, nơi hơn 265.000 cá nhân đã nhận được hai liều BNT162b2 và cả hai biến thể Alpha và Beta (B.1.351) là chủ yếu, hiệu quả của vaccinđược ước tính là 90% (95% CI 86-92) đối với bất kỳ trường hợp nhiễm Alpha nào, 75% (95% CI 71-79) đối với bất kỳ trường hợp nhiễm Beta nào và 100% đối với nhiễm trùng nặng, nguy kịch hoặc tử vong với một trong hai biến thể [58]. Tương tự, trong một nghiên cứu từ Vương quốc Anh, ước tính hiệu quả chống lại nhiễm trùng có triệu chứng do Delta (B.1.617.2) gây ra là 88 phần trăm (95% CI 85-90) so với 94 phần trăm (95% CI 92-95) đối với Alpha [59]. Tuy nhiên, dữ liệu chưa được công bố từ Israel đã gợi ý rằng sự xuất hiện của Delta như một biến thể chủ yếu trong nước có liên quan tạm thời với tỷ lệ hiệu quả thấp hơn (64%) chống lại nhiễm trùng có triệu chứng; hiệu quả chống lại việc nhập viện vẫn rất cao.
- Hiệu quả của vaccine có thể giảm dần theo thời Trong một báo cáo tiếp theo của những người tham gia thử nghiệm giai đoạn III, hiệu quả của vaccine chống lại bệnh có triệu chứng vẫn cao trong sáu tháng nhưng giảm nhẹ từ 96 phần trăm sau hai tháng, xuống 90% trong hai đến bốn tháng, xuống 84 phần trăm từ bốn đến sáu tháng. Trong số 30 trường hợp nhiễm trùng nặng, chỉ có một trường hợp xảy ra ở một người đã được tiêm chủng.
● An toàn và tác dụng phụ
- Các tác dụng ngoại ý tại chỗ và toàn thân tương đối phổ biến, đặc biệt sau liều thứ hai; hầu hết ở mức độ nhẹ hoặc trung bình (tức là không ngăn cản các hoạt động hàng ngày) và chỉ giới hạn trong hai ngày đầu sau khi tiêm chủng [30, 33, 44]. Trong số 1,6 triệu người nhận vaccin(từ 16 tuổi trở lên) ở Hoa Kỳ đã trả lời các cuộc khảo sát sau tiêm chủng, phản ứng tại chỗ tiêm (chủ yếu là đau, nhưng cũng đỏ, sưng và ngứa) đã được báo cáo với khoảng 65% sau mỗi liều; mệt mỏi, nhức đầu và đau cơ được báo cáo ở 29, 25 và 17% sau liều đầu tiên và 48, 40 và 37% sau liều thứ hai, tương ứng [30]. Sau liều thứ hai, mỗi lần sốt, ớn lạnh và đau khớp xảy ra với tỷ lệ khoảng 20%. Các phản ứng được báo cáo thường xuyên nhất vào ngày sau khi tiêm chủng. Những phản ứng này cũng thường được báo cáo ở thanh thiếu niên từ 12 đến 15 tuổi sau liều thứ hai (mệt mỏi, nhức đầu, ớn lạnh và đau cơ lần lượt ở [66, 65, 42] và 32%) [38]. Các phản ứng tại chỗ và toàn thân ít xảy ra hơn ở những người nhận từ 65 tuổi trở lên nhưng vẫn tương đối phổ biến. Viêm cơ tim và viêm màng ngoài tim, chủ yếu ở nam thanh thiếu niên và thanh niên, đã được báo cáo thường xuyên hơn dự kiến sau khi nhận BNT162b2. Điều này được thảo luận chi tiết ở nơi khác. Sốc phản vệ sau khi tiêm chủng đã được báo cáo với tỷ lệ xấp xỉ 5 sự kiện trên 1 triệu liều; 80% trường hợp sốc phản vệ đã xảy ra ở những người có tiền sử phản ứng dị ứng và 90% xảy ra trong vòng 30 phút [32]. Các phản ứng dị ứng khác được báo cáo bao gồm ngứa, phát ban, cảm giác ngứa ngáy trong cổ họng và các triệu chứng hô hấp nhẹ. Các tác dụng phụ lớn khác không liên quan nhất quán với việc tiếp nhận BNT162b2 [63]. Các trường hợp hiếm gặp về bệnh liệt của Bell đã được ghi nhận trong thử nghiệm pha III (bốn trường hợp ở người tiêm vaccine và không có ở người nhận giả dược) [44]; tuy nhiên, tỷ lệ này không vượt quá tỷ lệ cơ bản được tìm thấy trong dân số nói chung (15 đến 30 trường hợp trên 100.000 người mỗi năm), và theo dõi sau vaccine không xác định được mối liên quan giữa tiêm chủng và bệnh liệt Bell [32]. Tính đến ngày 12 tháng 4 năm 2021, không có báo cáo nào ở Hoa Kỳ về huyết khối xoang tĩnh mạch trung tâm với giảm tiểu cầu sau gần 98 triệu liều BNT162b2 được sử dụng [64]. Trong một nghiên cứu thuần tập lớn từ Israel, việc tiếp nhận BNT162b2 có liên quan chặt chẽ nhất đến viêm cơ tim, nổi hạch, viêm ruột thừa và herpes zoster.
2. mRNA-1273 (Vaccine Moderna COVID-19)
- Vaccine RNA thông tin (mRNA) này là một trong những vaccinđầu tiên cho SARS- CoV-2 được sản xuất; nó được phát triển và sử dụng cho người trong vòng hai tháng sau khi công bố trình tự gen SARS-CoV-2. Vaccine sử dụng mRNA được phân phối trong một hạt nano lipid để biểu hiện một protein đột biến có chiều dài đầy đủ. Nó được tiêm bắp làm hai liều cách nhau 28 ngày. mRNA-1273 đã được phép sử dụng ở Hoa Kỳ và Liên minh Châu Âu [26].
● Khả năng sinh miễn dịch
- Một thử nghiệm nhãn mở pha I đã chứng minh các phản ứng kháng thể liên kết và trung hòa tương đương với các phản ứng được thấy trong huyết tương dưỡng bệnh khi tiêm vaccinở những người khỏe mạnh từ 18 đến 55 tuổi. Các phản ứng của tế bào CD4 với sai lệch Th1 cũng được phát hiện. Tiêm phòng ở người lớn trên 55 tuổi cũng tạo ra các phản ứng miễn dịch tương đương với các phản ứng miễn dịch ở nhóm trẻ. Đáp ứng kháng thể liên kết và trung hòa giảm nhẹ trong sáu tháng ở những người tham gia từ tất cả các nhóm tuổi nhưng hiệu giá kháng thể vẫn cao và hoạt động trung hòa vẫn tồn tại trong thời gian này. Khả năng sinh miễn dịch ở thanh thiếu niên từ 12 đến 17 tuổi tương đương hoặc cao hơn khả năng sinh miễn dịch ở thanh niên. Chủng ngừa bằng mRNA-1273 có liên quan đến hiệu giá kháng thể cao hơn (được đo từ 6 đến 10 tuần sau liều thứ hai) so với BNT162b2.
- Các nghiên cứu cho thấy rằng huyết tương từ những cá nhân được tiêm chủng mRNA-1273 vẫn giữ được hoạt tính trung hòa chống lại các biến thể cần quan tâm, mặc dù mức độ kháng thể trung hòa được tạo ra thấp hơn đối với Beta (B.1.351) và Delta (B.1.617.2) [43] so với mức chống lại các chủng đã lưu hành trước đó.
- Trong kết quả giai đoạn III có đối chứng với giả dược, mRNA-1273 có 94,1% hiệu quả của vaccine (95% CI 89,3-96,8) trong việc ngăn ngừa COVID-19 có triệu chứng tại hoặc sau 14 ngày sau liều thứ Hiệu quả này được đánh giá sau khi phân tích 196 trường hợp COVID-19 được xác nhận (11 trường hợp ở nhóm vaccinvà 185 trường hợp ở nhóm dùng giả dược) trong số gần 30.000 người tham gia nghiên cứu từ 18 tuổi trở lên với thời gian theo dõi trung bình là hai tháng sau khi tiêm chủng. Ở người lớn ≥65 tuổi, hiệu quả của vaccinlà 86,4% (KTC 95% 61,4-95,5). Ba mươi trường hợp nghiêm trọng, và tất cả những trường hợp này đều xảy ra ở nhóm dùng giả dược. Sau khi theo dõi trung bình 5,2 tháng, hiệu quả của vaccine là 93,2% đối với nhiễm trùng có triệu chứng (9,6 so với 136,6 trường hợp trên 100 người-năm với giả dược) và 98,2% đối với bệnh nặng (2 so với 106 trường hợp với giả dược).
- Dữ liệu quan sát đánh giá hiệu quả của vaccincũng hỗ trợ các kết quả thử nghiệm [28,54,55,57]. Trong một nghiên cứu so sánh tỷ lệ chênh lệch của xét nghiệm SARS-CoV-2 dương tính giữa những người được tiêm chủng và chưa được tiêm chủng đã được thử nghiệm trong bối cảnh hơn 40.000 người nhập viện và lượt chăm sóc khẩn cấp hoặc cấp cứu, hiệu quả của vaccinmRNA-1273 là 91 đến 92 phần trăm chống lại việc cấp cứu hoặc chăm sóc khẩn cấp hoặc nhập viện liên quan đến COVID-19 [28]. Một nghiên cứu bệnh chứng trên 100.000 cựu chiến binh ở Hoa Kỳ đã được thử nghiệm SARS-CoV-2 đã ước tính hiệu quả vaccincủa mRNA-1273 là 98 phần trăm (95% CI 98-99) [55]. Một số nghiên cứu quan sát cho thấy hiệu quả của vaccinmRNA- 1273 cao hơn một chút so với BNT162b2, mặc dù vẫn chưa rõ liệu có sự khác biệt có ý nghĩa lâm sàng hay không [27, 29,78].
● An toàn và tác dụng phụ
- Các tác dụng ngoại ý tại chỗ và toàn thân tương đối phổ biến, đặc biệt sau liều thứ hai; hầu hết ở mức độ nhẹ hoặc trung bình (tức là không ngăn cản các hoạt động hàng ngày hoặc cần dùng thuốc giảm đau) và được giới hạn trong hai ngày đầu sau khi tiêm chủng [30, 33]. Trong số gần 2 triệu người nhận vaccinở Hoa Kỳ đã trả lời các cuộc khảo sát sau tiêm chủng, phản ứng tại chỗ tiêm (chủ yếu là đau, nhưng cũng đỏ, sưng và ngứa) được báo cáo ở 74 và 82% sau mỗi liều; mệt mỏi, nhức đầu và đau cơ được báo cáo ở 33, 27 và 21% sau liều đầu tiên và lần lượt là 60, 53 và 51% sau liều thứ hai [30]. Sau liều thứ hai, sốt và ớn lạnh mỗi người xảy ra khoảng 40% và đau khớp là 32%. Các phản ứng được báo cáo thường xuyên nhất vào ngày sau khi tiêm chủng. Các phản ứng tại chỗ và toàn thân ít xảy ra hơn ở những người nhận từ 65 tuổi trở lên nhưng vẫn tương đối phổ biến.
- Viêm cơ tim và viêm màng ngoài tim, chủ yếu ở nam thanh thiếu niên và thanh niên, đã được báo cáo thường xuyên hơn dự kiến sau khi nhận mRNA-1273. Điều này được thảo luận chi tiết ở nơi khác.
- Sốc phản vệ sau khi tiêm chủng đã được báo cáo với tỷ lệ xấp xỉ 2,8 biến cố trên một triệu liều; 86% trường hợp sốc phản vệ đã xảy ra ở những người có tiền sử phản ứng dị ứng và 90% xảy ra trong vòng 30 phút [32]. Có một số trường hợp hiếm hoi mắc bệnh liệt của Bell được coi là có khả năng liên quan đến việc tiêm chủng (ba trường hợp trong vaccinvà một trong nhóm giả dược). Tuy nhiên, tỷ lệ này không vượt quá tỷ lệ nền trong dân số nói chung (15 đến 30 trường hợp trên 100.000 người mỗi năm), và việc theo dõi sau vaccine không xác định được mối liên quan giữa tiêm chủng và bệnh liệt Bell [32].
- Không có tác dụng phụ liên quan đến vaccine chính nào khác đã được xác định trong giám sát sau vaccine. Kể từ ngày 29 tháng 6 năm 2021, một trường hợp huyết khối xoang tĩnh mạch trung tâm với giảm tiểu cầu sau khi nhận mRNA-1273 đã được báo cáo ở Hoa Kỳ. Chỉ đưa ra một trường hợp, rất khó để xác định mối quan hệ là quan hệ nhân quả hay ngẫu nhiên; bất kể, nó là cực kỳ hiếm.
Hai vaccine Pfizer-BioNTech và Moderna được sản xuất với kỹ thuật đột phá đặc biệt, tổng hợp nhân tạo mRNA.
Một ưu điểm thứ hai của vaccine công nghệ mRNA là các đoạn vaccine này chỉ hoạt động trong tế bào chất, bào tương (cytoplasm, cytosol) nên không vào nhân tế bào nên không thể ảnh hưởng lên gộ gene (genome) của con người [31].
Nhược điểm lớn nhất là giá thành khá cao, Moderna cao nhất 25-30 USD/liều, Pfizer/BioNTech 19 USD/liều [30]. Ngoài ra, vaccine Pfizer/BioNTech lại phải bảo quản dưới nhiệt độ cực lạnh, âm 70oC, âm 80 0C.
WHO: Lợi ích của vaccinCOVID-19 công nghệ mRNA lớn hơn nguy cơ
Tổ chức Y tế thế giới (WHO) cho biết lợi ích của vaccine ngừa COVID-19 sản xuất theo công nghệ mRNA, hiện dùng là loại Pfizer và Moderna, vượt trội so với nguy cơ viêm cơ tim cực kỳ hiếm gặp sau tiêm vaccine.
3. ChAdOx1 nCoV-19 / AZD1222 (Đại học Oxford, AstraZeneca và Viện Huyết thanh của Ấn Độ)
– Vaccine này dựa trên vectơ adenovirus tinh tinh không có khả năng sao chép biểu hiện protein đột biến (bảng 4). Nó được tiêm bắp và được đánh giá là hai liều cách nhau 4 đến 12 tuần. Tổ chức Y tế Thế giới (WHO) khuyến cáo nên tiêm hai liều cách nhau 8 đến 12 tuần. ChAdOx1 nCoV-19 / AZD1222 đã được phép sử dụng ở Liên minh Châu Âu và một số quốc gia khác, bao gồm Vương quốc Anh, Canada và Ấn Độ. Mặc dù có một số lo ngại về hiệu quả của vaccine đối với một số biến thể SARS-CoV-2, như được thảo luận dưới đây, WHO khuyến cáo sử dụng vaccine này ngay cả khi các biến thể đó đang lưu hành ở một quốc gia. Do một tác dụng phụ cực kỳ hiếm gặp, một số quốc gia đã đình chỉ việc sử dụng vaccine trong khi chờ đợi dữ liệu bổ sung, và một số quốc gia đang giới hạn vaccine cho những người trên một độ tuổi nhất định; điều này được thảo luận chi tiết ở nơi khác. (Nhìn thấy’Huyết khối với giảm tiểu cầu’ bên dưới.)
● Khả năng sinh miễn dịch
- Trong một thử nghiệm mù đơn, ngẫu nhiên có đối chứng giai đoạn I / II ở những người khỏe mạnh từ 18 đến 55 tuổi, trong đó hầu hết những người nhận vaccine được tiêm một liều duy nhất và một nhóm nhỏ nhận được một liều tăng cường bổ sung, trung hòa hiệu giá kháng thể trong 28 ngày. sau liều cuối cùng có thể so sánh với liều được phát hiện trong huyết tương dưỡng bệnh. Mức hiệu giá kháng thể đạt được cao hơn sau hai liều, và liều thứ ba có liên quan đến hiệu giá kháng thể thậm chí còn cao hơn. Các phản ứng miễn dịch tế bào cũng được phát hiện. Trong một nghiên cứu bao gồm những người nhận vaccine lớn tuổi (> 70 tuổi), vaccine dẫn đến các phản ứng kháng thể tương tự sau liều thứ hai như ở người trẻ tuổi. Tuy nhiên, các biến thể Beta (B.1.351) và Delta (B.1.617.2) có thể né tránh các đáp ứng miễn dịch ở một số cá nhân được tiêm chủng; trong một nghiên cứu trên 63 người nhận ChAdOx1 nCoV-19 / AZD1222, khoảng 60% có hoạt tính trung hòa có thể phát hiện được đối với các biến thể đó.
● Tính hiệu quả
- Trong một báo cáo kết quả tạm thời từ một thử nghiệm ngẫu nhiên đa quốc gia giai đoạn III, vaccine này có hiệu quả 70,4% (KTC 95% 54,8-80,6) trong việc ngăn ngừa COVID- 19 có triệu chứng tại hoặc sau 14 ngày sau liều thứ hai. Hiệu quả này được đánh giá sau khi phân tích 131 trường hợp được xác nhận COVID-19 (30 trường hợp ở nhóm vaccinvà 101 trường hợp ở nhóm đối chứng) trong số hơn 11.000 người tham gia với thời gian theo dõi trung bình là hai tháng sau khi tiêm chủng. Mười người tham gia đã phải nhập viện vì COVID-19, trong đó có hai người được phân loại là mắc bệnh nặng; tất cả chúng đều nằm trong nhóm đối chứng. Một nhóm nhỏ những người tham gia vô tình nhận được liều vaccine thấp hơn cho liều vaccine đầu tiên trong hai liều vaccine đầu tiên, và hiệu quả tổng thể của vaccine trong nhóm nhỏ này khác với nhóm còn lại. Hiệu quả của vaccine là 90,0 phần trăm (95% CI 67,4-97,0) trong số 2741 người tham gia nhận được liều thấp hơn và 62,1 phần trăm (95% CI 41-75,7) trong số những người được tiêm đủ liều. Lý do cho sự khác biệt này là không chắc chắn, mặc dù các khoảng tin cậy chồng chéo cho thấy rằng sự khác biệt không có ý nghĩa thống kê. Sự khác biệt trong đối chứng được sử dụng (vaccinviêm não mô cầu cho cả hai liều tại một số điểm nghiên cứu so với vaccinviêm não mô cầu cho một liều với nước muối cho một liều khác tại các vị trí khác) và trong khoảng thời gian giữa hai liều vaccine góp phần thêm vào sự không chắc chắn về kết quả.
- Trong một phân tích tiếp theo của thử nghiệm này, hiệu quả của vaccine đối với COVID-19 có triệu chứng là 76% từ 21 ngày sau khi nhận liều đầu tiên cho đến khi nhận được liều thứ hai hoặc ngày 90, tùy theo điều kiện nào đến trước, cho thấy sự bảo vệ với một liều duy nhất. Ngoài ra, việc nhận liều thứ hai sau 12 tuần hoặc muộn hơn có liên quan đến hiệu quả của vaccincao hơn so với việc tiêm dưới 6 tuần (81 so với 55%). Những phát hiện này hỗ trợ cho việc kéo dài khoảng thời gian cho liều thứ hai lên 12 tuần.
- Những phát hiện tương tự cũng được báo cáo trong một thông cáo báo chí về kết quả sơ bộ của một thử nghiệm có đối chứng với giả dược được tiến hành ở Hoa Kỳ, Chile và Peru. ChAdOx1 nCoV-19 / AZD1222 được tiêm hai liều đầy đủ cách nhau bốn tuần có hiệu quả 76% trong việc ngăn ngừa COVID-19 có triệu chứng, bắt đầu từ 15 ngày sau liều thứ hai. Việc công bố đầy đủ các chi tiết về phiên tòa là cần thiết để đánh giá một cách nghiêm túc những kết quả này. Tuy nhiên, dữ liệu quan sát từ các quốc gia khác nhau sau khi triển khai quốc gia của họ về ChAdOx1 nCoV-19/ AZD1222 hỗ trợ các kết quả thử nghiệm [47,88].
- Ví dụ, trong một nghiên cứu trên toàn quốc từ Scotland bao gồm hơn 600.000 người đã nhận được ít nhất một liều ChAdOx1 nCoV-19 / AZD1222, việc nhận vaccincó liên quan đến việc giảm 88% tỷ lệ nhập viện vì COVID-19 trong tuần thứ tư sau khi tiêm chủng [47].
- Hiệu quả chống lại các biến thể cần quan tâm có thể bị suy giảm. Trong một phân tích của một trong những thử nghiệm ngẫu nhiên, hiệu quả của vaccine chống lại COVID-19 có triệu chứng gây ra bởi Alpha (B.1.1.7), một biến thể vi rút đã nổi lên là biến thể thống trị ở Vương quốc Anh và đã được xác định ở các quốc gia khác, không khác biệt về mặt thống kê so với các biến thể khác (70 so với 82%), mặc dù cảm ứng hoạt động trung hòa thấp hơn so với biến thể Alpha [89]. Tuy nhiên, theo kết quả sơ bộ của thử nghiệm giai đoạn I / II ở Nam Phi, ChAdOx1 nCoV-19 / AZD1222 không làm giảm tỷ lệ COVID-19 từ nhẹ đến trung bình (ít nhất một triệu chứng nhưng không thở nhanh, thiếu oxy hoặc suy các cơ quan) trong một khung thời gian khi Beta (B.1.351) là biến thể thống trị được lưu hành [90]. Bởi vì thử nghiệm nhỏ và số trường hợp thấp, ước tính về hiệu quả của vaccine có khoảng tin cậy rất rộng (21,9%, 95% CI – 49,9 đến 59,8). Không thể đánh giá tác động đối với bệnh nặng, hiếm gặp ở dân số thử nghiệm trẻ, khỏe mạnh. Trong một nghiên cứu chưa được công bố từ Vương quốc Anh, ước tính hiệu quả chống lại nhiễm trùng có triệu chứng do Delta (B.1.617.2) gây ra là 67 phần trăm (95% CI 61-72) so với 75 phần trăm (95% CI 68-79) đối với
● An toàn và tác dụng phụ
- Trong các thử nghiệm ở giai đoạn trước, mệt mỏi, đau đầu và sốt là tương đối phổ biến sau khi nhận vaccinvà nghiêm trọng ở 8% số người nhận. Trong thử nghiệm pha III, có hai trường hợp viêm tủy cắt ngang ở những người nhận vaccin ChAdOx1 nCoV-19.
- Một trường hợp được cho là có thể liên quan đến việc tiêm phòng và được mô tả như là một sự khử men tủy sống vô căn, đoạn ngắn; bệnh còn lại là ở một người tham gia mắc bệnh đa xơ cứng chưa được phát hiện trước đó và được cho là không liên quan đến
- Thuốc chủng này cũng có thể liên quan đến một nguy cơ cực kỳ nhỏ của các biến cố huyết khối liên quan đến giảm tiểu cầu, điều này sẽ được thảo luận chi tiết ở phần khác.
* Vaccine AstraZeneca là vaccine vecto virus, bằng kỹ thuật gen di truyền một loại adenovirus cúm mùa thông thường trên loài tinh tinh. Các adenovirus này được can thiệp để không phát triển trong cơ thể người và có mang mã gen tổng hợp các protein gai S của SARS-CoV-2.
Khi được tiêm chủng, các adenovirus này sẽ sử dụng tế bào người tạo ra các protein gai S của SARS-CoV-2, các protein gai S đóng vai kháng nguyên kích thích hệ thống miễn dịch tạo kháng thể tương ứng. AstraZeneca là một trong những loại vaccine dễ phân phối nhất, vì nó không cần được bảo quản ở nhiệt độ quá lạnh, mà chỉ cần trữ trong các tủ lạnh thông thường.
4. Gam-COVID-Vac / Sputnik V (Viện Gamaleya)
- Khả năng sinh miễn dịch
- Đây là loại vaccine được phát triển ở Nga sử dụng hai vectơ adenovirus không có khả năng sao chép biểu hiện một glycoprotein gai có chiều dài đầy đủ (bảng 4). Vaccinđược tiêm bắp dưới dạng liều vectơ adenovirus 26 ban đầu, sau đó là liều thúc đẩy vectơ adenovirus 5 từ 21 ngày đến 3 tháng sau đó.
- Tính hiệu quả
- Vaccine này có sẵn ở Nga và một số quốc gia khác, bao gồm cả
- Trong một thử nghiệm ở giai đoạn I / II nhãn mở, không bị ung thư hóa, các đáp ứng miễn dịch tế bào và dịch thể SARS-CoV-2 đã được phát hiện ở những người tham gia.
- Theo phân tích tạm thời của một thử nghiệm giai đoạn III bao gồm hơn 000 người tham gia không có bằng chứng huyết thanh học về việc nhiễm SARS-CoV-2 trước đó, vaccine này có 91,6% (95% CI 85,6- 95,2) hiệu quả trong việc ngăn ngừa COVID-19 có triệu chứng bắt đầu từ 21 ngày sau liều đầu tiên (tại thời điểm của liều thứ hai). Hiệu quả này được đánh giá sau 78 trường hợp sử dụng COVID-19 (16 trong số 14.964 người tham gia được tiêm vaccine và 62 trong số 4902 người tham gia nhận được giả dược).
● An toàn và tác dụng phụ
- Tất cả 20 trường hợp COVID-19 nghiêm trọng xảy ra 21 ngày sau liều đầu tiên đều thuộc nhóm dùng giả dược. Thời gian theo dõi trung bình là 48 ngày sau liều đầu tiên. Các phản ứng giống cúm tại chỗ và toàn thân phổ biến hơn ở nhóm tiêm chủng, với tỷ lệ lần lượt là 15 và 5%. Không có tác dụng phụ nghiêm trọng nào được coi là liên quan đến vắc
6. WIV04 và HB02 (Sinopharm)
- Khả năng sinh miễn dịch
- Đây là vaccine toàn phần, bất hoạt dựa trên hai chủng SARS-CoV-2 khác nhau được phân lập từ các bệnh nhân ở Trung Quốc; chúng đều có một tá dược nhôm hydroxit. HB02 còn được gọi là BBIBP-CorV. Mỗi người được tiêm bắp hai liều cách nhau 28 ngày.
● Tính hiệu quả:
- Mỗi loại vaccine này đều tạo ra phản ứng kháng thể trung hòa và liên kết ở những người khỏe mạnh từ 18 đến 80 tuổi tham gia vào một số thử nghiệm ngẫu nhiên có đối chứng giả dược giai đoạn I / II; không có phản ứng nghiêm trọng nào được báo cáo. Hoạt động trung hòa do HB02 tạo ra bị giảm so với biến thể B.1.351 (Beta) [95]. Trong một thử nghiệm về hiệu quả giai đoạn III bao gồm gần 40.000 người tham gia mà không có bằng chứng về việc nhiễm SARS-CoV-2 trước đó, hiệu quả của vaccine bắt đầu từ 14 ngày sau khi tiêm chủng đầy đủ được ước tính là 73 phần trăm (95% CI 58-82) đối với WIV04 và 78 phần trăm (95 % CI 65-86) đối với HB02, mỗi loại được so sánh với giả dược chỉ có phèn.
●An toàn và tác dụng phụ
- Hiệu quả này được đánh giá sau 26, 21 và 95 trường hợp theo dõi WIV04, HB02 và giả dược tương ứng. Chỉ có hai trường hợp nghiêm trọng xảy ra, cả hai đều ở nhóm dùng giả dược. Các phản ứng toàn thân và tại chỗ tiêm xảy ra với tần suất tương tự ở cả ba nhóm (ví dụ: đau 20 đến 27 phần trăm, đau đầu 13 phần trăm, mệt mỏi 11 phần trăm). Các loại vaccine này có sẵn ở Trung Quốc và một số quốc gia khác, bao gồm Các Tiểu vương quốc Ả Rập Thống nhất và Hungary.
* Vaccine Vero Cell, Sinopharm (Trung Quốc) là vaccine bất hoạt, sử dụng các xác các virus SARS-CoV-2 đã bị giết chêt không thể gây bệnh làm kháng nguyên. Về lý thuyết, đây là phương cách kinh điển nhất để phát triển vaccin.
Do đó, một số chuyên gia hy vọng các vaccine Trung Quốc sẽ là một mắc xích trong việc giải quyết tình trạng khan hiếm vaccine COVID-19 trên toàn cầu.
Vero Cell cũng được cho là hiệu quả ngừa bệnh đến 78,2%, và được khuyến cáo có thể tiêm cho người 18 tuổi trở lên. Tuy nhiên, những dữ liệu thử nghiệm lâm sàng để đánh giá chưa được công bố đầy đủ. Hơn nữa, dù được phát triển theo công nghệ cổ điển nhưng giá thành khá cao [4].
7. CoronaVac (Sinovac)
- Khả năng sinh miễn dịch
– Loại vaccinCOVID-19 bất hoạt này được phát triển ở Trung Quốc; nó có chất bổ trợ nhôm hydroxit. Vaccine được tiêm bắp làm hai liều cách nhau 28 ngày. Trong các thử nghiệm ngẫu nhiên có đối chứng với giả dược ở pha I / II, vaccine này tỏ ra an toàn và có khả năng sinh miễn dịch ở những người khỏe mạnh từ 18 đến 59 tuổi cũng như những người từ 60 tuổi trở lên. Hoạt động trung hòa chống lại biến thể
B.1.351 (Beta) bị giảm.
· Tính hiệu quả
- Theo kết quả tạm thời của một thử nghiệm giai đoạn III với 10.000 người tham gia ở Thổ Nhĩ Kỳ mà không có bằng chứng về việc nhiễm SARS-CoV-2 trước đó, hiệu quả của vaccine bắt đầu từ 14 ngày sau khi tiêm chủng đầy đủ là 83,5% (KTC 95% 65,4–92,1); tuy nhiên, tỷ lệ hiệu quả thấp hơn đã được báo cáo trong các thông cáo báo chí về các thử nghiệm ở các quốc gia khác
· An toàn và tác dụng phụ
- Trong một nghiên cứu quan sát bao gồm hơn 10 triệu người ở Chile, ước tính hiệu quả của vaccinlà 70% để ngăn ngừa COVID-19 và 86 đến 88% để ngăn nhập viện hoặc tử vong [100]; một nghiên cứu tiếp theo ở Brazil đã
báo cáo hiệu quả vaccine thấp hơn ở người lớn trên 70 tuổi trong bối cảnh biến thể Gamma phổ biến (47, 56 và 61% chống lại COVID-19, nhập viện và tử vong, tương ứng). Loại vaccinnày có sẵn ở Trung Quốc và một số quốc gia khác, bao gồm Brazil, Chile, Indonesia, Mexico và Thổ Nhĩ Kỳ.
8. Covaxin (Bharat Biotech / Hội đồng Nghiên cứu Y khoa Ấn Độ)
- Khả năng sinh miễn dịch
– VaccinCOVID-19 bất hoạt này đã được phát triển và đang được sử dụng ở Ấn Độ; nó có một hydroxit nhôm và một chất bổ trợ chất chủ vận thụ thể giống như thụ thể. Nó được tiêm bắp làm hai liều cách nhau 29 ngày. Trong thử nghiệm đối chứng ngẫu nhiên giai đoạn I, vaccine này tỏ ra an toàn và có khả năng sinh miễn dịch ở những người khỏe mạnh từ 18 đến 55 tuổi.
· Tính hiệu quả
- Huyết thanh từ những người nhận vaccincũng vô hiệu hóa các biến thể 1.617 phổ biến ở Ấn Độ, nhưng ở hiệu giá thấp hơn so với quan sát với vi rút kiểu hoang dã.
· An toàn và tác dụng phụ
- Dữ liệu từ các thử nghiệm hiệu quả chưa được công bố; một thông cáo báo chí cho biết tỷ lệ hiệu quả là 81% đối với COVID-19 có triệu chứng ở những người không bị nhiễm trùng trước đó sau khi phân tích tạm thời 43 trường hợp trong số 25.800 người tham gia (36 trường hợp với giả dược và 7 với vắc xin); các chi tiết thử nghiệm cần thiết cho việc đánh giá quan trọng các kết quả này vẫn chưa được công
9. NVX-CoV2373 (Novavax)
Theo thống kê của WHO, cho đến tháng 7/2021 hiện có 330 loại vaccine ngừa COVID- 19 đang được thử nghiệm tiền lâm sàng trên động vật và lâm sàng trên người. Tại Việt Nam, công ty Nanogen đang nghiên cứu sản xuất vaccine Nanocovax, với dự kiến sẽ xin sử dụng khẩn cấp vào cuối năm 2022.
· Khả năng sinh miễn dịch
- Đây là vaccine hạt nano protein tái tổ hợp bao gồm glycoprotein nhọn trimeric và tá dược Matrix-M1 mạnh.
· Tính hiệu quả
- Trong một thông cáo báo chí liên quan đến thử nghiệm hiệu quả giai đoạn III ở Hoa Kỳ và Mexico, NVX-CoV2373 có 90,4 phần trăm (95% CI 82,9-94,6) hiệu quả trong việc ngăn ngừa COVID-19 có triệu chứng bắt đầu vào hoặc sau bảy ngày sau liều thứ hai trong huyết thanh âm tính cá nhân; trong số hơn người từ 18 đến 84 tuổi, có 14 trường hợp so với 63 trường hợp ở nhóm vaccine và giả dược.
· An toàn và tác dụng phụ
– Bốn trường hợp nghiêm trọng xảy ra ở nhóm dùng giả dược. Hiệu quả vaccintương tự (89,7 phần trăm, 95% CI 80,2-94,6) đã được báo cáo trong một thử nghiệm giai đoạn III ở Vương quốc Anh với khoảng 14.000 người tham gia.Thuốc chủng ngừa này vẫn chưa có sẵn.
KẾT LUẬN
COVID-19 là đại dich toàn cầu với hàng trăm triệu người nhiểm và hàng triệu người tử vong. Đại dịch đã ảnh hưởng nặng nề đến mọi mặt đời sống vật chất, tinh thần xã hội của con người trên toàn thế giới. Để kiểm soát đại dịch vai trò tiêm chủng vaccine là vũ khí căn bản, hiệu quả và và lâu dài. Tiêm vaccine ngừa COVID-19 là cách gây miễn dịch chủ động, mang lại 3 lợi ích: Tạo hàng rào bảo vệ ngăn SARS-CoV-2 thâm nhập; Giảm mức độ trầm trọng của bệnh; và Giảm lây truyền virus cho người khác, giảm tốc độ lây nhiễm trong cộng đồng. Tất cả vaccine đều có thể có, nhưng cực hiếm, các tác dụng không mong muốn (indesirable effect).
Nhưng những khảo sát khoa học đa trung tâm, đa quốc gia, các chuyên gia khẳng định lợi ích quá lớn, gấp cả ngàn lần, so với nguy cơ. Do đó, chúng ta nên thông hiểu để đồng thuận, hợp tác với chính quyền, ngành y tế tham gia tiêm vaccine theo lịch.
Không có vaccine nào công hiệu 100%, cũng như kháng thể cũng có thời gian lưu hành nhất định trong máu, nghĩa là có thể mắc bệnh dù đã tiêm vaccine cũng như có thể tái nhiễm SARS-CoV-2 một thời gian sau khi
lành COVID-19. Mặc dù vaccine phòng Covid 19 là giải pháp chống dịch hiệu quả hiện nay, nhưng chúng ta cũng không nên chủ quan.
Do đó, trong khi đại dịch còn đang lưu hành ngoài vaccine chúng ta cần thực hành 5K thường xuyên và luôn giữ cơ thể có hệ miễn dịch thật tốt.
TÀI LIỆU THAM KHẢO
- COVID-19 https://en.wikipedia.org/wiki/COVID- 19_vaccin
- Coronavirus cases, https://www.worldometers.info/coronavir us/
- SARS-CoV-2 Variant Classifications and Definitions. https://www.cdc.gov/coronavirus/2019- ncov/variants/variant-info.html
- Centers for diease control and prevention, SARS-CoV-2 Variant Classifications and Definitions, Updated Sept. 23, 2021
- Types of vaccins for COVID- https://www.immunology.org/coronavi rus/connect-coronavirus-public- engagement-resources/types-vaccins-for- covid-19.
- CTV News. (2021). “Sinovac vaccine restores a Brazilian city to near normal”.
- Pfizer-BioNTech COVID-19 Vaccine EUA Fact Sheet for Recipients and EUA 20734_VI FS for Recipients_Pfizer- BioNTech COVID-19 Vaccin_FINAL_22Sep2021 (2).pdf
- Annelies Wilder‑Smith, D., Ph.D., and Kim Mulholland, M.B., B.S., M.D.(2021, September 2). The new England Journal of Medicine: effectiveness of an inactivated SARS-CoV-2 vaccin, september 2, 2021). https://www.nejm.org/doi/full/10.1056/NEJM e2111165
- Jara A, Undurraga Annelies Wilder‑Smith, M.D., Ph.D., and Kim Mulholland, M.B., B.S., M.D. (2021).The new England Journal of Medicine: effectiveness of an inactivated SARS-CoV-2 vaccin, september 2, https://www.nejm.org/doi/full/10.1056/NEJ Me2111165
- Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC.(2020). Pathophysiology, transmission, diagnosis, and treatment of coronavirus disease 2019 (COVID-19): a JAMA;324:782-93.
- Verity R, Okell LC, Dorigatti I, et al.(2020). Estimates of the severity of coronavirus disease 2019: a model-based analysis. Lancet Infect Dis;20:669-77.
- Guan W-J, Ni Z-Y, Hu Y, et al. (2020). Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med;382:1708-20.
- Li Y, Campbell H, Kulkarni D, et al.(2021). The temporal association of introducing and lifting non- pharmaceutical interventions with the time-varying reproduction number (R) of SARS-CoV-2: a modelling study across 131 countries. Lancet Infect Dis ;21:193- 202.
- Walker PGT, Whittaker C, Watson OJ, et al.(2020). The impact of COVID-19 and strategies for mitigation and suppression in lowand middle-income countries. Science;369:413-22.
- Ledford H, Cyranoski D, Van Noorden R.(2020). The UK has approved a COVID vaccine — here’s what scientists now want to know. Nature;588:205-6.
- Polack FP, Thomas SJ, Kitchin N, et al. (2020). Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccin. N Engl J Med;383:2603-15.
- Zimmer C, Corum J, Wee S-L. Coronavirus vaccine tracker. New York (2021, June 10). https://www.nytimes.com/ interactive/2020/science/coronavirus – vaccin-tracker.html.
- Recommendation for an emergency use listing of Covid-19 vaccine (Vero cell). (June 28, 2021), inactivated — submitted by Sinovac. Geneva: World Health Organization.
- Lim WW, Mak L, Leung GM, Cowling BJ, Peiris M. (2021 July 15).Comparative immunogenicity of mRNA and inactivated vaccins against COVID-19. Lancet Microbe (Epub ahead of print).
- The Wall Street Journal. (2021). “Brazil’s Experiment to Vaccinate Town With Chinese CoronaVac Reduced Covid-19 Deaths by 95%”. ISSN 0099-9660.
- (2021).“China Sinovac Shot Seen Highly Effective in Real World Study”.
- Srinivasulu Yerukala Sathipati and Shinn- Ying Ho* (2021), Identification and Characterization of Species-Specific Severe Acute Respiratory Syndrome Coronavirus 2 Physicochemical Properties
- World health Organization, Coronavirus disease (COVID-19): How is it transmitted?.Updated on 30 April
- Tanne Covid-19: FDA panel votes to approve Pfizer BioNTech vaccin. BMJ 2020;371:m4799.
- Emergency Use Authorization (EUA) of the Pfizer-BioNTech COVID-19 Vaccine to Prevent Coronavirus. Fact sheet for healthcare providers administering https://www.fda.gov/media/144413/downl oad (Accessed on August 23, 2021).
- Emergency Use Authorization (EUA) of the Moderna COVID-19 Vaccine to prevent Coronavirus Disease 2019 (COVID-19). Factsheet for healthcare providers administering vaccine. https://fda.gov/media/144637/downl oad?utm_medium=email&utm_source=g ovdelivery (Accessed on August 23, 2021).
- Self WH, Tenforde MW, Rhoads JP, et al. Comparative Effectiveness of Moderna, Pfizer-BioNTech, and Janssen (Johnson & Johnson) Vaccines in Preventing COVID- 19 Hospitalizations Among Adults Without Immunocompromising Conditions — United States, March–August 2021. MMWR Morb Mortal Wkly
- Thompson MG, Stenehjem E, Grannis S, et al. Effectiveness of Covid-19 Vaccines in Ambulatory and Inpatient Care Settings. N Engl J Med 2021.
- Grannis SJ, Rowley EA, Ong TC, et al. Interim Estimates of COVID-19 Vaccine Effectiveness Against COVID-19- Associated Emergency Department or Urgent Care Clinic Encounters and Hospitalizations Among Adults During SARS-CoV-2 B.1.617.2 (Delta) Variant Predominance – Nine States, June-August MMWR Morb Mortal Wkly Rep 2021; 70:1291.
- Chapin-Bardales J, Gee J, Myers Reactogenicity Following Receipt of mRNA-Based COVID-19 Vaccines. JAMA 2021; 325:2201.
- Centers for Disease Control and Prevention (CDC). Syncope after vaccination–United States, January 2005- July 2007. MMWR Morb Mortal Wkly Rep 2008; 57:457.
- Shimabukuro COVID-19 vaccine safety update, Advisory Committee on Immunization Practices (ACIP) meeting, January 27,2021. https://www.cdc.gov/vaccines/acip/meetin gs/downloads/slides-2021-01/06-COVID- Shimabukuro.pdf (Accessed on January 28, 2021).
- Gee J, Marquez P, Su J, et al. First Month of COVID-19 Vaccine Safety Monitoring – United States, December 14, 2020-January 13, 2021. MMWR Morb Mortal Wkly Rep 2021; 70:283.
- United Kingdom Medicines and Healthcare products Regulatory UK medicines regulator gives approval for first UK COVID-19 vaccine. https://www.gov.uk/government/news/uk- medicines-regulator-gives-approval-for- first-uk-covid-19-vaccine (Accessed on December 02, 2020).
- Pfizer-BioNTech COVID-19 vaccine: Authorization information. https://www.canada.ca/en/health- canada/services/drugs-health- products/covid19-industry/drugs-vaccines-treatments/vaccines/pfizer- biontech/authorization.html (Accessed on December 09, 2020).
- European Medicines EMA recommends first COVID-19 vaccine for authorisation in the EU. https://www.ema.europa.eu/en/news/ema- recommends-first-covid-19-vaccine- authorisation-eu (Accessed on January 04, 2021).
- Walsh EE, Frenck RW Jr, Falsey AR, et al. Safety and Immunogenicity of Two RNA- Based Covid-19 Vaccine Candidates. N Engl J Med 2020; 383:2439.
- Frenck RW Jr, Klein NP, Kitchin N, et al. Safety, Immunogenicity, and Efficacy of the BNT162b2 Covid-19 Vaccine in Adolescents. N Engl J Med 2021; 385:239.
- Zhou D, Dejnirattisai W, Supasa P, et al. Evidence of escape of SARS-CoV-2 variant B.1.351 from natural and vaccine- induced sera. Cell 2021; 184:2348.
- Wall EC, Wu M, Harvey R, et al. Neutralising antibody activity against SARS-CoV-2 VOCs 1.617.2 and B.1.351 by BNT162b2 vaccination. Lancet 2021; 397:2331.
- Planas D, Veyer D, Baidaliuk A, et al. Reduced sensitivity of SARS-CoV-2 variant Delta to antibody neutralization. Nature 2021; 596:276.
- Tada T, Dcosta BM, Samanovic MI, et al. Convalescent-Phase Sera and Vaccine- Elicited Antibodies Largely Maintain Neutralizing Titer against Global SARS- CoV-2 Variant mBio 2021; 12:e0069621.
- Edara VV, Pinsky BA, Suthar MS, et al. Infection and Vaccine-Induced Neutralizing- Antibody Responses to the SARS-CoV-2 1.617 Variants. N Engl J Med 2021; 385:664.
- FDA Briefing Document. Pfizer- BioNTech COVID-19 Vaccine. Vaccines and Related Biological Products Advisory Committee Meeting. December 10, 2020 https://fda.gov/media/144245/download (Accessed on December 09, 2020).
- Polack FP, Thomas SJ, Kitchin N, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med 2020; 383:2603.
- Haas EJ, Angulo FJ, McLaughlin JM, et Impact and effectiveness of mRNA BNT162b2 vaccine against SARS-CoV-2 infections and COVID-19 cases, hospitalisations, and deaths following a nationwide vaccination campaign in Israel: an observational study using national surveillance data. Lancet 2021; 397:1819.
- Vasileiou E, Simpson CR, Shi T, et al. Interim findings from first-dose mass COVID-19 vaccination roll-out and COVID-19 hospital admissions in Scotland: a national prospective cohort Lancet 2021; 397:1646.
- Dagan N, Barda N, Kepten E, et al. BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Mass Vaccination N Engl J Med 2021; 384:1412.
- Hall VJ, Foulkes S, Saei A, et al. COVID-19 vaccine coverage in health-care workers in England and effectiveness of BNT162b2 mRNA vaccine against infection (SIREN): a prospective, multicentre, cohort study. Lancet 2021; 397:1725.
- Amit S, Regev-Yochay G, Afek A, et al. Early rate reductions of SARS-CoV-2 infection and COVID-19 in BNT162b2 vaccine recipients. Lancet 2021; 397:875.
- Rinott E, Youngster I, Lewis YE. Reduction in COVID-19 Patients Requiring Mechanical Ventilation Following Implementation of a National COVID-19 Vaccination Program – Israel, December 2020-February 2021. MMWR Morb Mortal Wkly Rep 2021; 70:326.
- Britton A, Jacobs Slifka KM, Edens C, et Effectiveness of the Pfizer-BioNTech COVID-19 Vaccine Among Residents of Two Skilled Nursing Facilities Experiencing COVID-19 Outbreaks – Connecticut, December 2020-February 2021. MMWR Morb Mortal Wkly Rep 2021; 70:396.
- Benenson S, Oster Y, Cohen MJ, Nir-Paz
- BNT162b2 mRNA Covid-19 Vaccine Effectiveness among Health Care Workers. N Engl J Med 2021; 384:1775.
- Tenforde MW, Olson SM, Self WH, et al. Effectiveness of Pfizer-BioNTech and Moderna Vaccines Against COVID-19 Among Hospitalized Adults Aged ≥65 Years – United States, January-March MMWR Morb Mortal Wkly Rep 2021; 70:674.
- Butt AA, Omer SB, Yan P, et al. SARS- CoV-2 Vaccine Effectiveness in a High- Risk National Population in a Real-World Setting. Ann Intern Med
- Chodick G, Tene L, Patalon T, et al. Assessment of Effectiveness of 1 Dose of BNT162b2 Vaccine for SARS-CoV-2 Infection 13 to 24 Days After Immunization. JAMA Netw Open 2021; 4:e2115985.
- Chung H, He S, Nasreen S, et al. Effectiveness of BNT162b2 and mRNA- 1273 covid-19 vaccines against symptomatic SARS-CoV-2 infection and severe covid-19 outcomes in Ontario, Canada: test negative design BMJ 2021; 374:n1943.
- Abu-Raddad LJ, Chemaitelly H, Butt AA, National Study Group for COVID-19 Effectiveness of the BNT162b2 Covid-19 Vaccine against the B.1.1.7 and B.1.351 Variants. N Engl J Med 2021; 385:187.
- Lopez Bernal J, Andrews N, Gower C, et Effectiveness of Covid-19 Vaccines against the B.1.617.2 (Delta) Variant. N Engl J Med 2021; 385:585.
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam