QUẢN LÝ BỆNH NHÂN ĐÁI THÁO ĐƯỜNG TRONG ĐẠI DỊCH COVID-19
GS.TS.GVCC. Nguyễn Hải Thủy
Trường Đại học Y Dược Huế
DOI: 10.47122/vjde.2021.50.16
SUMMARY
Management of diabetic patients during the COVID-19 pandamic
Diabetes mellitus (DM) and/or Hyperglycemia are noted in approximately 30%–40% of patients admitted with COVID- 19 infections. COVID-19 might either induce new onset diabetes or unmask previously undiagnosed diabetes, so all patients diagnosed with COVID-19 must get screening blood glucose measurement. Besides several risk factors including older age, a proinflammatory and hypercoagulable state and underlying comorbidities (hypertension, cardiovascular disease, chronic kidney disease and obesity). Hyperglycemia ( before hospital admission, at the time of hospitalistion and during in hospital stay) are considered the most important risk factors for a severe course of COVID-19. Treatment with steroids, can have a specific negative impact on diabetes itself, leading to worsening of hyperglycemia through increased insulin resistance and reduced beta-cell secretory function. Antidiabetic drugs that can reduce inflammatory processes and achieve good glycemic control are ideal. Insulin is of special importance in managing COVID-19 patients with diabetes, especially those who have hyperglycemic emergencies or in ICU admission. These findings provide clinical evidence correlating improved glycemic control with better outcomes in diabetic patients with COVID-19 infections.
Keywords: diabetes mellitus , COVID-19, SARS-CoV-2, glycemic control, outcomes
Tác giả liên hệ: Nguyễn Hải Thủy Email: [email protected] Ngày nhận bài: 01/11/2021
Ngày phản biện khoa học: 10/11/2021
Ngày duyệt bài: 15/12/2021
ĐẶT VẤN ĐỀ
Bệnh Coronavirus-19 (Coronavirus Disease 2019: COVID-19 ) do Coronavirus 2 gây ra hội chứng suy hô hấp cấp tính nghiêm trọng (Severe Acute Respiratory Syndrome Coronavirus 2: SARS-CoV-2 ) đã và đang gây nguy hại đến tính mạng của hàng trăm triệu bệnh trên toàn thế giới. Theo số liệu của Tổ Chức Y tế Thế Giới ( WHO) tính đến đến ngày 16/11/2021 có trên 252 triệu người nhiểm COVID-19 trong đó số đó có trên 5 triệu người đã tử vong ( bảng 1).
Sự bùng phát của đại dịch COVID-19 là tình trạng khẩn cấp về sức khỏe cộng đồng được quốc tế quan tâm hiện nay nhất là những đối tượng có bệnh nền trong đó phải kể đến bệnh nhân đái tháo đường (ĐTĐ). Thật vậy MicroRNA là một chất liên quan đến điều hòa biểu hiện gen, đóng một vai trò quan trọng trong phản ứng viêm và miễn dịch. Micro RNA có thể ức chế có hiệu quả sự sao chép của SARS-CoV-2 bằng cách nhắm mục tiêu trực tiếp vào protein S. Nghiên cứu từ Đại học Nam Kinh ở Trung Quốc (17/8/2021) đã xác định được 4 microRNA đang lưu hành (miR- 7-5p, miR-24-3p, miR-145-5p và miR-223- 3p). Qua nghiên cứu này đã ghi nhận hàm lượng cao miRRNA ở những người khỏe mạnh, đặc biệt trên đối tượng tập thể dục liên tục có thể tăng cường miễn dịch miRNA chống lại SARS-CoV-2. Trong khi đó nồng độ miRRNA thấp hơn nhiều gặp ở người lớn tuổi và bệnh nhân đái tháo đường. Qua đó các nhà khoa học cũng đã xác định nồng độ thấp microRNA (miRNA) ở người lớn tuổi và những người mắc bệnh ĐTĐ đã làm tăng nguy cơ nhiễm và tiến triễn nặng khi bị nhiểm COVID-19.
Bảng 1. Số liệu của Tổ chức Y Tế Thế giới về số bệnh nhân nhiểm và tử vong do COVID 19 tính đến 14/11/2021 trên toàn thế giới (Newly reported and cumulative COVID-19 cases and deaths, by WHO Region, as of 14 November 2021**)
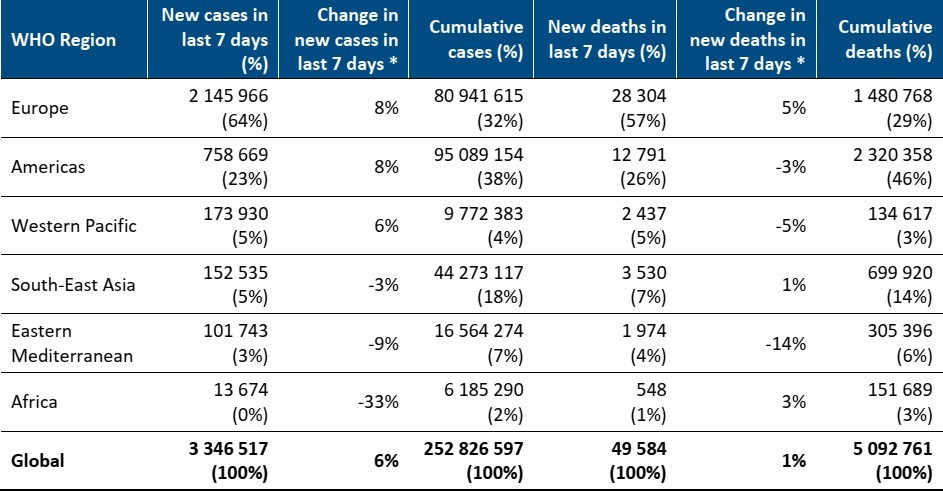
Theo nhiều thống kê ghi nhận số bệnh nhân tăng đường huyết và ĐTĐ bị nhiểm COVID-19 có tỷ lệ 30-40 % và chiếm tỷ lệ cao ở nhóm bệnh nhân COVID-19 giai đoạn nguy kịch.
Vì vậy việc sàng lọc tăng glucose máu và quản lý những người mắc bệnh ĐTĐ trong cộng đồng, trong khu vực cách ly và nhất là tại bệnh viện cần được tối ưu hóa để giảm thiểu nguy cơ trên đối tượng này.
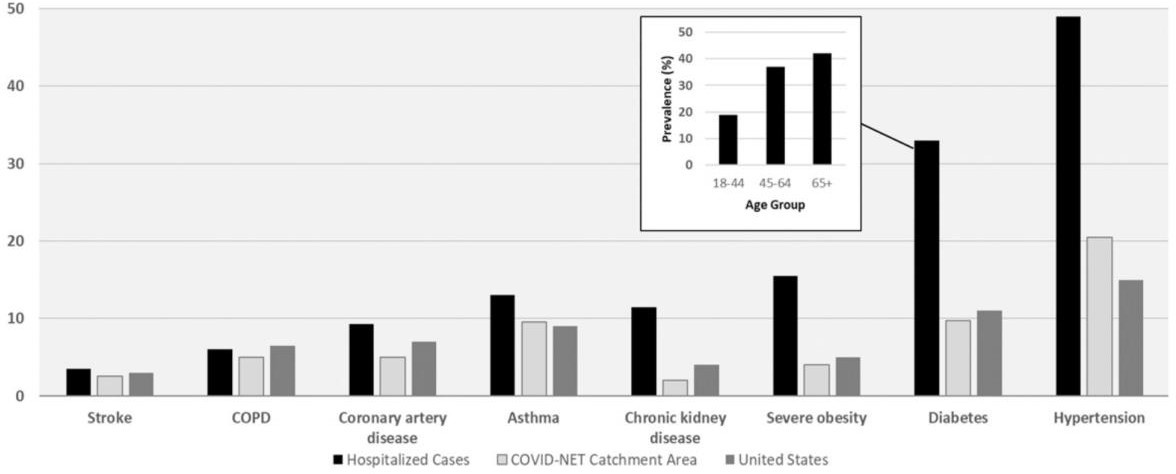
Sơ đồ 1. Bệnh nhân ĐTĐ người cao tuổi chiếm tỷ lệ trên đối tượng nhiểm COVID-19
Đối với những người mắc bệnh ĐTĐ nhiểm COVID-19 cần theo dõi để xác định nhanh chóng và ngăn ngừa tình trạng xấu đi, kết hợp kiểm soát đường huyết chặt chẽ để ngăn ngừa các biến chứng cấp tính như nhiễm toan ceton ĐTĐ (DKA), trạng thái tăng thẩm thấu ĐTĐ (HHS) hoặc hạ đường huyết do điều trị.
Điều này liên quan đến sự điều chỉnh liều lượng thuốc hiện tại của bệnh nhân, ngừng một số loại thuốc viên hạ đường huyết hoặc chuyển sang liệu pháp insulin phóng-nền (basal plus hoặc basal bolus) hoặc truyền insulin tĩnh mạch cho những bệnh nhân nặng và kiểm soát đường huyêt kém. Vì vậy vai trò của kiểm soát tăng đường huyết những người bệnh ĐTĐ mắc COVID-19 có vai trò quan trọng trong việc giảm thiểu bất kỳ nguy cơ tiềm ẩn nào trên bệnh nhân nhiểm CoviD-19 là những vấn đề liên quan trong bài viết này.
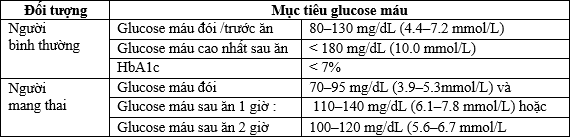
1. Mục tiêu kiểm soát đường huyết trước nhập viện
Bảng 2. Mục tiêu kiểm soát đường huyết (VADA 2020 và ADA 2021)
Bảng 3. Mục tiêu đường huyết ở người bệnh ĐTĐ cao tuổi ( VADA 2020 và ADA 2021)
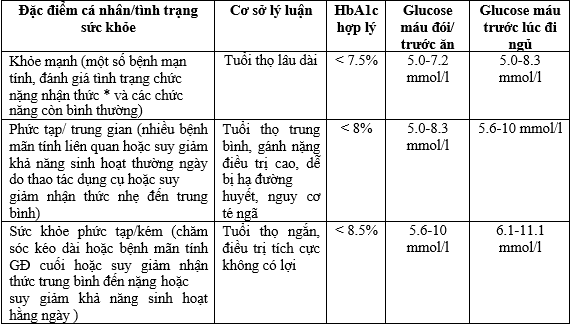
- Đánh giá chức năng nhận thức theo THANG ĐIỂM ĐÁNH GIÁ TÂM THẦN TỐI THIỂU ( MMSE= Mini- Mental State Examination) trong đó không suy giảm chức năng nhận thức ( ≥ 24 điểm), nhẹ (20-23 điểm), trung bình (14-19 điểm) và nặng (0-13 điểm) Chuyển đổi glucose máu :
- mg/dl sang mmol/l: mmol/l = mg/dl : 18
- mmol/l sang mg/dl: mg/dl = 18 x mmol/l
2. Sàng lọc tăng glucose máu và đái tháo đường khi vào viện
Các điểm quan trọng:
- Kiểm tra glucose máu tất cả bệnh nhân nhiểm COVID-19 ngay khi nhập viện (nhất là đối tượng nguy cơ như thừa cân, trên 45 tuổi, rối loạn lipid máu, bệnh tim mạch..) ít nhất hai lần bằng glucose huyết tương mao mạch (1 lần trước bữa ăn và 1 lần sau bữa ăn) bằng máy đo đường huyết cá nhân.
- Bệnh nhân bị đái tháo đường (ĐTĐ) nên bắt đầu chế độ ăn dành cho người đái tháo đường. Bệnh nhân cần đảm bảo về tuân thủ nghiêm ngặt về thời gian và số lượng được khuyến cáo trong biểu đồ ăn cho bệnh nhân đái tháo đường.
Bảng 4. Sàng lọc tăng glucose máu ở bệnh nhân COVID 19 nhập viện
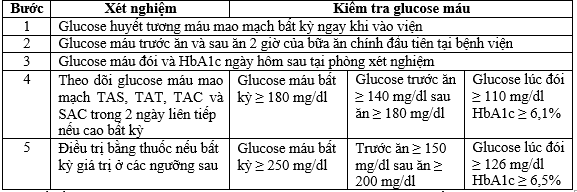
Chữ viết tắt : TAS (trước ăn sáng), TAT(trước ăn trưa), TAC (trước ăn chiều) và SAC (sau ăn chiều) Chuyển đổi glucose máu :
mg/dl sang mmol/l: mmol/l = mg/dl : 18
mmol/l sang mg/dl: mg/dl = 18 x mmol/l
- Đề xuất ba bước (Bước 3 nếu có các phòng thí nghiệm) để sàng lọc tình trạng tăng đường huyết chưa được chẩn đoán trong 24 giờ đầu nhập viện.
- Nếu Glucose máu ≥250 mg/dl, kiểm tra nồng độ ceton trong nước tiểu / máu → nếu dương tính, lập tức mời tư vấn chuyên gia /bác sĩ nội tiết.
- Bắt đầu “Chế độ ăn kiêng dành cho người ĐTĐ” nếu các giá trị cao hơn mức giới hạn được đưa ra trong bước 4.
- Bắt đầu “Liệu pháp dùng thuốc ” nếu các giá trị glucose máu cao hơn giới hạn được đưa ra trong bước
- Glucose máu đói ≥126 mg / dl và / hoặc HbA1c ≥6,5% (giá trị phòng thí nghiệm) được chẩn đoán bệnh Đái tháo đường.
Bảng 5. Các thuốc gây tăng glucose máu
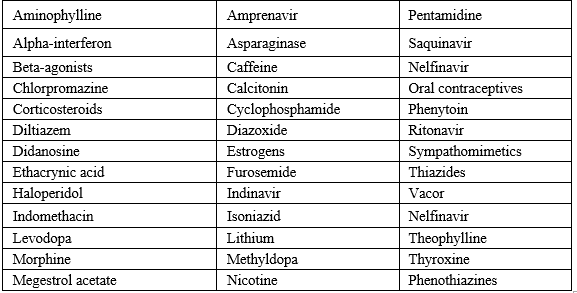
Nên xem xét việc kiểm tra glucose máu lặp lại ngay cả khi glucose máu ban đầu là bình thường trong một số tình huống sau đây:
- Bệnh nhân được chỉ định sử dụng steroid hoặc các thuốc có khả năng ảnh hưởng đến tình trạng đường huyết (Bảng 4) được bắt đầu, và
- Có sự gia tăng mức độ nghiêm trọng của COVID-19 (tăng đường huyết do stress).
Coppelli và cộng sự đã ghi nhận mối liên quan với tỷ lệ tử vong ở những bệnh nhân nhập viện nhiểm COVID-19 trong đó Glucose máu bất kỳ ≥ 140 mg/dl có tỷ lệ 24,3% bệnh nhân.
Tỷ lệ tử vong ở bệnh nhân glucose bất kỳ ≥ 140 mg/ dl (39,4% với HR 2,20, p= 0,005) so với bệnh nhân Glucose bất kỳ <140 mg / dl ( 16,8%) và thậm chí cao hơn so với những bệnh nhân ĐTĐ từ trước (28,6%; HR=1,73, p = 0,086).
Bảng 6. Theo dõi glucose máu đối tượng không có minh chứng tăng glucose máu do Stress hoặc ĐTĐ chưa được chẩn đoán khi sàng lọc ban đầu

Chữ viết tắt: TAS (trước ăn sáng), TAT (trước ăn trưa), TAC (trước ăn chiều), SAC (sau ăn chiều)
- Bệnh nhân có glucose máu ban đầu bình thường nhưng có thể bị tăng đường huyết do stress trong quá trình bị bệnh, đặc biệt nếu mức độ nghiêm trọng của COVID tăng lên.
Bên cạnh đó, việc sử dụng glucocorticoid để điều trị bệnh nguyên phát cũng có thể góp phần làm tăng đường huyết ở những người như vậy. Do đó, trong quá trình nằm viện việc đánh giá đường huyết không nên thực hiện một lần mà phải thực hiện liên tục.
3. Đánh giá giai đoạn lâm sàng của Nhiểm COVID-19
Đánh giá giai đoạn lâm sàng quan trọng trong chọn thuốc điều trị , mục tiêu kiểm soát đường máu cũng như quy trình theo dõi . Tuy nhiên hiện vẫn chưa có sự thống nhất về phân loại lâm sàng của COVID-19. Một nghiên cứu lâm sàng lớn đầu tiên đã phân loại thành bệnh nặng và không-nặng (Guan 2020), theo Hướng dẫn chẩn đoán và điều trị viêm phổi cộng đồng ở người lớn, được xuất bản bởi Hiệp Hội Lồng Ngực Hoa Kì và Hiệp Hội Bệnh Truyền Nhiễm Hoa Kì (Metlay 2019). Trong các định nghĩa được chấp nhận, bệnh được xem là nặng khi có 1 trong 2 tiêu chuẩn chính hoặc 3 tiêu chuẩn phụ trở lên trong đó tiêu chuẩn phụ bao gồm nhịp thở >30 lần/phút, tỷ lệ PaO2/FIO2 < 250, thâm nhiễm nhiều tiểu thùy, lú lẫn/mất phương hướng, tăng urê máu, giảm bạch cầu, giảm số lượng tiểu cầu, hạ thân nhiệt, hạ huyết áp cần hồi sức tích cực. Tiêu chí chính bao gồm sốc nhiễm trùng cần dùng thuốc vận mạch hoặc suy hô hấp yêu cầu thở máy
Trong báo cáo của CDC Trung Quốc, có sự tương đồng trong sử dụng các tiêu chuẩn phân loại mức độ nặng của bệnh (Wu 2020) mặc dù một số tác giả đã gộp mức độ số 1 và 2. Theo báo cáo này, có 81% trường hợp nhẹ và trung bình, 14% trường hợp nặng và 5% trường hợp nguy kịch. Trong khi đó các báo cáo sơ bộ từ Viện Y tế quốc gia Italia cho thấy 24.9% là nặng và 5.0% nguy kịch (Livingston 2020). Tuy nhiên, các con số này được cho là đánh giá quá cao gánh nặng bệnh tật, so với số lượng rất ít các trường hợp được chẩn đoán tại Italia vào thời điểm đó. Trong bài viết này tôi chọn phân loại của Wang ( 2020) vừa đơn giãn và phù hợp với bác sĩ nội tiết với phân loại như sau ( Bảng 6)
Bảng 7. Phân giai đoạn lâm sàng nghiểm COVID-19 theo Wang (2020)

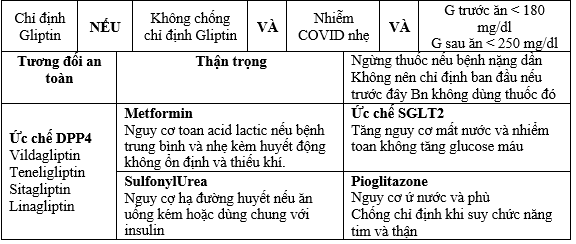
4. Chi định sử dụng thuốc uống hạ đường huyết (OAD)
Bệnh nhân ĐTĐ từ trước và đang dùng OAD khi nhập viện
Tiếp tục OAD liều hiện tại nếu tất cả các tiêu chí được đề cập dưới đây được đáp ứng:
+ Glucose máu được kiểm soát (Trước bữa ăn <140 mg/ dl và sau bữa ăn <180 mg / dl).
+ Bệnh nhân còn nhận thức, định hướng và chấp nhận ăn uống; Các triệu chứng nhiểm COVID nhẹ; Chức năng thận và chức năng gan bình thường.
Nếu bệnh nhân không đáp ứng tất cả các tiêu chí trên. Cần tham khảo ý kiến bác sĩ / bác sĩ nội tiết để bắt đầu sử dụng phác đồ insulin phóng- nền hoặc truyền insulin tĩnh mạch tùy thuộc vào nồng độ Glucose máu.
Bắt đầu OAD ở những bệnh nhân được phát hiện ĐTĐ lần đầu tiên lúc nhập viện
(G trước bữa ăn: 150 -180 mg/dl và/hoặc sau bữa ăn BG 200- 250 mg/dl).
*Tham khảo ý kiến bác sĩ / bác sĩ Nội tiết sớm nhất để bắt đầu hoặc tối ưu hóa liều OAD
**.Trong khi chờ đợi ý kiến nên bắt đầu sử dụng Metformin (phóng thích nhanh hoặc chậm) 500 mg/2 lần/ngày và nhóm Gliptin (Vildagliptin 50 mg/2 lần/ngày hoặc Sitagliptin 100 mg /ngày hoặc Linagliptin 5 mg/ngày hoặc Teneligliptin 20 mg/ngày) với điều kiện bệnh nhân đáp ứng tất cả các tiêu chí sau đây: Đường huyết trước bữa ăn 150- 180 mg dl và/ hoặc đường huyết sau ăn từ 200-250 mg/dl.
Nếu nồng độ G lúc nhập viện cao hơn phạm vi được đề cập (trước bữa ăn ≥180 mg / dl hoặc đường huyết sau bữa ăn ≥250 mg / dl) → bắt đầu sử dụng insulin (cần tham khảo ý kiến bác sĩ nội tiết hoặc bác sĩ/tham khảo phần 3A).
Không nên bắt đầu bằng nhóm Pioglitazone và ức chế SGLT2 ở bệnh nhân COVID.
Trong nhiểm COVID mức độ trung bình đến nặng, nên ngừng Pioglitazone và ức chế SGLT2 nếu bệnh nhân trước đó đã dùng chúng.
- Theo dõi Glucose máu mao mạch TAS, SAS, TAT, SAT, TAC và
Bảng 8. Hướng dẫn sử dụng thuốc viên hạ đường huyết
5. Chỉ định sử dụng Insulin cho bệnh nhân ĐTĐ nhiểm COVID-19
Bảng 9. Các loại insulin thường dùng trên lâm sàng
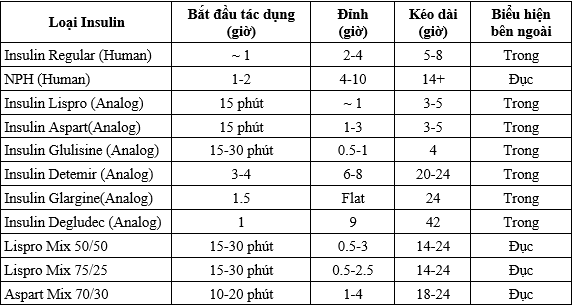
Cần hiểu rỏ dược động học loại insulin dự định sử dụng cho bệnh nhân nhất là thời gian bắt đầu tác dụng cũng như thời gian kéo dài tác dụng.
6. Liệu pháp insulin phóng-nền
Cần phân biệt liệu pháp basal bolus dành cho ĐTĐ típ 1 và basal plus (1,2 và 3) dành cho ĐTĐ típ 2
* Bệnh nhân mới phát hiện mắc bệnh ĐTĐ
Chỉ định: Lúc nhập viện: Glucose máu trước bữa ăn: ≥180 mg/dl hoặc sau bữa ăn G
≥250 mg/dl. Tổng liều hàng ngày (TDD) = 0,4 UI/kg/ngày. Tuy nhiên cần giảm liều Insulin khoảng 0,2 UI/kg/ngày nếu tuổi > 65 tuổi, bệnh thận hoặc bệnh gan.
Tổng liều hàng ngày được chia đều thành 4 liều (25% mỗi liều): 3 liều dành cho insulin bolus (Insulin thường 30 phút trước bữa sáng, trước bữa trưa và trước bữa tối) và 1 liều cho insulin nền (Insulin NPH trước giờ đi ngủ hoặc 2 giờ sau ăn tối)
Ví dụ: Bệnh nhân Nam 60 tuổi với trọng lượng cơ thể 60 kg có G trước bữa ăn là 185 mg/dl và G sau bữa ăn là 305 mg/dl có chỉ định liệu pháp insulin phóng-nền.
Tổng liều Insulin hàng ngày = 0,4 UI/kg/ngày = 0,4 x 60 = 24 UI/ngày.
Liều insulin ban đầu được kê cho bệnh nhân:
- Insulin nhanh 6 UI/TDD 30 phút trước bữa sáng, 6 UI/TDD 30 phút trước bữa trưa và 6UI/TDD 30 phút trước bữa tối.
- Insulin NPH : 6 UI/TDD trước lúc đi ngủ hoặc 2 giờ sau bữa ăn tối. Nếu insulin nền dạng analog (Bảng 7) thì có thể dụng bất kỳ thời điểm nào trong ngày (tốt nhất sang hoặc chiều) nhưng ngày sau nên cùng thời điểm.
* Bệnh nhân đang dùng OAD và glucose máu không được kiểm soát tốt (G trước bữa ăn ≥140 mg/dl hoặc sau bữa ăn G ≥180 mg/dl) Nếu G trước bữa ăn 140-180 mg/dl và / hoặc G sau bữa ăn 180-250 mg/dl → tham khảo ý kiến bác sĩ / bác sĩ nội tiết để tối ưu hóa liều OAD. Nếu G trước bữa ăn ≥180 mg/dl và/hoặc G sau bữa ăn ≥250 mg/dl mặc dù đang điều trị OAD → bắt đầu chế độ insulin phóng-nền bằng cách tính được đề cập trong phần trên (lưu ý trường hợp OAD ngoài Metformin và Gliptins cần phải được dừng lại). Tham khảo ý kiến bác sĩ / bác sĩ nội tiết để tối ưu hóa.
Lưu ý: Bệnh nhân ĐTĐ típ 2 không phải lúc nào cũng cần insulin phóng (Insulin thường) cho cả ba bữa ăn và chỉ có thể được thêm vào các bữa ăn riêng lẻ yêu cầu đảm bảo thực tế (tức là đối với các bữa ăn có G trước bữa ăn tăng sau bữa ăn > 40 mg/dl ( cũng có khuyến cáo ≥ 50 mg/dl ) vào một ngày nhất định, nên bổ sung insulin thường trước những bữa ăn cùng thời điểm này vào ngày hôm sau). Ví dụ : Trong bữa ăn trưa một ngày nhất định, G tăng từ 112 mg/dl (TAT) tăng lên 204 mg / dl (2h SAT). nghĩa là tăng > 40 mg/dl (92 mg/dl), Nên bổ sung liều insulin thường trước bữa trưa vào ngày hôm sau.
Nếu G máu đói ≥140mg/dl và nồng độ G tăng sau các bữa ăn trong giới hạn bình thường (< 40 mg / dl), thì chỉ cần thêm liều insulin nền (NPH insulin trước khi đi ngủ hoặc 2 giờ sau bữa ăn tối). Nếu insulin nền analogs thì không áp dụng chích thời điểm này.
*Bệnh nhân đang sử dụng chế độ insulin phóng-nền lúc nhập viện.
Tiếp tục phác đồ hiện có. Theo dõi đường huyết và xem lại bảng theo dõi hàng ngày về sự biến đổi nồng G máu để điều chỉnh liều.
*Bệnh nhân chuyển chế độ truyền insulin tĩnh mạch sang insulin phóng-nền
Cần tham khảo ý kiến bác sĩ / bác sĩ nội tiết để chuyển insulin tĩnh mạch sang chế độ insulin phóng nền. Nếu có sự chậm trễ trong việc tham khảo ý kiến bác sĩ / bác sĩ nội tiết, hãy làm theo các bước được đề cập bên dưới để chuyển sang chế độ cơ bản bằng liều phóng bolus như sau:
Tính tổng liều hàng ngày (TDD) dựa lượng insulin truyền trong 24 giờ qua:
Chọn TDD = 80% tổng liều insulin hàng ngày khi truyền IV trong 24 giờ qua.
Khi có TDD, hãy tính toán liều lượng insulin bolus (Insulin thường) và insulin nền (NPH insulin) như được mô tả trên .
Các lưu ý quan trọng: Chỉ nên chuyển từ chế độ truyền insulin tĩnh mạch sang chế độ insulin phóng nền khi nồng độ G máu kiểm soát tốt và ổn định khi truyền insulin tĩnh mạch, bệnh nhân chấp nhận ăn uống hoặc cho ăn qua sonde và ổn định về huyết động. Thời gian truyền insulin phải được duy trì cho trùng với thời điểm của chế độ insulin phóng nền khoảng 60-120 phút trước khi ngừng truyền tĩnh mạch.Vì thế khuyến cáo không nên ngừng truyền insulin tĩnh mạch đột ngột ( ngoại trừ hạ glucose máu).
Ví dụ: Một bệnh nhân nam 50 tuổi đang được truyền insulin tĩnh mạch và nồng độ G của được kiểm soát trong 24 giờ qua. Bệnh nhân chấp nhận ăn uống và huyết động ổn định. Vào lúc 11 giờ sáng, G máu là 132 mg/dl và quyết định chuyển sang insulin phóng nền .
Lượng insulin truyền tĩnh mạch trong 24 giờ ngày hôm trước là 30 UI/ngày
Lượng insulin phóng nền dự kiến: 30 UI x 80% = 24 UI
Tính toán liều lượng và dự định bắt đầu Insulin thường 6 UI/TAS, 6 UI/TATvà 6 UI/TAC và Insulin NPH 6 UI lúc đi ngủ hoặc 2 giờ sau bữa ăn tối. Không nên ngừng truyền insulin lúc 11 giờ sáng, thay vì đó tiếp tục truyền insulin cho đến bữa trưa. Vào lúc 12:30 chiều, chích Insulin thường 6UI (như đã tính toán), bệnh nhân ăn trưa vào lúc 1 giờ trưa, tiếp tục truyền insulin theo thang điểm và cuối cùng dừng 1 giờ sau đó lúc 1 giờ 30 chiều (sau khi phủ liều insulin).
Bảng 10. Hướng dẫn sử dụng liệu pháp insulin
*Sử dụng insulin trên bệnh nhân đang được nuôi ăn qua sonde dạ dày (Ryles Tube =RT)
Giống như các bữa ăn tiêu chuẩn, thức ăn qua sonde nên được chia thành 3 bữa ăn chính và 3 bữa ăn phụ. Thức ăn chính và phụ được xác định bằng calo/ số lượng thức ăn. (Ví dụ: thức ăn chính: 300ml mỗi bữa ăn và thức ăn phụ: 150 ml mỗi bữa ăn) trong số đó cần chú ý lượng Carbohydrate mổi bữa ăn
Thời gian bữa ăn chính: 9 giờ sáng, 1 giờ 30 chiều, 7 giờ tối.
Thời gian bữa ăn phụ : 11 giờ sáng, 4 giờ 30 chiều, 10 giờ tối.
Liệu pháp insulin phóng nền sẽ được ưu tiên ở những bệnh nhân như vậy. Insulin Bolus (Insulin thường) tiêm 30 phút trước mỗi lần bơm ăn chính và nên tiêm insulin nền (NPH insulin) vào lúc 10 giờ tối cùng với bữa ăn phụ cuối cùng. Theo dõi đường huyết mao mạch nên được thực hiện trước và 2 giờ sau mỗi lần cho bữa ăn chính.
Tính toán liều phóng nền và chỉ định insulin truyền tĩnh mạch
* Điều chỉnh liều insulin và mục tiêu đường huyết
Nguyên tắc chung chọn liều insulin nhanh ( insulin human hay insulin analog) cho mổi bữa ăn.
Khi sử dụng liều insulin tăng cường cho bữa ăn cần sử dụng 2 chỉ số dưới đây
* ICR (Insulin Carbohydrate Ratio):
Lượng Insulin phù hợp với lượng carbohydrate của mổi bữa ăn. Trong đó 1 UI Insulin cần cho 10 – 15 gam glucose (tùy bữa ăn và tùy cân nậng)
**ISF (Insulin Sensitility Factor): Nồng độ glucose máu cho một đơn vị insulin (nếu đường máu trước bữa ăn cao hoặc thấp hơn so mục tiêu đường máu trước ăn) dùng quy luật Rules trong đó 1500 (Insulin Human) hoặc 1800 (Insulin analog) chia tổng liều insulin dùng trong ngày.
Lượng insulin cho bữa ăn sẽ bao gồm lượng insulin cho lượng CHO tiêu thụ cộng Insulin hiệu chỉnh (nếu glucose máu trước ăn cao hơn mục tiêu) hoặc trừ Insulin hiệu chỉnh (nếu glucose máu thấp hơn mục tiêu).
Điểm quan trọng nhất cần nhớ khi điều chĩnh liều lượng insulin là chúng ta chủ động và không vội vàng, liều lượng insulin được điều chỉnh dựa trên nhật ký G của ngày hôm trước (có tính đến tác động của liều lượng insulin phóng và insulin nền vào ngày hôm trước) và không phải giá trị G máu thời điểm hiện tại.
Liều lượng insulin bolus cho mỗi bữa ăn chính (hoặc thức ăn bơm qua sonde bữa chính) được điều chỉnh sao cho nồng độ G máu trước bữa ăn tăng sau bữa ăn khoảng 30- 50 mg/dl.
Nếu sau ăn cao hơn phạm vi này, người ta nên kiểm tra xem kỹ thuật tiêm insulin có đúng không, có khoảng cách thời gian thích hợp giữa việc tiêm insulin và bữa ăn (30 phút trước ăn đối với insulin thường) hay không và chất lượng và số lượng carbohydrate trong bữa ăn phù hợp và tương đối cố định không.
Nếu những yếu tố này không góp phần gây ra tăng glucose máu sau ăn hoặc tăng glucose vẫn kéo dài mặc dù đã giải quyết được những yếu tố nói trên , thì nên tăng liều insulin cho bữa ăn (insulin thường) vào ngày tiếp theo.
Bảng 11. Bảng theo dõi bệnh nhân sử dụng liệu pháp insulin phóng- nền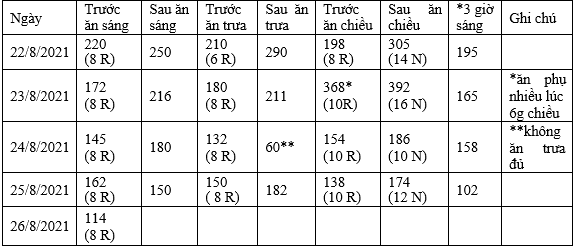
R= insulin regular, N= Insulin NPH Tăng/Giảm liều insulin regular cho bữa ăn
so sánh glucose máu sau ăn với mục tiêu kiểm soát đường huyết.
Tăng/giảm liều NPH so sánh glucose máu lúc đói ( buổi sáng) giữa các ngày với mục tiêu kiểm soát đường huyết.
Mục tiêu đường huyết cần cá nhân hóa nhất là người bệnh ĐTĐ cao tuổi
Bảng 8. Ví dụ: Ngày 22/8/2021 vào bữa trưa (bữa ăn chính ), nếu ở liều 6 UI Insulin thường và tăng G máu trước bữa ăn đến sau bữa ăn là 80 mg/dL (290-210 mg/dl) có thể tăng liều insulin lên 8 UI Insulin thường kể từ ngày hôm sau (23/8/2021) với điều kiện kỹ thuật tiêm insulin đúng, khoảng cách thời gian giữa insulin thường và bữa ăn phù hợp và đủ số lượng. và chất lượng carbohydrate trong bữa trưa phù hợp và nhất quán.
Liều insulin nền được điều chỉnh chủ yếu dựa vào nồng độ G máu đói buổi sáng. Nếu G ≥140 mg/dl, liều nền NPH insulin trước khi đi ngủ nên tăng (thường là 2 UI trở lên) để nhắm mục tiêu G đói xuống <140 mg / dl vào ngày hôm sau.
Trước khi tăng liều insulin nền buổi tối cần phân biệt hiện tượng Somogy ( do hạ đường máu trong đêm ) và hiện tượng Down ( tăng đường máu do stress và các hormone chông điều hòa ) . Vì thế nên được thực hiện kiểm tra nồng độ glucose máu khoảng 3 giờ sáng.
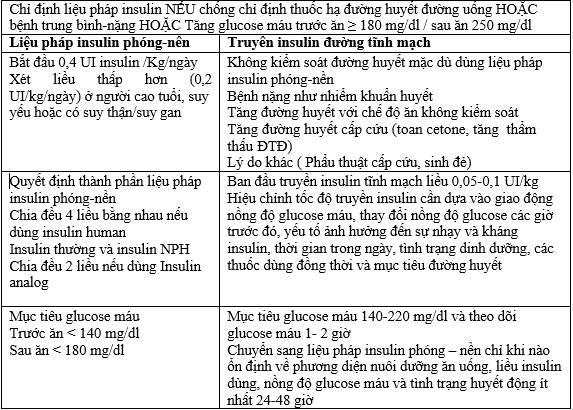
7. Truyền insulin đường tĩnh mạch
A. Chỉ định truyền insulin tĩnh mạch
Truyền insulin đường tĩnh mạch được chỉ định khi nồng độ glucose máu ≥180 mg/dl (≥ 2 lần xét nghiệm ) trong các trường hợp sau:
- Bệnh nhân không ăn uống bằng đường miệng (NPO) hoặc những người bệnh có chế độ ăn uống thất thường (về thời gian và thành phần thức ăn).
- Nhiễm toan ceton do ĐTĐ.
- Tăng đường huyết không kiểm soát được mặc dù đã sử dụng nhiều mũi chích
- Tăng đường huyết nghiêm trọng khi khởi phát (G máu trước ăn ≥300 mg/dl và G máu sau ăn ≥400 mg / dl) – mặc dù đã sử dụng insulin tiêm dưới da. Tình trạng ceton nên được kiểm tra trước khi bắt đầu truyền.
- Bệnh nặng như nhiễm trùng huyết và sốc nhiễm trùng.
B. Chuẩn bị dịch truyền: Hòa 50 UI insulin nhanh trong 50ml Natri 0,9% (1.0 UI/ml). Phiếu ghi đầy đủ phải được dán trên ống tiêm 50 ml nhưng không được che khuất thang số. Trước khi bắt đầu truyền bằng cách xã 20 ml dung dịch đã pha qua dây chuyền .
Dung dịch có chứa insulin nếu không sử dụng nên được loại bỏ sau 24 giờ.
Nếu không có sẵn máy bơm ống tiêm, có thể sử dụng các bộ truyền dịch cho trẻ em được hỗ trợ trọng lực để truyền insulin qua đường tĩnh mạch.
C. Khởi đầu truyền insulin: liều insulin khởi đầu từ 0,05-0,1 UI/kg/giờ.
D. Tần suất theo dõi đường huyết: mỗi 2 giờ và có thể kéo dài mỗi 4 giờ nếu nhu cầu insulin thấp, giá trị glucose máu ổn định và đạt trong mục tiêu.
E. Mục tiêu đường huyết:
Duy trì đường huyết từ 140-180 mg/dl cho hầu hết các bệnh nhân.
Mục tiêu 110-180 mg/dl trong một bối cảnh mà mục tiêu này có thể đạt được mà không gây hạ đường huyết đáng
Mục tiêu có thể được nới lỏng 200-220 mg/dl khi mục tiêu 140-180 mg/dl là không an toàn và liên quan đến tăng nguy cơ hạ đường huyết.
F. Điều chỉnh tốc độ truyền insulin:
Cần điều chỉnh tốc độ truyền insulin dựa trên biến đổi nồng độ đường huyết, mức đường huyết mục tiêu và mức độ thay đổi nồng độ đường huyết trong các giờ trước đó. Các yếu tố khác cần được tính đến là thời gian và thành phần bữa ăn, độ nhạy insulin và đáp ứng đường huyết của ngày hôm trước.
Một công thức đơn giản và phổ biến:
Tốc độ truyền (đơn vị UI insulin / giờ) = Glucose máu (mg/dl)/100 để tính tốc độ truyền ban đầu. Tuy nhiên, không nên hoàn toàn dựa vào dây để điều chỉnh vì nó không tính đến sự thay đổi G máu trong những giờ trước đó.
Ví dụ:
- Với tốc độ liên tục 3 UI insulin/ giờ, G máu từ 280 mg/dl (vào 2 giờ trước đó) giảm xuống mức glucose máu hiện tại là 250 mg/dl ( giảm 15 mg/dl /giờ). Kỳ vọng nồng độ này sẽ là 220 mg/dl (vẫn còn trên mục tiêu) sau 2 giờ với tốc độ 3 UI/ giờ như hiện tại. Vì vậy, tốc độ truyền cần được tăng lên.
- Với tốc độ truyền insulin liên tục là 1,8 UI / giờ, G máu là 185 mg/dl (2 giờ trước đó) xuống mức hiện tại là glucose là 170 mg/dl (giảm 7,5 mg/dl / giờ) và dự kiến glucose máu là 155 mg/dl ( đạt mục tiêu) sau 2 giờ với tốc độ truyền hiện tại. Vì vậy, tiếp tục tốc độ truyền như cũ.
- Với tốc độ truyền insulin liên tục là 1,2 UI/ giờ, Glucose máu từ 144 mg/dl ( 2 giờ trước đó) giảm xuống mức hiện tại glucose là 100 mg/dl (giảm 22 mg/ dl/ giờ) và dự kiến glucose máu là 56 mg/dl sau 2 giờ với tốc độ hiện tại. Vì vậy, Cần phải giảm tốc độ truyền insulin (50% tương đương 0,6 UI / giờ).
- Với tốc độ truyền insulin liên tục là 1,2 UI / giờ, G máu vào giữa đêm từ 108 mg/dl (2 giờ trước đó ) giảm xuống nồng độ glucose máu hiện tại là 60 mg / dl. Trong trường hợp trên ngừng truyền insulin và cấp cứu hạ glucose bằng cung cấp glucose hiệu chỉnh (50 ml dextrose 50% ở bệnh nhân hôn mê và 15- 20 gam glucose dung dịch đường uống ở bệnh nhân còn tỉnh táo) và kiểm tra glucose máu sau mỗi 15-20 phút cho đến khi 2 hoặc nhiều giá trị nồng độ glucose > 100 mg/dl.
Khi truyền insulin có thể bắt đầu lại nên giảm liều với tốc độ 0,6 UI/ giờ với sự theo dõi chặt chẽ cứ sau 30-60 phút trong 2 giờ tiếp theo.
G. Tốc độ truyền insulin cần thay đổi Glucose mục tiêu:
Ban đầu, nồng độ glucose máu nên cho giảm từ 50-100 mg/dl/giờ (50-75 mg/dl/giờ cũng có thể chấp nhận), đạt được nồng độ G máu mục tiêu và duy trì trạng thái ổn định. Nếu đường huyết thay đổi < 50 mg/dl hoặc > 100 mg/dl, cân nhắc tăng hoặc giảm tốc độ truyền insulin tương ứng.
H. Hiệu chỉnh liều Insulin bao phủ cho các bữa ăn:
Đối với hiệu chỉnh insulin bao phủ thực ăn tiêu thụ, cần tăng tốc độ truyền thêm 2-4 UI/giờ và cao hơn tốc độ cơ bản ngay trước khi dùng bữa chính và tiếp tục tốc độ truyền tăng trong 2 giờ tiếp theo. Điều quan trọng cần lưu ý là truyền insulin tĩnh mạch có hai thành phần:
*Tỷ lệ bao phủ insulin cơ bản được cung cấp bởi tốc độ duy trì của insulin tĩnh mạch và
*Đảm bảo thực tế được cung cấp bởi sự gia tăng tốc độ insulin duy trì trong vòng 2 giờ xung quanh bữa ăn.
Ví dụ: Một bệnh nhân nam 55 tuổi đang dùng insulin TM để kiểm soát tăng đường huyết. Bệnh nhân đã ăn uống lại được và dự định ăn trưa lúc 1 giờ chiều.
Vào lúc 1 giờ chiều nồng Glucose máu là 202 mg / dl và tốc độ truyền là 2 U / giờ, nhưng cần tăng tốc độ truyền insulin lên 5 U/giờ (2 + 3 UI / giờ) từ 1 giờ chiều đến 3 giờ chiều để cung cấp lượng insulin cho sau bữa ăn.
Từ 3 giờ chiều trở đi, tốc độ truyền insulin cơ bản (hoặc duy trì tốc độ ) được tiếp tục cho đến thời điểm của bữa ăn tiếp theo.
Cần lưu ý cung cấp thêm lượng insulin đảm bảo cho bữa ăn có thể thay đổi vào ngày hôm sau dựa trên sự thay đổi glucose máu của bữa ăn trước và sau bữa ăn trong ngày hôm trước.
Khuyến cáo chung
- Việc ngừng truyền insulin tĩnh mạch (nếu thật sự cần thiết) nên thực hiện trong một khoảng thời gian ngắn nhất nhằm đảm bảo kiểm soát đường huyết tốt hơn. Ví dụ, nếu ngừng truyền insulin để cho bệnh nhân tắm, thì nên bắt đầu lại ngay khi bệnh nhân quay lại với thời gian gián đoạn trong vòng 10-15 phút.
- Thời gian và liều lượng insulin được mô tả trên đây liên quan đến việc sử dụng Insulin human dưới dạng insulin phóng (cho bữa ăn ) và Insulin NPH là insulin nền. Tuy nhiên, trong trường hợp sử dụng các insulin analogs (insulin aspart, insulin lispro và insulin glulisine và các insulin analog nền tác dụng kéo dài như insulin glargine và insulin degludec) các thông số kỹ thuật này sẽ thay đổi tương ứng ( bảng 8).
Ví dụ:
- Do insulin analog tác dụng nhanh có thời gian tác dụng nhanh hơn so với insulin human vì thế khoảng cách chích trước khi ăn 5-15 phút thay vì 30 phút loại insulin regular
- Do insulin analogue dạng nền có thời gian tác dụng kéo dài từ 24 giờ trở lên vì thế có thể được sử dụng vào bất kỳ thời điểm tương đối cố định nào trong ngày không nhất thiết trước khi ngủ hoặc sau ăn chiều 2 giờ như insulin
- Khi sử dụng các insulin analogs cho chế độ insulin phóng-nền, sự phân chia liều có khác trong đó insulin analog nền chiếm 50% tổng liều insulin , trong khi insulin analỏg tác dụng nhanh chiếm 50% lượng insulin còn lại (được chia thành ba phần cho mỗi bữa ăn tùy theo lượng carbohydrate tiêu thụ).
3. Hướng dẫn sử dụng phác đồ insulin trong các tình huống khác nhau được cung cấp trong hình dưới đây.
Bảng 12. Liệu pháp insulin theo tình huống lâm sàng
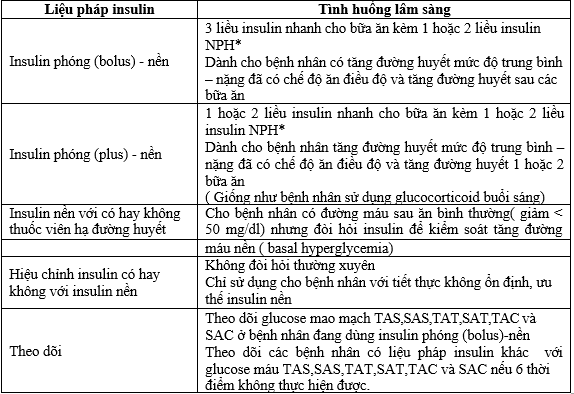
* Có thể thay 2 liều NPH ngày bằng một lượng tương insulin nền dạng analogs
Chữ viết tắt: TAS: Trước ăn sáng, TAT: Trước ăn trưa, TAC: trước ăn chiều, SAS: Sau ăn sáng , SAT: Sau ăn trưa , SAC: Sau ăn chiều
Một số tai biến thường gặp khi sử dụng liệu pháp insulin
Hạ glucose máu. Thường xãy ra về đêm. Người cao tuổi, bệnh nhân nặng, không kiểm soát chế độ ăn. Đặc biệt chú ý hạ đường huyết trên bệnh nhân ĐTĐ có suy thận (insulin tích lũy) và bệnh nhân có bệnh dạ dày giảm trương lực (gastroparesia) bị hạ đường huyết sớm sau ăn. Cần theo dõi glucose máu định kỳ và khi có triệu chứng nghi ngờ. Những bệnh nhân nặng cần theo dõi bằng thiết bị theo dõi glucose máu liên tục (Continous Glucose Monitoring). Hạ kali máu. Nguy cơ hạ kali máu khi Insulin truyền tĩnh mạch do kali vào nội bào. Vì vậy cần kiểm tra điện tim và định lượng kali huyết thanh sau mỗi 6 giờ ở những bệnh nhân nuôi dưỡng qua sonde và 12 giờ một lần ở người bệnh ăn uống bình thường. Phù não. Thường xãy ra ở bệnh nhân bù nhiều dịch và insulin liều cao (nhiểm toan ceton, hôn mê tăng thâm thấu đái tháo đường…) thường có triệu chứng phù não vào thời điểm sau khi bắt đầu điều trị từ giờ thứ 3 trở đi.
8. Sử dụng insulin ở bệnh nhân COVID được chỉ định Glucocorticoid:
Glucocorticoid là loại thuốc có chỉ định trong điều trị nhiểm COVID-19 . Tuy nhiên nhóm thuốc này có thể làm trầm trọng thêm tình trạng tăng đường huyết vì thế cần điều chỉnh liều insulin. Việc điều chỉnh sẽ phụ thuộc vào thời gian kéo dài tác dụng của loại glucocorticoid được sử dụng: tác dụng ngắn (hydrocortisone, thời gian tác dụng: 8-12 giờ), tác dụng trung gian (prednisolone, thời gian tác dụng: 12-36 giờ) và tác dụng kéo dài (dexamethasone, thời gian tác dụng: 36 giờ) và tần suất sử dụng thuốc.
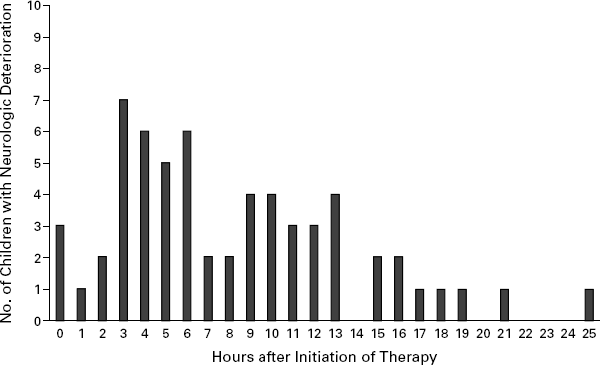
Sơ đồ 10. Các thời điểm xãy ra phù não trong quá trình truyền insulin tĩnh mạch và bù dịch.
Bảng 13 . So sánh hiệu quả kháng viêm, liều tương đương, thời gian bán hủy và tác dụng của các glucocorticoid
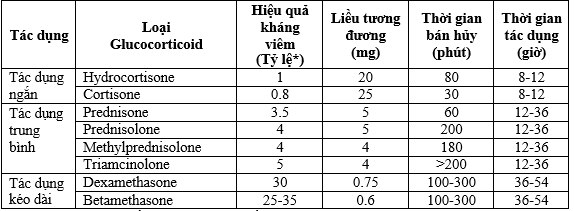
* Tỷ lệ tác dụng chống viêm được đo bằng quy chiếu hydro hóa là 1.
Liều lượng tương đương dựa trên hydro hóa làm tham chiếu.
Hai thuốc Methylprednisolone và Dexamethasone là những glucocorticoid thường được sử dụng ở bệnh nhân COVID-19 nặng.
*Nếu bệnh nhân dùng glucocorticoid tác dụng kéo dài (ví dụ 8 mg Dexamethasone) liều duy nhất hàng ngày hoặc methylprednisolone hai lần mỗi ngày, tác dụng tăng đường huyết có khả năng kéo dài suốt cả ngày và do đó việc chuẩn độ liều insulin sẽ giống như đã đề cập ở trên trừ trường hợp cần tăng / liều lượng insulin cao hơn trong trường hợp dùng steroid.
*Nếu bệnh nhân đang sử dụng steroid tác dụng trung gian liều cao (ví dụ như prednisolone hoặc methylprednisolone 60 mg) được dùng một liều duy nhất vào lúc 9 giờ sáng, tác dụng tăng đường huyết cao nhất dự kiến sẽ xảy ra vào các giờ buổi chiều và buổi tối (từ 12 giờ trưa đến 8 giờ tối). Theo đó, bệnh nhân sẽ yêu cầu một liều insulin cao hơn trước bữa ăn trưa. Ngoài ra, Insulin NPH có thể hữu ích vì dược động học của NPH gần giống với tác dụng của steroid (prednisone / methylprednisolone) trên mức đường huyết; Insulin NPH có thể được dùng trước bữa ăn sáng hoặc 9 giờ sáng trong trường hợp như vậy.
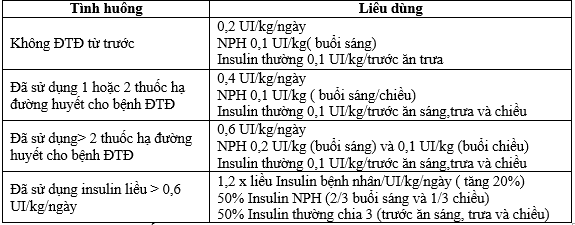
Hướng dẫn về liều lượng gần đúng cần thiết trong các tình huống khác nhau khi sử dụng steroid được cung cấp trong hình dưới đây. Liều lượng insulin sẽ khác nhau tùy thuộc vào loại steroid, liều lượng và tần suất sử dụng.
Bảng 14. Hướng dẫn ban đầu sử dụng insulin cho tình trạng tăng đường huyết do Glucocorticoid ở bệnh nhân có hoặc không đái tháo đường
Mục tiêu đường huyết:
Đối với hầu hết bệnh nhân đang điều trị chế độ insulin phóng-nền (hoặc để quản lý tăng đường huyết tại bệnh nhân, nói chung). Nồng độ G trước bữa ăn là <140 mg / dl và nồng độ G sau bữa ăn là <180 mg / dl có thể được nhắm mục tiêu.
Ở những người được chọn, có thể đạt được mức mục tiêu là <120 mg / dl (trước bữa ăn) và <160 mg / dl (sau bữa ăn) được xem xét, miễn là có thể đạt được những điều này mà không gây hạ đường huyết quá mức.
* Giám sát G mao mạch TAS, SAS, TAT,SAT, TAC và SAC. Bảng 1: Nhật ký đường huyết
Viết tắt: TAS: Trước bữa sáng, SAS: Sau bữa sáng,TAT: Trước bữa trưa, SAT:Sau bữa trưa,
TAC:Trước bữa chiều,SAC: Sau bữa chiều, R: Insulin thường, N: Insulin NPH
# Theo dõi đường huyết 3 giờ sáng khi đường huyết lúc đói liên tục vượt quá mục tiêu
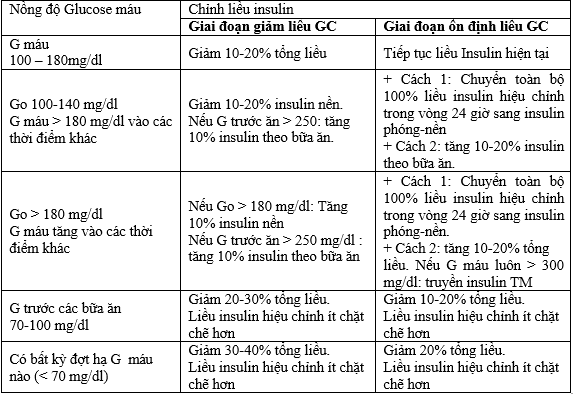
Bảng 15. Chỉnh liều insulin trong liệu pháp Glucocorticoid (GC) theo glucose máu
Bảng 16. Bảng theo dõi glucose máu trên Bn ĐTĐ đang sử dụng steroid và insulin
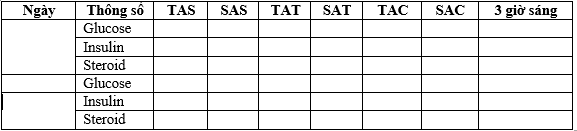
Chữ viết tắt: TAS: Trước ăn sáng, TAT: Trước ăn trưa, TAC: trước ăn chiều, SAS: sau ăn sáng, SAT: sau ăn trưa, SAC: sau ăn chiều
TÓM TẮT HƯỚNG DẪN LÂM SÀNG VỀ KHỞI TRỊ VÀ ĐIỀU CHỈNH GLUCOSE MÁU Ở BỆNH NHÂN ĐÁI THÁO ĐƯỜNG NHIỂM COVID 19.
Bảng 17. Hướng dẫn lâm sàng về khởi trị và điều chỉnh glucose máu ở bệnh nhân ĐTĐ mắc bệnh COVID-19
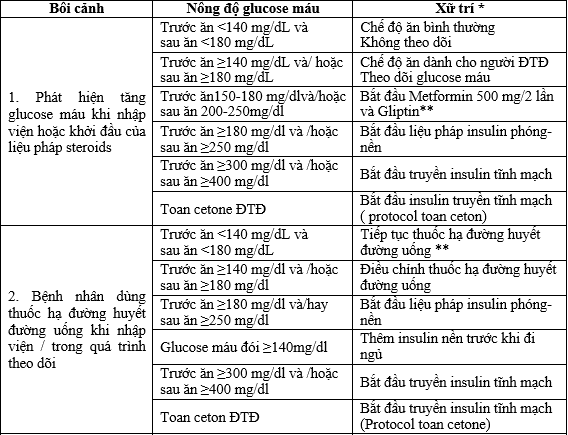
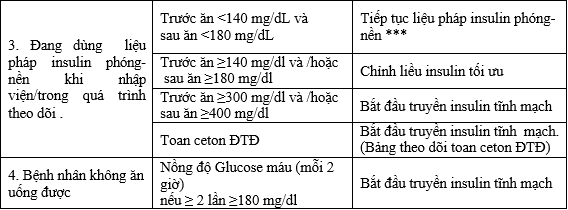
* Tham khảo tài liệu để biết chi tiết về việc bắt đầu /chuẩn độ các phác đồ khác nhau.
**Thuốc hạ đường huyết đường uống chỉ được bắt đầu/tiếp tục trong các trường hợp COVID-19 nhẹ được chấp nhận bằng đường uống, ổn định mà không có bất kỳ trường hợp nào chống chỉ định cho việc sử dụng chúng.
Nhóm Gliptin có thể là Vildagliptin 50 mg 2 lần/ngày, Sitagliptin 100 mg một lần/ngày, Linagliptin 5 mg một lần/ngày hoặc Teneligliptin 20 mg một lần/ngày.
*** Tiếp tục phác đồ insulin phóng-nền hiện dùng nếu không có cơn hạ đường huyết.
KẾT LUẬN
Tăng đường huyết và ĐTĐ chiếm tỷ lệ cao ở bệnh nhân nhiểm COVID-19 nhất là giai đoạn nguy kịch. Sự ảnh hưởng quan trọng của việc kiểm soát đường huyết về mức độ nghiêm trọng của COVID-19 ở cả ba mốc thời gian trước vào viện, ngay thời điểm nhập viện và trong quá trình nằm viện. Vi vậy với những người bệnh ĐTĐ nhiểm COVID-19 cần theo dõi chặt chẽ để xác định nhanh chóng và ngăn ngừa tình trạng xấu đi, kết hợp với việc tiếp tục kiểm soát đường huyết chặt chẽ để ngăn ngừa các biến chứng. Điều này liên quan đến sự điều chỉnh liều lượng thuốc hiện tại của bệnh nhân, ngừng một số loại thuốc uống hoặc chuyển sang liệu pháp insulin cho những bệnh nhân nặng nhất là khi sử dụng steroid và kiểm soát đường huyêt kém. Kiểm soát tốt đường máu là một trong những yếu tố góp phần cải thiện tiên lượng cho bệnh nhân ĐTĐ bị nhiểm CoViD-19.
TÀI LIỆU THAM KHẢO
- Wang S, Ma P, Zhang S, et al. Fasting Blood Glucose At Admission is an Independent Predictor for 28-Day Mortality in Patients With COVID-19 Without Previous Diagnosis of Diabetes: A Multi-Centre Retrospective Diabetologia (2020) 63(10):2102–11. doi: 10.1007/s00125-020-05209-1
- Ruissen MM, Regeer H, Landstra CP, et al. Increased Stress, Weight Gain and Less Exercise in Relation to Glycemic Control in People With Type 1 and Type 2 Diabetes During the COVID-19 Pandemic. BMJ Open Diabetes Res Care (2021) 9(1). doi: 10.1136/bmjdrc-2020- 002035
- Bonora BM, Boscari F, Avogaro A, Bruttomesso D, Fadini Glycaemic Control Among People With Type 1 Diabetes During Lockdown for thenSARS-Cov-2 Outbreak in Italy. Diabetes Ther 2020:1–11. doi: 10.1007/ s13300-020-00829-7
- Maddaloni E, Coraggio L, Pieralice S, Carlone A, Pozzilli P, Buzzetti Effects of COVID-19 Lockdown on Glucose Control: Continuous Glucose Monitoring Data From People With Diabetes on Intensive Insulin Therapy. Diabetes Care (2020) 43(8):e86–7. doi: 10.2337/dc20-0954
- Mesa A, Viñals C, Pueyo I, et al. The Impact of Strict COVID-19 Lockdown in Spain on Glycemic Profiles in Patients With Type 1 Diabetes Prone to Hypoglycemia Using Standalone Continuous Glucose Monitoring. Diabetes Res Clin Pract (2020) 167:108354. doi: 10.1016/j.diabres.2020.108354
- Kim NY, Ha E, Moon JS, Lee YH, Choi Acute Hyperglycemic Crises With Coronavirus Disease-19: Case Reports. Diabetes Metab J (2020) 44 (2):349–53. doi: 10.4093/dmj.2020.0091
- Li J, Wang X, Chen J, Zuo X, Zhang H, Deng A. COVID-19 Infection May Cause Ketosis and Ketoacidosis. Diabetes Obes Metab (2020) 22(10):1935– 41. doi: 10.1111/dom.14057
- Reddy PK, Kuchay MS, Mehta Y, Mishra SK. Diabetic Ketoacidosis Precipitated by COVID-19: A Report of Two Cases and Review of Literature. Diabetes Metab Syndr (2020) 14(5):1459–62. doi: 10.1016/ dsx.2020.07.050
- Heaney AI, Griffin GD, Simon EL. Newly Diagnosed Diabetes and Diabetic Ketoacidosis Precipitated by COVID-19 Infection. Am J Emerg Med (2020) 38(11):2491 e2493–2491 e2494. doi: 10.1016/j.ajem.2020.05.114
- Goldman N, Fink D, Cai J, Lee YN, Davies Z. High Prevalence of COVID-19- Associated Diabetic Ketoacidosis in UK Secondary Care. Diabetes Res Clin Pract (2020) 166:108291. doi: 1016/j.diabres.2020.108291
- Li HQ, Tian SH, Chen T, et al. Newly Diagnosed Diabetes is Associated With a Higher Risk of Mortality Than Known Diabetes in Hospitalized Patients Withcovid-19. Diabetes Obes Metab (2020) 22(10):1897–906. doi: 1111/ dom.14099
- Chee YJ, Ng SJH, Yeoh Diabetic Ketoacidosis Precipitated by Covid-19 in a Patient With Newly Diagnosed Diabetes Mellitus. Diabetes Res Clin Pract (2020) 164:108166. doi: 10.1016/j.diabres.2020.108166
- Hollstein T, Schulte DM, Schulz J, et al. Autoantibody-Negative InsulinDependent Diabetes Mellitus After SARS-Cov-2 Infection: A Case Report. Nat Metab (2020) 2(10):1021–4. doi: 1038/s42255-020-00281-8
- Marchand L, Pecquet M, Luyton C. Type 1 Diabetes Onset Triggered by COVID- 19. Acta Diabetol (2020) 57(10):1265–6. doi: 1007/s00592-020-01570-0
- Wu L, Girgis CM, Cheung COVID-19 and Diabetes: Insulin Requirements Parallel Illness Severity in Critically Unwell Patients. Clin Endocrinol (Oxf) (2020) 93(4):390–3. doi: 10.1111/cen.14288
- Corticosteroids for COVID-19 (2020). Available at: https://www.who. int/publications/i/item/WHO-2019-nCoV- Corticosteroids-2020.1
- Fignani D, Licata G, Brusco N, et al. SARS-Cov-2 Receptor Angiotensin IConverting Enzyme Type 2 (ACE2) is Expressed in Human Pancreatic BetaCells and in the Human Pancreas Front Endocrinol (Lausanne) (2020) 11:596898. doi: 10.3389/fendo.2020.596898
- Kusmartseva I, Wu W, Syed F, et al. Expression of SARS-Cov-2 Entry Factors in the Pancreas of Normal Organ Donors and Individuals With COVID-19. Cell Metab (2020) 32(6):1041–1051 e1046. doi: 1016/j.cmet.2020.11.005
- Müller JA, Groß R, Conzelmann C, et al. SARS-Cov-2 Infects and Replicates in Cells of the Human Endocrine and Exocrine Pancreas. Nat Metab (2021). potential conflict of
- Goyal A, Gupta S, Gupta Y, Tandon Proposed guidelines for screening of hyperglycemia in patients hospitalized with COVID-19 in low resource settings Diabetes Metab Syndr. 2020;14(5):753- 756.
- Umpierrez G, Hellman R, Korytkowski MT, et al. Management of Hyperglycemia in Hospitalized Patients in Non-Critical Care Setting: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2012; 97(1):16–38.
- Moghissi ES, Korytkowski MT, Dinardo MM et al. American Association of Clinical Endocrinologists and American Diabetes Association consensus statement on inpatient glycemic control. Diabetes Care 2009; 32(6):1119-1131.
- Attri B, Goyal A, Gupta Y, Tandon Basal-Bolus Insulin Regimen for Hospitalised Patients with COVID-19 and Diabetes Mellitus: A Practical Approach . Diabetes Ther. 2020;1-18. doi:10.1007/s13300-020-00873-3.
- Rayman G, Lumb A, Kennon B, et al. Guidance on the management of Diabetic Ketoacidosis in the exceptional circumstances of the COVID-19 pandemic. Diabet Med. 2020;37(7):1214- 1216.doi:10.1111/dme.14328
- Rayman G, Lumb A, Kennon B, et al. New Guidance on Managing Inpatient Hyperglycaemia during the COVID-19 Pandemic. Diabet Med. 2020;37(7):1210- 1213. doi:10.1111/dme.14327
- Kelly JL. Continuous Insulin Infusion: When, Where, and How?. Diabetes Spectr. 2014;27(3):218-223.
- Gupta Y, Goyal A, Kubihal S, Golla KK, Tandon A guidance on diagnosis and management of hyperglycemia at COVID care facilities in India. Diabetes Metab Syndr. 2021 Jan-Feb;15(1):407-413
- Government of India.Ministry of Health & Family Welfare Clinical Guidance on Diagnosis and Management of Diabetes at COVID-19.Patient Management facility.Version 0. 1st June, 2021
- Chung SM, Lee YY, Ha E, Yoon JS, Won KC, Lee HW, et al. The risk of diabetes on clinical outcomes in patients with coronavirus disease 2019: a retrospective cohort Diabetes Metab J 2020;44:405-13.
- Gregory JM, Slaughter JC, Duffus SH, Smith TJ, LeStourgeon LM, Jaser SS, et al. COVID-19 severity is tripled in the diabetes community: a prospective analysis of the pandemic’s impact in type 1 and type 2 diabetes. Diabetes Care 2021;44:526-32.
- Huang I, Lim MA, Pranata R. Diabetes mellitus is associated with increased mortality and severity of disease in COVID-19 pneumonia: a systematic review, meta-analysis, and meta-regression. Diabetes Metab Syndr 2020;14:395-403.
- Kim MK, Jeon JH, Kim SW, Moon JS, Cho NH, Han E, et al. The clinical characteristics and outcomes of patients with moderate-to-severe coronavirus disease 2019 infection and diabetes in Daegu, South Korea. Diabetes Metab J 2020;44: 602-13.
- Lim S, Bae JH, Kwon HS, Nauck MA. COVID-19 and diabetes mellitus: from pathophysiology to clinical management. Nat Rev Endocrinol 2021;17:11-30.
- Barron E, Bakhai C, Kar P, Weaver A, Bradley D, Ismail H, et al. Associations of type 1 and type 2 diabetes with COVID- 19-related mortality in England: a whole- population Lancet Diabetes Endocrinol 2020;8:813-22.
- Cariou B, Hadjadj S, Wargny M, Pichelin M, Al-Salameh A, Allix I, et al. Phenotypic characteristics and prognosis of inpatients with COVID-19 and diabetes: the CORONADO Diabetologia 2020;63:1500-15.
- Moon SJ, Rhee EJ, Jung JH, Han KD, Kim SR, Lee WY, et al. Independent impact of diabetes on the severity of coronavirus disease 2019 in 5,307 patients in South Korea: a nationwide cohort Diabetes Metab J 2020;44:737-46.
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam




