CẬP NHẬT ĐIỀU TRỊ RỐI LOẠN LIPID MÁU
Ở BỆNH NHÂN ĐÁI THÁO ĐƯỜNG TYP 2
ADA 2018/AACE – ACE 2018
GS.TS. Nguyễn Hải Thủy
Trường Đại học Y Dược Huế
SUMMARY
Dyslipidemia guidelines in type 2 diabetic patients ADA 2018/AACE –ACE 2018
Type2 diabetic patients have a type of dyslipidemia that is consist with increased triglycerides (TG), low-density lipoprotein are smaller and more dense (LDPsd) and decreased high-density lipoprotein (HDL). Type 2 diabetics also have increased amounts of intermediate lipid particles, including very low-density lipoprotein (VLDL) and intermediate density lipoprotein (IDL). This can lead to an increased non-HDL cholesterol (non-HDL-C) level—which is associated with an even higher risk of atherosclerotic cardiovascular disease (ASCVD) than increased LDL levels in type 2 diabetics. Lifestyle modification should be recommended to improve the lipid profile. Statin use is recommended for most persons with diabetes aged ≥ 40 years without additional ASCVD factors. For diabetic patients of all ages with ASCVD, high-intensity statin therapy should be added to lifestyle therapy, if LDL cholesterol is ≥70 md/dL on maximally tolerated statin dose, consider adding additional LDL-lowering therapy (such as ezetimibe or PCSK9 inhibitor) after evaluating the potential for further ASCVD risk reduction. For diabetic patients with fasting TG levels of ≥ 5.7 mmol/L, evaluation for secondary causes of hypertriglyceridemia should be done and medical therapy should be considered to reduce the risk for pancreatitis. Therapy with a statin and fenofibrate may be considered for men with a TG level of ≥2.3 mmol/L and a HDL.C level of <0.9 mmol/L Recently, new classes of lipid-lowering drugs have been developed and some of them are available for the clinical practice. The Cholesteryl ester transfer protein (CEPT) inhibitor, Microsomal triglyceride transport protein (MTP) inhibitor and antisense oligonucleotide against apolipoprotein B (ApoB) and the apolipoprotein A1 (ApoA1) mimetics pursuing the beneficial effect on management of atherosclerosis.
Key words: Atherosclerotic cardiovascular disease (ASCVD), low-density lipoprotein cholesterol (LDL-C), non-HDL cholesterol (non-HDL-C).
Chịu trách nhiệm chính: Nguyễn Hải Thủy
Ngày nhận bài: 01/10/2018
Ngày phản biện khoa học: 10/10/2018
Ngày duyệt bài: 15/10/2018
1. ĐẠI CƯƠNG RỐI LOẠN LIPID MÁU ĐÁI THÁO ĐƯỜNG TÝP 2
Đái tháo đường týp 2 (ĐTĐT2) được xem yếu tố nguy cơ chính về bệnh tim mạch xơ vữa (BTMXV) liên quan đến rối loạn lipid máu (Bảng 1).
Kiểm soát glucose máu cơ bản nhằm dự phòng các biến chứng vi mạch, trong khi kiểm soát nồng độ cholesterol và triglyceride (TG) nói chung và các hạt lipoprotein vận chuyển lipid gây xơ vữa nói riêng là cơ bản để phòng ngừa bệnh mạch máu lớn và vi mạch nhất là bảo vệ bệnh cơ tim ĐTĐ (Sơ đồ 1).
Phân loại bệnh tim mạch do xơ vữa (AACE 2018) bao gồm.
- Nhồi máu cơ tim hoặc các hội chứng vành cấp khác
- Can thiệp bệnh mạch vành hoặc tái tưới máu khác
- Cơn thiếu máu thoáng qua
- Nhồi máu não
- Bệnh lý xơ vữa động mạch ngoại biên
+ Chỉ số huyết áp cổ chân/cánh tay (ABI) < 0,9
Bảng 1. Yếu tố nguy cơ bệnh tim mạch do xơ vữa (AACE – 2018)
| YTNC chính | YTNC phối hợp | YTNC không truyền thống |
| Tuổi lớn
Tăng TC Tăng Non–HDL-C Tăng LDL-C Giảm HDL-C ĐTĐ THA Bệnh thận mạn Hút thuốc lá Tiền sử gia đình BTMXV |
Béo phì, béo dạng nam
Tiền sữ gia đình tăng lipid máu Tăng LDLsd Tăng Apo B Tăng LDL-P Tăng TG lúc đói và sau ăn Hội chứng Buồng trứng đa nang (PCOS) Tam chứng RLLP máu (HCCH) |
Tăng Lipoprotein (a)
Tăng YT đông máus Tăng chỉ điểm viêm (hsCRP; Lp-PLA2) Tăng Homocysteine Apo E4 isoform Tăng Uric acid Tăng các lipoprotein thừa chứa nhiều TG |
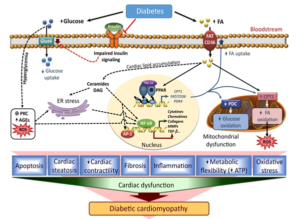
Sơ đồ 1. Vai trò RLLP máu trong bệnh cơ tim ĐTĐ
- Các bệnh lý xơ vữa động mạch khác
+ Xơ vữa động mạch vành
+ Xơ vữa động mạch thận
+ Phình động mạch chủ do xơ vữa
+ Mãng xơ vữa động mạch cảnh (hẹp ≥ 50%).
Nhằm giảm nguy cơ BTMXV ở những bệnh nhân ĐTĐ Týp 2, ngoài sàng lọc phát hiện việc điều trị tích cực sớm của rối loạn lipid máu được khuyến cáo.
Trong rối loạn lipid máu ở ĐTĐ có sự xuất hiện các chất vận chuyển LDLsd nguy cơ gây biến chứng tim mạch trầm trọng và cao hơn so với hạt LDL kích thước lớn.
Như thế RLLPM ở bệnh nhân đái tháo đường ngoài các nguy cơ như người không ĐTĐ còn có sự hiện diện tăng TG, giảm HDL.C và tăng LDLsd là những nguy cơ không những nguy cơ bệnh mạch máu lớn và mạch máu nhỏ mà có thể gây các bệnh lý khác như gan nhiểm mỡ, viêm tụy, bệnh cơ tim đái tháo đường.
2. SÀNG LỌC, NGUY CƠ – PHÂN LOẠI RỐI LOẠN LIPID MÁU
Tất cả người bệnh ĐTĐ ≥ 20 tuổi cần xét nghiệm bilan lipid máu (nhịn ăn hoặc không nhịn ăn) ít nhất mỗi 5 năm một lần. Bilan lipid ở mức tối thiểu bao gồm: Cholesterol toàn phần (TC), HDL-C và Non HDL.C =TC-HDL-C.
Sau nhịn ăn từ 9-12 giờ, nếu nồng độ TG < 400 mg/dL (4,5 mmol/l) thì nồng độ LDL-C có thể được tính toán qua ước đoán dựa vào công thức Friedewald: LDL.C (mmol/l) = TC-HDL.C – (TG/2,2) hoặc LDL.C (mg/dl) = TC-HDL.C – (TG/5). Việc tìm thấy các lipoprotein khác ngoài LDL trong các mảng xơ vữa. Việc định lượng ApoB và các hạt LDL (LDL-P) cũng được khuyến cáo trong thời gian gần đây. Ngoài ra những bệnh nhân ĐTĐ týp 2 lớn tuổi cần lưu ý trước khi đưa kết luận RLLPM cần xem xét các bệnh nhân này sử dụng một số thuốc (bảng 2) hoặc do tiết thực, bệnh tật, các rối loạn chuyển hóa có thể gây RLLPM thứ phát (Bảng 3).
Bảng 2. Thuốc có thể làm tăng nồng độ LDL.C và TG
| Thuốc làm tăng LDL.C | Thuốc làm tăng TG |
| Progestins
Anabolic steroids Danazol Isotretinoin Thuốc ức chế MD (cyclosporine) Amiodarone Thiazide Glucocorticoids Thiazolidinediones Fibric acids (tăng TG nặng ) Long chain omega-3 fatty acids (trong tăng TG nặng nếu chứa docosahexaenoic acid)
|
Estrogens
Tamoxifen Raloxifene Retinoids Thuốc ức chế MD(cyclosporine, sirolimus) Interferon Ức chế Beta( non-beta 1 selective) Thuốc tâm thần (fluperlapine, clozapine, olanzapine) Ức chế Protease Thiazide Glucocorticoids Rosiglitazone Bile acid sequestrants L-asparaginase Cyclophosphamide |
Bảng 3. Đặc điểm về tiết thực và bệnh tật, các rối loạn, thay đổi tình trạng chuyển hóa có thể làm tăng nồng độ LDL.C và hoặc TG
| Nguyên nhân | Tăng LDL.C | Tăng TG |
| Tiết thực
Thừa năng lượng Tăng mỡ bảo hòa Tăng mỡ dạng trans Tăng tiêu thụ đường Uống nhiều rượu Tăng cân Chán ăn thần kinh |
+ + +
+ + |
+
+ + + |
| Bệnh tật, các rối loạn, và thay đổi tình trạng chuyển hóa | Tăng LDL.C | Tăng TG |
| Bệnh thận mạn
Hội chứng thận hư Tắc đường mật Đái tháo đường Hội chứng chuyển hóa Nhiểm HIV Rối loạn tự miễn Suy giáp Thai nghén Hội chứng buồng trứng đa nang Mãn kinh kèm giảm nồng độ estrogen |
+
+ +
+ + + + + + |
+
+
+ + + + + + + + |
3. MỤC TIÊU ĐIỀU TRỊ RỐI LOẠN LIPID MÁU
Theo các khuyến cáo trước đây rối loạn lipid máu (RLLPM) được định nghĩa là sự gia tăng bất thường trong máu nồng độ các thành phần như cholesterol toàn phần (TC), LDL- cholesterol (LDL.C) và/hoặc tăng triglycerid (TG) và/hoặc giảm HDL- cholesterol (HDL.C).
Tuy nhiên các khuyến cáo hiện nay đã bổ sung thêm giá trị Non HDL.C và Apo B. Rối loạn các thành phần lipid kéo dài sẽ gây tổn thương nhiều cơ quan trong đó tổn thương xơ vữa động mạch, làm hẹp mạch máu và là nguyên nhân chủ yếu của bệnh tim mạch xơ vữa (BTMXV).
Bảng 4. Mục tiêu điều trị về lipid cho bệnh nhân ĐTĐ týp 2 (AACE 2018).
| Loại nguy cơ | YTNCa/Nguy cơ 10 năm b
(Thang điểm Framingham) |
Mục tiêu điều trị | ||
| LDL.C
(mg/dl) |
Non-HDL.C
(mg/dl) |
ApoB
(mg/dl) |
||
| Cực kỳ cao | -BTMXV tiến triễn bao gồm cơn đau thắt ngực không ổn định sau khi đạt LDL.C < 70mg/dl
-Bệnh tim mạch sẵn có trên bệnh nhân ĐTĐ, Bệnh thận mạn giai đoạn 3/4 hoặc tăng cholesterol gia đình dị hợp tử (HeFH) Tiền sử gia đình có BMV sớm ( nam <55 và nữ <65 tuổi) |
< 55 | < 80 | < 70 |
| Rất cao | -HCV cấp có từ trước hoặc gần đây, bệnh động mạch cảnh hoặc động mạch ngoại biên, nguy cơ 10 năm >20%
-Bệnh ĐTĐ hoặc bệnh thận mạn 3/4 kèm 1 hoặc nhiều YTNC -Tăng cholesterol gia đình dị hợp tử (HeFH) |
< 70 | < 100 | < 80 |
| Cao | ≥ 2 YTNC và nguy cơ 10 năm ≥ 10% hoặc nguy cơ tương đương BMVc, bao gồm Bệnh ĐTĐ hoặc bệnh thận mạn 3/4, không có YTNC nào khác | < 100 | < 130 | < 90 |
| Trung bình | ≥ 2 YTNC và nguy cơ 10 năm < 10% | < 130 | < 160 | NR |
| Thấp | ≤ 1 YTNC | < 160 | < 190 | NR |
- Các YTNC độc lập chính là tăng LDL-C, Hội chứng buồng trứng đa nang,thuốc lá , THA ( ≥140/90 mm Hg hoặc đang dùng thuốc), hoặc giảm HDL.C (<40 mg/dL), gia đình có BMV (thế hệ thứ nhất nam dưới 55 và nữ dưới 65 tuổi), bệnh thận mạn giai đoạn 3,4, vôi hóa ĐMV và tuổi (nam ≥45; nữ ≥55 tuổi ). trừ 1 YTNC nếu tăng HDL.C.
- Thang điểm Framingham nguy cơ 10-năm .
- Nguy cơ BMV tương đương bao gồm ĐTĐ và biểu hiện lâm sàng BTMXV ngài BMV (bệnh ĐM ngoại biên, phình ĐM chủ bụng và ĐM cảnh )
Bảng 5. Mục tiêu lipid máu ở bệnh nhân ĐTĐ týp 2 (AACE-2018)
| Thành phần lipid | BN ĐTĐ týp 2 nguy cơ cao (không có NC chính* và/hoặc < 40 tuổi | BN ĐTĐ týp 2 nguy cơ rất cao (kèm ≥ 1 NC chính BTMXV* hoặc đã có BTMXV |
| LDL.C (mg/dl) | < 100 | < 70 |
| Non-HDL.C(mg/dl) | < 130 | < 100 |
| Triglycerides(mg/dl) | < 150 | < 150 |
| ApoB (mg/dl) | < 90 | < 80 |
| LPL-P (nmol/l) | < 1.200 | < 1.000 |
| TC/HDL.C | < 3,5 | < 3,0 |
* THA,TS gia đình BTMXV, ↓HDL.C , hút thuốc lá
4. ĐIỀU TRỊ RỐI LOẠN LIPID MÁU KHÔNG DÙNG THUÔC
Các biện pháp can thiệp lối sống, bao gồm giảm cân, tăng hoạt động thể lực và liệu pháp dinh dưỡng cũng như hạn chế yếu tố nguy cơ giúp bệnh nhân giảm rối loạn lipid máu hạn chế BTMXV.
4.1. Giảm cân
Giảm cân có thể làm giảm cholesterol máu và TG . Nên duy trì mức cân nặng lý tưởng và hạn chế béo dạng nam dành cho người Nam Á trong đó BMI không quá 23, Vòng bụng nam giới không quá 90 cm và nữ giới không quá 80 cm
4.2. Liệu pháp dinh dưỡng
Nên sử dụng 30-35% năng lượng từ chất béo, 10-15% từ protein và 50-55% từ carbohydrate (tối thiểu 130 gam/ngày). Chất béo cũng cần cho cơ thể vì thế không nên quá hạn chế trong thực đơn hằng ngày mà cần chọn lựa phù hợp. Ngoài ra việc kiểm soát đường huyết có lợi thay đổi nồng độ lipid huyết tương, đặc biệt ở những bệnh nhân với TG máu rất cao .
Hạn chế thực phẩm
– Hạn chế thức ăn chứa Cholesterol.
Cholesterol từ thực phẩm chủ yếu từ nguồn thịt động vật do vậy lý tưởng nhất là ăn dưới 200mg cholesterol/ngày. Nguồn gốc cholesterol từ: Lòng đỏ trứng, Gan và các phủ tạng khác, Thịt nhiều mỡ và da của gia cầm, Sản phẩm giàu chất béo từ sữa (sữa toàn phần, cream, pho-mat).
– Hạn chế thức ăn chứa Acid béo bão hòa (saturated fatty acids)
Acid béo bão hòa chứa trong các sản phẩm có nguồn gốc động vật ( sữa, phô mai, thịt mỡ bò, heo)… Da của các loại gia cầm (gà, vịt, ngan..) hoặc nguồn thực vật (dầu dừa, dầu cọ cũng có lượng bão hòa cao). Các chất béo bão hòa để sản xuất ra cholesterol tại gan . Ăn thừa chất béo bão hòa sẽ làm tăng cholesterol máu, đặc biệt là LDL.C . Các khuyến cáo mức tiêu thụ acid béo bão hòa ≤ 7% của tổng năng lượng (người 50kg, có nhu cầu năng lượng 1500 kcal/ngày, tổng số lượng calo từ nguồn chất béo bão hoà 7% là 105kcal tương đương với 12 gram mỡ).
– Hạn chế thức ăn chứa chất béo chuyển dạng trans (Trans-Fats )
Chất béo dạng trans được tạo ra khi dầu dạng lỏng được cho vào chất béo dạng rắn. Quá trình này được gọi là hydro hoá (hydrogenation). Chất béo dạng trans hoạt động như chất béo bão hoà và có thể làm tăng lượng LDL.C và giảm HDL.C. Chất béo dạng trans được ghi trên nhãn thành phần và có thể nhận biết chúng một cách dễ dàng. Những thực phẩm chứa < 0,5 gram trans fat có thể coi là không có chất béo dạng này. Nguồn của trans fat thường thấy trong thực phẩm chế biến như bánh snack (bánh quy giòn, khoai tây chiên) bánh nướng (bánh xốp nướng, bánh quy dẹt nhỏ) với hydrogenated oil. Margarin, Mỡ pha vào bánh cho xốp giòn.
Khuyến khích sử dụng thực phẩm
– Nên sử dụng acid béo không bão hòa đơn (monounsaturated fatty acids) .
Nguồn chất béo đơn bão hoà từ: Quả lê, Quả hạnh, đào lộn hột, hồ đào, lạc, Dầu ô-liu, Dầu lạc,Vừng – Các chất béo này có chức năng làm giảm LDL nhưng không ảnh hưởng tới các HDL.C Acid béo không bão hòa đơn được khuyến cáo 10%-15% tổng năng lượng.
– Nên sử dụng Acid béo không bão hòa đa (polyunsaturated fatty acids).
Nguồn gốc các chất béo này từ Dầu ngô, Dầu hạt bông, Dầu cây rum, Dầu đậu nành, Dầu hạt hướng dương, Quả óc chó, Quả bí ngô, Mayonaise, Dầu trộn salad. Tác dụng có thể hạ mức cholesterol trong máu.Tuy nhiên tiêu thụ nhiều chất béo không bão hòa đa thì sẽ lượng HDL.C cũng giảm theo. Chất béo không bão hòa đa chứa nhiều năng lượng, cho nên được khuyến cáo 7-10% tổng năng lượng. Acid béo Omega-3. Nguồn gốc động vật bao gồm Cá ngừ, Cá trích, Cá thu, Cá hồi, Cá Sardine…..
Một số nguồn thực vật như Sản phẩm từ đậu nành, Hạt dẻ cười, Hạt hạnh nhân
– Nên sử dụng Sterol và stanols thực vật
Sterol và stanols thực vật tự nhiên được tìm thấy trong màng tế bào thực vật và thực vật các phiên bản của cholesterol giúp hạn chế hấp thu cholesterol vào cơ thể. Đây là những đặc điểm làm cho chúng hữu ích trong việc giảm cholesterol. Nghiên cứu cho thấy một liều hàng ngày của thực vật sterol và stanols làm giảm LDL.C mà không cần các tác động tiêu cực trên HDL.C. Sterol và stanols thực vật được khuyến cáo bởi NCEP-ATP III trong đánh giá và điều trị của tăng Cholesterol máu. Sterol thực vật 2gram /ngày được khuyến khích để sử dụng như một thành phần của một chế độ ăn uống chất béo thấp để làm giảm LDL.C. Theo ADA thực vật sterol cho giảm LDL.C 10-15% và cholesterol toàn phần. FDA đã phê duyệt sterol thực vật.
– Nên sử dụng các chất xơ .
Những thực phẩm nhiều chất xơ hòa tan thường được dung nạp tốt, có hiệu quả giảm LDL-C.
Liều khuyến cáo 5-15 g chất xơ hòa tan mỗi ngày. Để điều trị tốt RLLP máu, chế độ ăn cần 25-40g chất xơ, tối thiểu 7-13 g chất xơ hòa tan.
4.3. Hoạt động thể lực
Thường xuyên tập thể dục có thể giúp cải thiện nồng độ LDL.C, HDL.C và Triglyceride, thời gian ít nhất 150 phút/tuần, trung bình 30-45 phút tập thể dục mỗi ngày, khoảng 5 buổi /tuần. Đối với bệnh nhân ĐTĐ cần kiểm tra điện tim và soi đáy mắt trước khi bắt đầu liệu trình tập, chú ý tần số tim thích nghi theo độ tuổi, khoảng 50-70% tần số tim tối đa. (Bệnh nhân 60 tuổi, tần số tim thích nghi=(220-60) x 50% = 80 đến 110 lần/phút.
4.4. Giấc ngủ
Nghỉ ngơi đầy đủ là quan trọng cho việc duy trì năng lượng và tinh thần thoải mái. Tất cả các bệnh nhân cần được tư vấn về giấc ngủ trung bình khoảng 7 giờ mỗi đêm, hỗ trợ bằng chứng. Có sự liên quan giữa thời gian ngủ 6-9 giờ mỗi đêm với giảm yếu tố nguy cơ tim mạch chuyển hóa. Thiếu ngủ làm trầm trọng thêm tình trạng kháng insulin, tăng huyết áp, tăng đường huyết và rối loạn lipid máu và tăng viêm yếu tố cytokine
4.5. Hạn chế yếu tố nguy cơ
Hút thuốc lá
Hạn chế hút thuốc, tốt nhất nên bỏ thuốc để có thể cải thiện nồng độ HDL.C và kháng insulin.
Rượu bia
Sử dụng rượu bia nhiều có nguy cơ làm tăng TG máu. Sử dụng rượu bia mức trung bình có thể làm tăng nồng độ HDL cholesterol. Tuy nhiên những lợi ích trên không đủ thuyết phục cho những ai không uống được.
Stress
Tình trạng bị stress có thể khiến quá trình trao đổi chất chậm lại ở những phụ nữ dùng nhiều chất béo, do đó họ dễ bị tăng cân hơn so với những người không bị stress.
5. ĐIỀU TRỊ RỐI LOẠN LIPID MÁU BẰNG THUỐC
5.1. Liệu pháp Statins
Liệu pháp statin luôn ưu tiên trong RLLPM nói chung và ĐTĐ nói riêng. Statin cường độ trung bình sẽ giảm nồng độ LDL-C khoảng 30% – 50% và statin cường độ cao giảm ≥ 50%, mặc dù phản ứng của từng bệnh nhân dự kiến sẽ thay đổi đáng kể. Thường bắt đầu statin cường độ cao và giảm liều nếu bệnh nhân không dung nạp. Những người khác muốn bắt đầu với một statin cường độ vừa phải và điều chỉnh nếu nồng độ cholesterol gây xơ vữa không đạt . Bởi vì bệnh nhân thường ngừng điều trị khi họ gặp các tác dụng phụ, điều này quan trọng cho các bác sĩ lâm sàng để áp dụng các chiến lược mà họ cảm thấy sẽ đưa ra các khả năng lớn nhất của sự tuân thủ lâu dài cho bệnh nhân.Tuy nhiên, nếu điều trị bằng thuốc bảng quy chiếu đồng thuận rằng đã giảm được ít nhất 30% lượng cholesterol gây xơ vữa nên được nhắm mục tiêu.
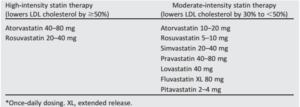
Bảng 6. Liệu pháp statin theo cường độ (ADA 2018)
Bệnh nhân ĐTĐ týp 2 thường có tăng tỷ lệ bất thường về lipid máu, góp phần vào nguy cơ cao về BTMXV. Nhiều thử nghiệm lâm sàng đã chứng minh tác dụng có lợi của thuốc giảm lipid (statin) trên tiên lượng BTMXV trong các đối tượng có và không có bệnh mạch vành
Hầu hết các thử nghiệm của Statin và tiên lượng BTMXV để thăm dò liều đặc hiệu của statin so với giả dược hoặc các loại statin hơn là hướng tới mục tiêu cụ thể LDL.C.
Tiêu chuẩn ADA 2018 đã được sửa đổi để khuyên cáo khi nào liệu pháp statin khởi đầu và liệu pháp statin tăng cường (cường độ cao so với trung bình) dựa trên bối cảnh nguy cơ bảng dưới đây.
Bảng 6. Khuyến cáo sử dụng và phối hợp với Statin ở bệnh nhân ĐTĐ (ADA-2018)
| Tuổi | Yếu tố nguy cơ | Khuyến cáo cường độ statin * và phối hợp thuốc |
| dưới
40 tuổi |
Không
Yếu tố nguy cơ cao BTMXV** LDL.C ≥ 70 mg/dl mặc dù dung nạp liều cao statin |
không
Cao Xét phối hợp Ezetimibe hoặc ức chế PCSK9 |
| > 40 tuổi | Không
Yếu tố nguy cơ BTMXV** LDL.C ≥ 70 mg/dl ặc dù dung nạp liều cao statin |
Trung bình
Cao Xét phối hợp Ezetimibe hoặc ức chế PCSK9 |
| *Phối hợp liệu pháp thay đổi lối sống
** Bệnh tim mạch xơ vữa (BTMXV) bao gồm LDL cholesterol ≥ 100 mg/dL (2.6 mmol/L), tăng huyết áp, hút thuốc lá, thừa cân và béo phì và tiền sử gia đình có bệnh tim mạch xơ vữa trẻ tuổi. |
||
Bảng 8. Các thuốc phối hợp với statin làm tăng nguy cơ bệnh cơ và tiêu cơ vân
| Kháng sinh | Nhóm ức chế calci | Nhóm khác |
| Itraconazole | Verapamil | Ciclosporin |
| Ketoconazole | Diltiazem | Danazol |
| Posaconazole | Amlodipine | Amiodarone |
| Erythromycin | Ranolazine | |
| Clarithromycin | Nefazodone | |
| Telithromycin | Gemfibrozil | |
| HIV protease inhibitors | Grapefruit juice |
5.2. Liệu pháp kết hợp làm giảm LDL cholesterol
Liệu pháp kết hợp statin và các thuốc điều trị lipid máu khác chỉ nên thực hiện sau khi sử dụng statin liều tối đa hoặc không dung nạp statin liều cao mà mục tiêu lipid máu chưa đạt .
5.2.1. Phối hợp Statins và Ezetimibe
Ezetimide ức chế Niemann-Pick C1 Like 1 Protein (NPC1L1) tại niêm mạc ruột non kết quả giảm cholesterol ngoại sinh hấp thu sau khi ăn. Ban đầu ↓ LDL-C 10%-18% đưa đến sự điều hòa ngược thụ thể LDL, ↓ Apo B 11%-16%. Khi kết hợp với statin được thêm vào ↓ LDL-C 25%, tổng cộng ↓ LDL-C 34%-61%.
Nghiên cứu IMPRO-IT (The IMProved Reduction of Outcomes : Vytorin Efficacy International Trial ) là một thử nghiệm ngẫu nhiên so sánh việc bổ sung các Ezetimibe vào điều trị simvastatin so với sử dụng simvastatin một mình trên đối tượng ≥ 50 tuổi đã có HC vành cấp trong vòng 10 ngày trước và nồng độ LDL cholesterol ≥ 50 mg / dL (1,3 mmol / L). Trong đó bệnh nhân ĐTĐ (27%), sự kết hợp của cường độ trung bình simvastatin (40mg) và ezetimibe (10 mg) cho thấy giảm đáng kể các biến cố tim mạch với giảm nguy cơ tuyệt đối 5% (40% so với 45%) và RR giảm 14% (RR 0.86 [95% CI 0,78-0,94]) so với dùng đơn độc simvastatin cường độ trung bình (40 mg) (53). Vì vậy, những người tham gia IMPRO-IT, những người chỉ có thể nhận statin cường độ trung bình việc bổ sung các ezetimibe để statin điều trị cần được xem xét.
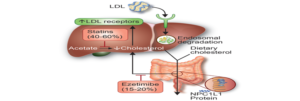
Sơ đồ 2. Cơ chế tác dụng Ezetimibe đơn độc và phối hợp với Statin trong điều trị giảm cholesterol
5.2.2. Phối hợp Statins và thuốc ức chế PCSK9
Chất PCSK9 (Proprotein Convertase Subtilisin Kexin Type 9) là một serineprotease có vai trò trung tâm trong quá trình chuyển hóa cholesterol ở gan bằng cách tăng cường sự thoái biến thụ thể LDL.
Thụ thể LDL có thể được tái chế hoặc bị phân hủy trong tiêu thể (lysosome) sau khi bị trung hòa. Chất PCSK9 lưu hành sẽ liên kết trực tiếp với các thụ thể LDL đưa các thụ thể LDL này đến ty thể (lysosome), tăng cường sự thanh thải của chúng trong các tế bào gan đểthoái biến và ngăn ngừa việc tái chế các thụ thể LDL trở lại bề mặt tế bào sau khi được trung hòa. Ức chế PCSK9 đã được đề xuất. Trong số đó, các kháng thể đơn dòng nhân bản hoàn toàn kháng lại PCSK9 ghi nhận các dữ liệu trên người đượcthành công cho đến nay.
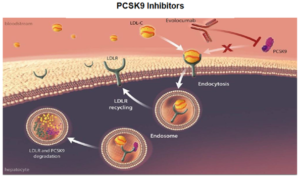
Sơ đồ 3. Cơ chế tác dụng nhóm ức chế PCSK9
Nhóm ức chế PCSK9 làm LDL-C 48%-71%, non HDL-C 49%-58%, Total-C 36%-42%, Apo B 42%-55% .Các thử nghiệm về kiểm soát và giả dược đánh giá việc bổ sung các chất ức chế PCSK9 mới (Evolocumab và Alirocumab), đã đạt liều dung nạp tối đa của liệu pháp statin trong những người tham gia đều có nguy cơ cao đối với BTMXV chứng minh giảm LDL.C từ 36% đến 59%. Những tác nhân này cần được xem như là một liệu pháp hổ trợ cho bệnh nhân ĐTĐ có nguy cơ cao về biến cố BTMXV, những người đòi hỏi hạ thấp thêm LDL.C hoặc người yêu cầu nhưng lại không dung nạp với điều trị statin cường độ cao.
Trong thử nghiệm lâm sàng trên 77 bệnh nhân với tăngcholesterol máu gia đình dị hợp tử, chất Alirocumab giảm LDL-C từ 29% – 43% khi chích 150-300 mg mỗi 4 tuần và 68% khi chích 150 mg mỗi 2 tuần. Ngoài ra, các liều cao hơn của Alirocumab, 150 mg mỗi 2 tuần, cho thấy sự gia tăng đáng kể nồng độ HDL-C và ApoA1 lần lượt từ 6,5% và 8,8%, cũng như giảm apo B và non-HDL-C. Trong thử nghiệm GAUSS khi điều tra tính hiệu quả và tính an toàn của Evolocumab ở 160 bệnh nhân không dung nạpstatin, dựa trên sự phụ thuộc vào liều, Evolocumab làm giảm đáng kể nồng độ LDL-C từ 40,8% đến 50,7% so với ban đầu.
5.2.3. Ức chế chất vận chuyển cholesterol ester (Cholesteryl ester transfer protein inhibitor)
Sự ức chế CETP làm tăng HDL.C và làm giảm LDL.C. Đây là loại thuốc không có khả năng để sử dụng trong lâm sàng, nhưng các nghiên cứu cung cấp cái nhìn sâu sắc hơn về tác động của giảm LDL cholesterol đối với các biến cố tim mạch.
Tổng cộng có bốn thử nghiệm đã được tiến hành, ba trong số đó đã không cho thấy lợi ích Trong số này, một cho thấy tác hại và hai đã bị dừng lại sau khoảng 2 năm và do đó không có đủ thời gian hoặc sức mạnh để xác định lợi ích. Nghiên cứu cơ bản, ngẫu nhiênĐánh giá ảnh hưởng của Anacetrapib qua sự thay đổi lipid (Evaluation of the Effects of Anacetrapib Through Lipid-modification trial = REVEAL) ghi danh 30.449 bệnh nhân với ASCVD (70).
Tất cả bệnh nhân được điều trị atorvastatin chuyên sâu và được phân ngẫu nhiên thành anacetrapib hoặc giả dược.Trong thời gian theo dõi trung bình là 4,1 năm, kết quả chính (tử vong mạch vành, MI, hoặc mạch vành) đã giảm đáng kể khi bổ sung anacetrapib từ 11,8 đến 10,8%, với tỷ số nguy cơ (HR) là 0,91 (P = 0,004) ).
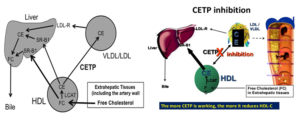
Sơ đồ 4 và 5. Cơ chế tác dụng CETP và nhóm ức chế CETP
Sự khác biệt tương đối về rủi ro là tương tự nhau giữa nhiều phân nhóm được xác định trước, bao gồm 11.320 bệnh nhân tiểu đường (37% thử nghiệm). Lợi ích dường như có liên quan đến việc giảm LDL (và rộng hơn không HDL) trái ngược với việc tăng HDL. LDL.C trung bình đạt được là 63 mg / dL so với 53 mg / dL ở điểm giữa thử nghiệm ở nhóm giả dược và anacetrapib, tương ứng. Nghiên cứu này tái khẳng định lợi ích của việc giảm LDL.C trong việc giảm các biến cố tim mạch.
5.2.4. Chất ức chế MTP (Microsomal Triglyceride Transfer Protein Inhibitors)
Protein vận chuyển triglyceride (TG) trong ty thể (Microsomal Triglyceride Transfer Protein) được trình diện chủ yếu trong các tế bàogan và tế bào ruột non (enterocytes), mà tác dụng chúng được đòihỏi trong quá trình tổng hợplipoprotein chứa apo B. Chất MTP vận chuyển TG, phospholipids và este cholesteryl đến apo B trong hệ lưới nội mô và có một vai tròquan trọng trong quá trình tổng hợp lipoprotein tỷ trọng rất thấp (VLDL) vàchylomicrons trong gan và ruột non.
Sự ức chế MTP làm giảm tổng hợp và tiết VLDL ở gan bằng cách ức chếkết hợp lipid (lipidation) của apo B . Chất ức chế MTP có thể đảo ngược sự tăng sản xuất và bài tiết của VLDLs tại gan gây ra do kháng insulin. Hơn nữa, sự ức chế của MTP trong tế bào ruột non có thể góp phần vào việc giảm TG huyết tương nhờ giảm hấp thụ chất béo của chế độ ăn thông qua chylomicron.
Tác động thuốc ức chế phân tử nhỏ đường uống của MTP, chất Lomitapide, được phát triễn và nó đã được chấp thuận để điều trị tăng cholesterol máu có tính gia đình đồng hợp tử. Nhóm này có tác dụng LDL-C 40%, TC 36%, apo B 39%, TG 45%, và non-HDL-C 40% (phụ thuộc liều lượng).
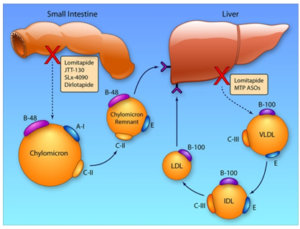
Sơ đồ 6. Cơ chế tác dụng kép ức chế tiết TC và TG trên tế bào gan và ruột non của nhóm ức chế MTP
Trong một thử nghiệm giai đoạn III của 29 tăng cholesterol gia đình đồng hợp tử với LDL-C trung bình 336 mg / dL mặc dù trước đó điều trị hạ lipid , lomitapide giảm LDL-C 50% ở 26 tuần điều trị và 38% tại 52 tuần điều trị . Nồng độ HDL-C đã được giảm đáng kể khoảng 12% ở 26 tuần, nhưng trở lại mức trước khi điều trị 78 tuần. Tác dụng phụ thường gặp bao gồm tiêu chảy, buồn nôn, và đau bụng. Trong các nghiên cứu lâm sàng giai đoạn sớm, Lomitapide làm tăng TG gan phụ thuộc liều, liên quan ức chế MTP gan và bắt giửVLDLs trong gan. Trong thử nghiệm giai đoạn III, 10 bệnh nhân cho thấy tăng nồng độ men gan và phục hồi với sự thay đổi liều. Kết quả từ nghiên cứu này cho thấy có thể chấp nhận bối cảnh nguy cơ-lợi ích và Lomitapide đã được cục quản lý thực phẩm Dược Hoa Kỳ (FDA).phê duyệt để điều trị cho tăng cholesterol máu đồng hợp tử gia đình.
5.2.5.Antisense oligonucleotide kháng Apolipoprotein B(Antisense Oligonucleotide against Apolipoprotein B)
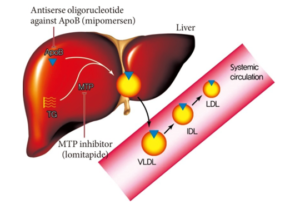
Sơ đồ 7. Cơ chế tác dụng nhóm kháng Apo B
Apo B là một loại cấu trúc protein chính của các lipoproteins gây xơ vữa (lipoprotein chứa Apo-B ). Nó có một vai trò quan trọng trong việc kết hợp và tiết VLDL từ gan. Nồng độ apo B là một chỉ số đáng tin cậy của tổng số hạt lipoprotein xơ vữa như LDL.C nhỏ đậm đặc.
Mipomersen là một chất tổng hợp 20 nucleotide antisense oligonucleotide có thể liên kết với apo B mRNA thông qua bổ sung tương tác. Tiến trình kết hợp (hybridization) của mipomersen với mục tiêu apo B mRNA tạo ra một chất nền cho RNase H1, mà kết quả làm giảm nồng độ apo B mRNA của apo B và sản xuất của apoprotein B . Thuốc làm ↓ LDL-C 21%, ↓TC 19%, ↓apo B 24%, and ↓non-HDL-C 22% .
Hai biến đổi hóa học đã được thực hiện để cơ cấu nucleotide của mipomersen. Đầu tiên, các mối liên kết giữa nucleotide (internucleotide) được biến đổi hóa học như là este phosphorothioated, mà kết quả gây đề kháng sự thủy phân hoặc thoái hóa bởi nucleases và tăng liên kết với protein huyết tương để tạo điều kiện đểphân phối thuốc và hấp thu.
Việc sửa đổi thứ hai, chèn của đường methoxyethyl tồn dư vào vị trí đầu tiên và 5 vị cuối cùng đã mipomersen đượcổn định hơn và tăng ái lực
Đối với các đối tượng có rối loạn lipid máu nhẹ, 12 tuần điều trị với mipomersen với liều 50-400 mg mỗi 3 tuần làm apo B và LDL-C tối đa lần lượt là 50% và 35%, phụ thuộc vào liều.Hiệu quả của liệu pháp mipomersen ở bệnh nhân tăng cholesterol gia đình đã được khẳng định trong một số thử nghiệm giai đoạn II và III .
Thử nghiệm giai đoạn III trên 44 bệnh nhân tăng cholesterol máu có tính gia đình dị hợp tử cho thấy sự giảm đáng kể nồng độ apo B và LDL-C tối đa là 33% và 34%. Trong một thử nghiệm khác giai đoạn III ở những bệnh nhân tăng cholesterol máu có tính gia đình đồng hợp tử và đã được nhận liều tối đa dung nạp để điều trị hạ lipid, 26 tuần điều trị mipomersen dẫn đến giảm điều chỉnh giả dược của apo B và LDL-C 24% và 21%.
Từ kết quả của thử nghiệm này, Mipomersen được FDA Hoa Kỳ chấp thuận để điều trị tăng cholesterol máu có tính gia đình đồng hợp tử. Các thử nghiệm lâm sàng khác ở bệnh nhân tăng cholessterol tiên phát cũng cho thấy phụ thuộc vào liều và nhất quán giảm apo B và LDL-C với việc điều trị mipomersen.
Tần suất tác dụng phụ thường xuyên phối hợp với mipomersen là phản ứng tại chỗ tiêm, các triệu chứng giống như cúm và tăng cao men gan. Các mối quan tâm an toàn chính là sự tích tụ TG ở gan có lẽ do rối loạn tiết VLDLs, đó là cơ chế tương tự như của bắt giữa TG như chất ức chế MTP.
Việc tăng các men transaminase có thể đảo ngược với điều chỉnh liều hoặc thậm chí thoáng qua với tiếp tục điều trị, và tăng mỡ gan xảy ra sớm và được ổn định theo thời gian. Những hậu quả lâm sàng lâu dài của tăng gan TG là chưa rõ. Hiện vẫn còn là mối quan tâm thường xuyên theo dõi chức năng gan được yêu cầu trong các bệnh nhân nhận mipomersen.
5.2.6. Thuốc hướng APO-A1 (APOLIPOPROTEIN A1 MIMETICS)
Nồng độ cao của HDL-C trong huyết thanh là yếu tố bảo vệ của BTMXV. Trong đó ApoA1 là một trong những apolipoprotein cấu thành chính của hạt HDL trưởng thành. ApoA1 lấy bớt cholesterol từ đại thực bào trong các tổn thương xơ vữa động mạch thông qua dãi ATP-binding A1 (ABCA1), đồng thời kích hoạt vận chuyển ngược cholesterol.
Vai trò trọng tâm của ApoA1 bao gồm làm cho HDL như là một mục tiêu thu hút về sự thay đổi nguy cơ BTMXV. Các chất giống (mimetics) ApoA1 là một nhóm thuốc được thiết kế để bắt chước tác động của ApoA1 và HDL để đảo ngược sự tiến triển của xơ vữa động mạch.
Franceschini và cộng sự (1980) trình bày một phiên bản ApoA1 gọi ApoA1 Milano trong ba cá nhân người Ý với tuổi thọ dài và xơ vữa động mạch thấp, mặc dù mức HDL.C thấp và tăng TG. Sự biến đổi gen này có một Arginine để thay Cysteine, cho phép tạo ra dimer của ApoA1.
Trong một nghiên cứu lâm sàng ở bệnh nhân có hội chứng mạch vành cấp, 5 tuần truyền tái tổ hợp ApoA1 Milano giảm 4,2% khối lượng mảng xơ vữa so với mức cơ bảnđược đo bằng siêu âm nội mạch HDL tái tổ hợp chứa ApoA1 người bình thường kết hợp với phospholipid cũng đã được thử nghiệm.
Trong nghiên cứu ERASE (Effect of rHDL on Atherosclerosis Safety and Efficacy=Ảnh hưởng của rHDL trên tính An toàn và tính hiệu quả Xơ vữa động mạch ), bệnh nhân với hội chứng vành cấp nhận HDL tái tổ hợp (CSL-112) trong 4 tuần, kết quả là không có ảnh hưởng đáng kể đến mảng xơ vữa hoặc khối lượng mảng bám so với giả dược.
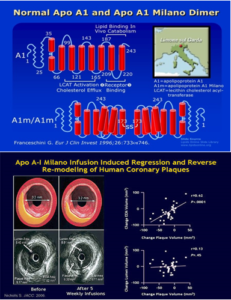
Sơ đồ 8. Cấu trúc và hiểu quả trên lipid máu của thuốc hướng Apo A1
6. ĐIỀU TRỊ TĂNG TRIGLYCERIDES
Can thiệp lối sống là phương thức cơ bản nỗ lực giảm TG, bao gồm giảm cân nếu thừa cân hoặc béo phì mục tiêu ban đầu là giảm 5% -10% trọng lượng cơ thể), hoạt động thể lực (≥ 150 phút / tuần của hoạt động cường độ trung bình hoặc cao hơn) và hạn chế rượu, đường hoặc thực phẩm chứa carbohydrate.
Bệnh nhân có nồng độ TG ≥ 500 mg/dL, mục tiêu chính của điều trị là giảm TG< 500 mg/dL để giảm nguy cơ viêm tụy. Nếu nồng độ TG từ 500-999 mg/dL, thuốc giảm TG máu hoặc một statins (nếu không có tiền sử viêm tụy) có thể lựa chọn loại thuốc đầu tiên là hợp lý.Chứng tăng chylomicron máu thường xuyên hiện diện ở bệnh nhân TG ≥ 750 mg / dL. Đối với những bệnh nhân này, một chế độ ăn uống ít chất béo (<15% năng lượng) có thể hữu ích để giảm thu nhận của các hạt chylomicron mới vào máu.
Bệnh nhân có nồng độ TG 200-499 mg/dL, mục tiêu chính của điều trị là để hạ thấp nồng độ cholesterol gây xơ vữa (non-HDL-C và LDL-C) để giảm thiểu nguy cơ về biến cố BTMXV. Thay thế một phần carbohydrate của chế độ ăn phối hợp mỡ không bão hòa và protein có thể giúp làm giảm nồng độ TG máu và non-HDL-C. Đối với bệnh nhân TG cao (200-499 mg / dL), statins là tác nhân hiệu quả nhất về giảm nồng độ cholesterol gây xơ vữa và apoB, bằng chứng từ các phân nhóm tăng TG trong nghiên cứu kiểm chứng cho thấy statin giảm nguy cơ tai biến BTMXV bệnh nhân tăng TG trong giới hạn này.
Nếu dung nạp tối đa statin nhưng lại không giảm non-HDL-C dưới mục tiêu ở những bệnh nhân có nồng độ TG: 200-499 mg / dL, phối hợp thêm một thuốc chủ yếu làm giảm TG máu và VLDL-C giúp đạt được mục tiêu cholesterol gây xơ vữa.
Phân tích nhóm nhỏ từ các nghiên cứu tiên lượng về tim mạch đã cung cấp bằng chứng gợi ý của giảm nguy cơ tai biến BTMXV với việc bổ sung của một thuốc giảm TG máu vào liệu pháp statin, đặc biệt những bệnh nhân kết hợp tăng TG và giảm HDL-C.
Nếu nồng độ TG lúc đói là ≥ 1000 mg/d, thuốc được chỉ định ưu tiên giảm TG và VLDL-C (fibrate, và dầu cá chuỗi dài axit béo omega-3, hoặc acid nicotinic) do các thuốc này sẽ làm giảm nhiều TG. Trên lâm sàng viêm tụy cấp do tăng TG máu quá cao (≥1000 mg/dl) cần sử dụng liệu pháp insulin để giảm TG máu, nếu không hiệu quả đòi hỏi thanh lọc huyết tương (plasmapheresis).
6.1. Kết hợp Statin và Fibrate
Điều trị phối hợp (statin và fibrate) có liên quan với tăng nguy cơ cho mức độ bất thường men gan , viêm cơ và tiêu cơ vân. Nguy cơ tiêu cơ vân là phổ biến hơn với liều cao statin và suy thận. Dường như nguy cơ càng cao hơn khi statin được kết hợp với gemfibrozil so với fenofibrate. Trong nghiên cứu ACCORD, ở những bệnh nhân ĐTĐ týp 2 có nguy cơ cao đối với BTMXV, sự kết hợp fenofibrate và simvastatin không làm giảm tỷ lệ biến cố tim mạch gây tử vong, NMCT không tử vong, hoặc đột quỵ không tử vong so với sử dụng simvastatin một mình. Phân tích các phân nhóm cho thấy sự không đồng nhất trong hiệu quả điều trị với lợi ích tốt cho nam giới với nồng độ TG ≥ 204 mg/dL (2,3 mmol/ L) và HDL.C < 34 mg/dL (0,9 mmol/L).
6.2. Kết hợp Statin và Niacin
Nghiên cứu AIM-HIGH (Atherothrombosis Intervention in Metabolic Syndrome With Low HDL.C /high Triglycerides Impact on Global Health Outcomes) nhằm thử nghiệm ngẫu nhiên trên 3.000 bệnh nhân (khoảng một phần ba bị bệnh ĐTĐ) với đã có BTMXV, nồng độ LDL.C <180 mg/dL [4.7 mmol/L]), nồng độ HDL.C nam <40 mg/dL [1,0 mmol/L] và nữ < 50 mg/dL [1,3 mmol/L], và TG 150-400 mg/dL (1,7-4,5 mmol/L) phối hợp điều trị statin với Niacin phóng thích kéo dài hoặc giả dược.
Các thử nghiệm đã bị dừng sớm do thiếu hiệu quả trênBTMXV (sự kiện đầu tiên của phối hợp tử vong do bệnh mạch vành, NMCT không tử vong, đột quỵ thiếu máu cục bộ, nhập viện vì HC Vành cấp hoặc triệu chứng dẫn đến can thiệp mạch vành hay não) và khả năng tăng đột quỵ do thiếu máu cục bộ trong những ngày điều trị kết hợp. Vì vậy, điều trị kết hợp với statin và Niacin không được khuyến cáo cho việc thiếu hiệu quả trên kết quả chính BTMXV khả năng tăng nguy cơ đột quỵ thiếu máu và tác dụng phụ.
KẾT LUẬN
Bệnh nhân đái tháo đường (ĐTĐ) nhất là bệnh nhân đái tháo đường týp 2 (ĐTĐT2) có nguy cơ cao về bệnh tim mạch xơ vữa (BTMXV). Theo các khuyến cáo trước đây rối loạn lipid máu (RLLPM) được định nghĩa là sự gia tăng bất thường trong máu nồng độ các thành phần như cholesterol toàn phần (TC), LDL- cholesterol (LDL.C) và/hoặc tăng triglycerid (TG) và/hoặc giảm HDL- cholesterol (HDL.C). Tuy nhiên các khuyến cáo hiện nay đã bổ sung thêm tăng Non HDL.C và Apo B. Liệu pháp statin là một tiêu chuẩn trong điều trị rối loạn lipid máu. Từ nhiều thử nghiệm lâm sàng ngẫu nhiên, nó đã được chứng minh là an toàn và hiệu quả trong việc phòng ngừa biến cố tim mạch trong tương lai. Tuy nhiên, vẫn còn, số lượng đáng kể nguy cơ BTMXV tồn dư, ngay cả dưới điều trị statin tối ưu và một phần lớn bệnh nhân không dung nạp hoặc không đáp ứng với liệu pháp statin. Ezetimibe, chất ức chế PCSK9, ức chế CETP, ức chế MTP và chuổi đơn bổ cứu của oligonucleotide (antisense oligonucleotide) kháng với apo B, chất tác dụng giống ApoA1 có thể dẫn đường cho sự cải thiện liệu pháp chống xơ vữa động mạch trên đối tượng nguy cơ này.
TÀI LIỆU THAM KHẢO
- Roh E, Ko SH, Kwon HS, Kim NH, Kim JH, Kim CS, Song KH, Won JC, Kim DJ, Choi SH, Lim S, Cha BY. Prevalence and Management of Dyslipidemia in Korea: Korea National Health and Nutrition Examination Survey during 1998 to 2010. Diabetes Metab J 2013;37:433-49.
- Koo BK. Statin for the primary prevention of cardiovascular disease in patients with diabetes mellitus. Diabetes Metab J 2014;38:32-4.
- Lim S, Park YM, Sakuma I, Koh KK. How to control residual cardiovascular risk despite statin treatment: focusing on HDL-cholesterol. Int J Cardiol 2013;166:8-14.
- Hovingh GK, Davidson MH, Kastelein JJ, O’Connor AM. Diagnosis and treatment of familial hypercholesterolaemia. Eur Heart J 2013;34:962-71.
- Ridker PM. LDL cholesterol: controversies and future therapeutic directions. Lancet 2014;384:607-17.
- DiNicolantonio JJ, Chatterjee S, Lavie CJ, Bangalore S, O’Keefe JH. Ezetimibe plus moderate dose simvastatin after acute coronary syndrome: what are we IMPROVEing on? Am J Med. Epub 2015 Feb 27. DOI:
- Do RQ, Vogel RA, Schwartz GG. PCSK9 Inhibitors: potential in cardiovascular therapeutics. Curr Cardiol Rep 2013;15:345.
- Noto D, Cefalu AB, Averna MR. Beyond statins: new lipid lowering strategies to reduce cardiovascular risk. Curr Atheroscler Rep 2014;16:414.
- Denis M, Marcinkiewicz J, Zaid A, Gauthier D, Poirier S, Lazure C, Seidah NG, Prat A. Gene inactivation of proprotein convertase subtilisin/kexin type 9 reduces atherosclerosis in mice. Circulation 2012;125:894-901.
- Stein EA, Gipe D, Bergeron J, Gaudet D, Weiss R, Dufour R, Wu R, Pordy R. Effect of a monoclonal antibody to PCSK9, REGN727/SAR236553, to reduce low-density lipoprotein cholesterol in patients with heterozygous familial hypercholesterolaemia on stable statin dose with or without ezetimibe therapy: a phase 2 randomised controlled trial. Lancet 2012;380:29-36.
- Sullivan D, Olsson AG, Scott R, Kim JB, Xue A, Gebski V, Wasserman SM, Stein EA. Effect of a monoclonal antibody to PCSK9 on low-density lipoprotein cholesterol levels in statin-intolerant patients: the GAUSS randomized trial. JAMA 2012; 308:2497-506.
- Robinson JG, Farnier M, Krempf M, Bergeron J, Luc G, Averna M, Stroes ES, Langslet G, Raal FJ, Shahawy ME, Koren MJ, Lepor NE, Lorenzato C, Pordy R, Chaudhari U, Kastelein JJ. Efficacy and Safety of Alirocumab in Reducing Lipids and Cardiovascular Events. N Engl J Med 2015.
- Sabatine MS, Giugliano RP, Wiviott SD, Raal FJ, Blom DJ, Robinson J, Ballantyne CM, Somaratne R, Legg J, Wasserman SM, Scott R, Koren MJ, Stein EA. Efficacy and Safety of Evolocumab in Reducing Lipids and Cardiovascular Events. N Engl J Med 2015.
- Rader DJ, Kastelein JJ. Lomitapide and mipomersen: two first-in-class drugs for reducing low-density lipoprotein cholesterol in patients with homozygous familial hypercholesterolemia. Circulation 2014;129:1022-32.
- Dhote V, Joharapurkar A, Kshirsagar S, Dhanesha N, Patel V, Patel A, Raval S, Jain M. Inhibition of microsomal triglyceride transfer protein improves insulin sensitivity nd reduces atherogenic risk in Zucker fatty rats. Clin Exp Pharmacol Physiol 2011;38:338-44.
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam