KHẢO SÁT TÍNH AN TOÀN CỦA FORXIGA (DAPAGLIFLOZIN) TRÊN NGƯỜI BỆNH ĐÁI THÁO ĐƯỜNG TÍP 2 TẠI VIỆT NAM TỪ NGHIÊN CỨU DỮ LIỆU ĐỜI THỰC
Nguyễn Vĩnh Nam1a, Nguyễn Thị Bích Đào2a, Ngô Nhật Long3, Đặng Bích Việt3, Phương Lễ Trí4, Nguyễn Công Lương4, Vũ Đình Hòa3, Nguyễn Hoàng Anh3* 1Bộ môn Quản lý & Kinh Tế Dược, Đại học Dược Hà Nội
2Bệnh viện Tim Tâm Đức
3Trung tâm quốc gia về thông tin thuốc và theo dõi phản ứng có hại của thuốc
4Công ty TNHH AstraZeneca Việt Nam
a: Hai tác giả đóng góp tương đương nhau trong vai trò là tác giả chính của bài báo này
DOI: 10.47122/vjde.2022.52.6
ABSTRACT
This observational, one-arm cohort was conducted to investigate the proportion and incidence rate of adverse drug reactions (ADR) and the determinants to the presence of ADRs among 1001 patients initially treated with Forxiga (dapagliflozin) in 08 hospitals in Vietnam. Within 24 weeks of follow-up, the propotion of presenting ADR was 12,0% (95%CI [10.1-14.2]). The proportion of presenting serious ADR was very low (0,1% or 0,2/100 patient-year). Among ADRs, urinary tract infection had the highest incidence (1,7%, or 4,1/ 100 patient-year). Proportions of presenting hypoglycemiae (0,6%) or ADRs related to modified renal function such as descresed eGFR (0.5%) or decreased creatinine renal clearance (0.4%) were very low. Our logistic regression analysis showed that the patients aged more than 75 was associated with a more likelihood of presenting ADRs than patients aged less than 75 (OR = 5,38, 95% CI: 1,18 – 24,56, p = 0,030). In general, our study shows that (dapagliflozin) was well-torelated, identified no new safety concerns for dapagliflozin, compared with previously published studies as well as the approved summary of product characteristics in Vietnam.
TÓM TẮT
Nghiên cứu quan sát, thuần tập một nhánh này được thực hiện nhằm khảo sát tỷ lệ và tỷ suất gặp phản ứng bất lợi (ADR) liên quan đến thuốc, và các yếu tố làm tăng nguy cơ gặp ADR, trên 1001 bệnh nhân được khởi trị Forxiga (dapagliflozin) tại 08 bệnh viện ở Việt Nam. Trong 24 tuần theo dõi, tỷ lệ gặp ADR là 12,0% (95%CI [10,1-14,2]). Tỷ lệ gặp ADR nghiêm trọng rất thấp (tương ứng tỷ lệ 0,1% và tỷ suất 0,2/100 người bệnh-năm). Trong số các ADR ghi nhận được, nhiễm trùng tiết niệu có tỷ lệ mắc cao nhất (1,7%, tương ứng với tỷ suất 4,1/ 100 người bệnh-năm). Tỷ lệ người bệnh có xuất hiện biến cố bất lợi tụt đường huyết (0,6%) hoặc gặp các ADR liên quan đến chức năng thận như giảm eGFR (0,5%) hoặc giảm thanh thải creatinin (0,4%) ở mức thấp. Phân tích hồi quy logistic đa biến cho thấy người trên 75 tuổi có khả năng gặp ADR cao hơn người dưới 75 tuổi (OR = 5,38, 95% CI: 1,18 – 24,56, p = 0,030). Kết quả nghiên cứu từ dữ liệu đời thực trong thực hành lâm sàng này cho thấy Forxiga (dapagliflozin) được dung nạp tốt, không phát sinh vấn đề mới về an toàn đã được ghi nhận trong các nghiên cứu lâm sàng trước đây, phù hợp với thông tin hướng dẫn sử dụng thuốc đã được phê duyệt.
Tác giả liên hệ: Nguyễn Vĩnh Nam
Email: [email protected]
Ngày nhận bài: /03/2022
Ngày phản biện khoa học: /03/2022
Ngày duyệt bài: /03/2022
1. ĐẶT VẤN ĐỀ
Đái tháo đường (ĐTĐ) là bệnh không lây nhiễm phổ biến hiện nay trên Thế giới và tại Việt Nam. Theo ước tính của Tổ chức Y tế Thế giới năm 2016, cứ 20 người trưởng thành tại Việt Nam thì có một người mắc bệnh ĐTĐ.
Hiệp hội ĐTĐ Thế giới dự đoán số lượng người ĐTĐ tại Việt Nam sẽ gia tăng từ 3,5 triệu người vào năm 2015 lên 6,1 triệu vào năm 2040 (1).
Trong số các hoạt chất mới được phê duyệt chỉ định điều trị đái tháo đường típ 2, dapagliflozin là thuốc ức chế hệ đồng vận chuyển natri-glucose(SGLT) đầu tiên trong nhóm được cấp phép lưu hành. Với cơ chế hoạt động mới và không phụ thuộc vào insulin, thuốc phát huy tác dụng thông qua việc ức chế protein vận chuyển SGLT-2 ở ống lượn gần, dẫn đến tăng bài tiết glucose trong nước tiểu.
Theo kết quả từ các thử nghiệm lâm sàng (TNLS) ngẫu nhiên có đối chứng và các tổng quan hệ thống có kết hợp phân tích gộp, dapagliflozin được chứng minh giúp duy trì hiệu quả kiểm soát đường huyết lâu dài, giảm trọng lượng cơ thể và ổn định huyết áp tốt hơn so với các chất ức chế dipeptidyl peptidase-4 (DPP-4) và sulphonylureas trong phác đồ phối hợp với metformin. Bổ sung thêm các lợi ích gần đây của thuốc giúp mở rộng chỉ định trên quần thể BN ĐTĐ (ví dụ giảm nguy cơ tim mạch, tử vong), điều này có nghĩa là thuốc càng ngày càng chiếm vị trí quan trọng trong phác đồ điều trị (first line) và số bệnh nhân dự kiến được chỉ định thuốc có xu hướng gia tăng. Dữ liệu từ các TNLS lớn trong giai đoạn phát triển thuốc cũng cho thấy thuốc dung nạp tốt và nhìn chung an toàn trên người sử dụng. Theo kết quả của TNLS DECLARE-TIMI 58, tỷ lệ xuất hiện suy kiệt, khối u ác tính, gãy xương và các biến cố nhiễm trùng đường tiết niệu không khác biệt giữa nhóm dùng dapagliflozin và nhóm dùng giả dược. Tổn thương thận cấp và hạ đường huyết nghiêm trọng ít xảy ra hơn khi dùng dapagliflozin so với placebo (2). Các biến cố bất lợi (AE) có tỷ lệ mắc cao hơn ở dapagliflozin như nhiễm toan ceton và nhiễm trùng sinh dục rất hiếm và không khác biệt so với các SGLT2i khác. Tuy nhiên, các dữ liệu an toàn trên quần thể người bệnh ĐTĐ típ 2 tại Việt Nam còn hạn chế.
Trên cơ sở đó, nghiên cứu này được thực hiện với hai mục tiêu:1) khảo sát đặc điểm các phản ứng bất lợi nghi ngờ liên quan đến dapagliglozin trên người bệnh ĐTĐ típ 2 mới được chỉ định điều trị dapagliflozin; 2) phân tích một số yếu tố ảnh hưởng tới sự xuất hiện các ADR của dapagliflozin trên bệnh nhân.
2. ĐỐI TƯỢNG VÀ PHƯƠNG PHÁP NGHIÊN CỨU
2.1. Đối tượng nghiên cứu
Người bệnh ĐTĐ típ 2 mới được điều trị bằng dapagliflozin tại 08 bệnh viện (Bệnh viện (BV) Bạch Mai, BV Tim Hà Nội, BV Nội tiết Trung Ương, BV Nhân Dân 115, BV An Sinh, BV Nhân Dân Gia Định, BV Tim Thành phố Hồ Chí Minh và BV Đại học Y dược Thành phố Hồ Chí Minh) đáp ứng các tiêu chuẩn sau:
1) người bệnh trưởng thành (≥18 tuổi) được chẩn đoán ĐTĐ típ 2 tại một trong 08 bệnh viện tham gia nghiên cứu, 2) đủ điều kiện khởi trị bằng Forxiga (dapagliflozin) theo chỉ định được phê duyệt của thuốc tại Việt Nam và 3) chấp nhận ký đồng thuận tham gia nghiên cứu (bản thân hoặc người đại diện hợp pháp).
Tổng cộng có 1001 đối tượng được thu dung trong nghiên cứu này. Cỡ mẫu nghiên cứu được xác định dựa trên Hướng dẫn của Bộ Y tế trong đó quy định cỡ mẫu cho một nghiên cứu lâm sàng pha 4 để đánh giá hiệu quả và/hoặc an toàn của một thuốc tối thiểu là 1000 người.
2.2. Thiết kế nghiên cứu
Đây là nghiên cứu thuần tập một nhánh, tiến cứu và không can thiệp trên 1001 người bệnh ĐTĐ típ 2 được kê đơn dapagliflozin lần đầu. Mỗi đối tượng nghiên cứu sẽ được theo dõi trong tối đa 24 tuần, chia thành 4 lần thu thập dữ liệu. Cửa sổ thời gian theo dõi (24 tuần) được xác định dựa trên các TNLS pha 3 cung cấp bằng chứng hỗ trợ cấp phép lưu hành của Forxiga (dapagliflozin). Dapagliflozin dự kiến sẽ được sử dụng liên tục trong thời gian này. Kết thúc thời gian theo dõi, bác sỹ có thể toàn quyền quyết định tiếp tục hoặc ngưng chỉ định dapagliflozin. Vì nghiên cứu được thiết kế quan sát, việc chỉ định và ngừng chỉ định dapagliflozin hoàn toàn dựa trên chủ ý của bác sỹ điều trị và/hoặc người bệnh tại các điểm nghiên cứu mà không có tác động nào của nhà tài trợ và các tổ chức hỗ trợ nghiên cứu được nhà tài trợ ủy quyền.
Kết điểm chính trong nghiên cứu này là sự xuất hiện của các ADR, được định nghĩa là bất kỳ biến cố bất lợi xuất hiện trong quá trình theo dõi được đánh giá là chắc chắn, có thể hoặc có khả năng liên quan đến dapagliflozin theo nhận định của bác sỹ nghiên cứu.
2.3. Phân tích và xử số liệu
Đối với mục tiêu khảo đặc điểm các ADR trên người bệnh sử dụng dapagliflozin, chúng tôi sử dụng thống kê mô tả cho phân tích dữ liệu. Chỉ tiêu nghiên cứu chính bao gồm tỷ lệ gặp ADR trong thời gian theo dõi (24 tuần) và tỷ suất gặp ADR/100 người bệnh-năm. Các chỉ tiêu nghiên cứu phụ là các tỷ lệ gặp ADR phân loại theo mức độ nghiêm trọng, mức độ nặng và hệ cơ quan ảnh hưởng. Tất cả các tỷ lệ sẽ được trình bày kèm theo khoảng tin cậy 95% (95% CI).
Đối với mục tiêu phân tích các yếu tố ảnh hưởng tới sự xuất hiện của ADR, chúng tôi sử dụng mô hình hồi quy logistic tác động hỗn hợp (mixed effect logistric regression model). Chỉ tiêu nghiên cứu chính là tỷ số chênh (odd ration, OR), 95% CI của OR và p-value. Một yếu tố được xem là ảnh hưởng nếu như p- value < 0.05 (tương ứng với 95% CI của OR không chứa 1). Các biến số (yếu tố ảnh hưởng) được đưa vào mô hình dựa trên tổng quan tài liệu. Các biến tác động cố định (fixed effect) bao gồm tuổi, giới tính, BMI, tình trạng hút thuốc (sau đây gọi tắt là hút thuốc), bệnh mắc kèm và tốc độ lọc cầu thận ước tính (eGFR). Biến tác động ngẫu nhiên (random effect) là bệnh viện tham gia nghiên cứu, được chúng tôi đưa vào mô hình nhằm loại trừ ảnh hưởng của tác động cụm (clustering effect).
Chúng tôi sử dụng R phiên bản 4.1.1 cho việc phân tích dữ liệu.
2.4. Đạo đức nghiên cứu
Nghiên cứu này được thực hiện tuân thủ theo các Hướng dẫn của Bộ Y tế và Hướng dẫn quốc tế về thực hành tốt thử thuốc trên lâm sàng. Đề cương nghiên cứu đã được thông qua tại Hội đồng đạo đức các bệnh viện triển khai nghiên cứu.
Trong quá trình triển khai nghiên cứu, người tham gia nghiên cứu tiềm năng đã được giải thích về quyền lợi và trách nhiệm tham gia nghiên cứu. Người tham gia nghiên cứu tiềm năng chỉ được thu tuyển vào nghiên cứu khi đồng ý ký, hoặc người chịu trách nhiệm hợp pháp của người tham gia nghiên cứu ký vào phiếu chấp thuận tham gia nghiên cứu. Tất cả các tài liệu nguồn và tài liệu khác trong nghiên cứu được lưu trữ theo đúng yêu cầu của Bộ y tế Việt Nam về Thực hành lâm sàng tốt. Nghiên cứu được giám sát, kiểm toán và thanh tra định kỳ hoặc đột xuất theo các quy định hiện hành.
3. KẾT QUẢ NGHIÊN CỨU
3.1. Đặc điểm người bệnh tham gia nghiên cứu
Đặc điểm người bệnh tham gia nghiên cứu được trình bày trong bảng 1.
Bảng 1. Đặc điểm người bệnh tham gia nghiên cứu

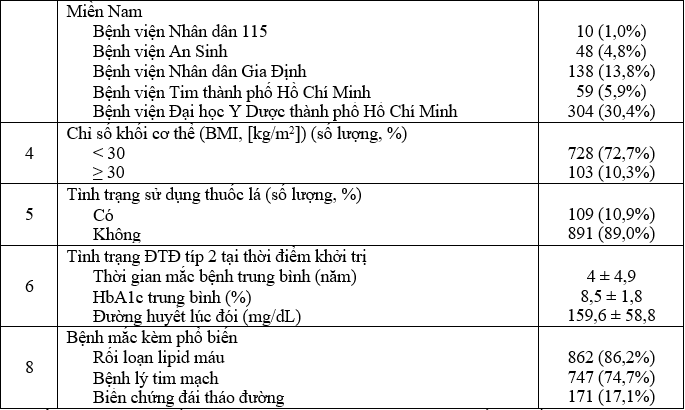
Tuổi trung bình các đối tượng nghiên cứu là 56,5 với nữ giới chiếm đa số (61,2%). Thời gian mắc bệnh ĐTĐ trung bình của các đối tượng nghiên cứu là 4 năm. Tại thời điểm khởi trị dapagliflozin, mặc dù đã được kiểm soát bằng các liệu pháp điều trị ĐTĐ trước đó, HbA1c trung bình của các đối tượng vẫn ở mức 8,5%, chưa đạt được mức HbA1c mục tiêu tại các khuyến cáo (≤7%). Về bệnh lý mắc kèm, rối loạn lipid máu (86,2%) và bệnh lý tim mạch (74,7%) xuất hiện phổ biến ở các đối tượng tham gia nghiên cứu.
3.2. Tỷ lệ và tỷ suất người bệnh gặp ADR có thể liên quan đến dapagliflozin
Tỷ lệ và tỷ suất người bệnh gặp ADR có thể liên quan đến dapagliflozin được trình bày dưới đây.
Bảng 2. Tỷ lệ người bệnh gặp ADR trong nghiên cứu
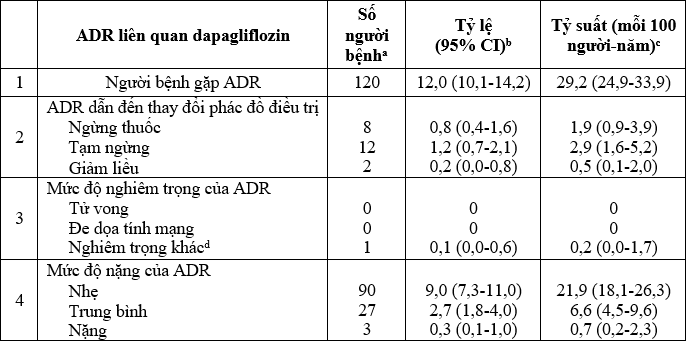
a Bệnh nhân có nhiều biến cố khác nhau ở trong cùng 1 hạng mục được tính 1 lần với mức độ cao nhất.
b [(Số bệnh nhân gặp biến cố) / (tổng số bệnh nhân)] × 100.
c [(Số bệnh nhân gặp biến cố) / (tổng số ngày theo dõi của tất cả bệnh nhân / 365,25)] × 100.
d Nghiêm trọng khác bao gồm nhập viện/kéo dài thời gian nằm viện, dị tật bẩm sinh/dị dạng thai nhi, thương tật vĩnh viễn hoặc có ý nghĩa khoa).
Trong 24 tuần theo dõi, 120 người bệnh gặp ADR liên quan đến dapagliflozin (tương ứng với tỷ lệ gặp ADR là 12,0% (95%CI [10,1-14,2]) và tỷ suất gặp ADR là 29,2/ 100 người bệnh-năm (95% CI, 24,9 – 33,9). Trong đó, 22 bệnh nhân (2,2%) gặp ADR cần thay đổi phác đồ điều trị (chủ yếu tạm ngừng dapagliflozin). Không có ADR gây tử vong hoặc đe dọa tính mạng.
3.3. Các ADR thường gặp
Chỉ có một ADR được đánh giá là nghiêm trọng (tương ứng tỷ lệ 0,1% và tỷ suất 0,2/100 người bệnh-năm). Đây là một trường hợp giảm thanh thải creatinin thận, được đánh giá có ý nghĩa về mặt y khoa, dẫn tới tạm ngừng dapagliflozin, đã hồi phục trước khi kết thúc nghiên cứu. Phần lớn bệnh nhân gặp ADR ở mức độ nhẹ (90 trong tổng số 120) và trung bình (27 trong tổng số 120).
Danh sách 10 ADR thường gặp nhất trên các đối tượng tham gia nghiên cứu được trình bày trong bảng 3. Tên ADR được lấy theo từ điển MedDRA, khóa phân loại thuật ngữ ưu tiên.
Bảng 3. 10. ADR thường gặp nhất trong nghiên cứu xếp theo tỷ lệ gặp giảm dần
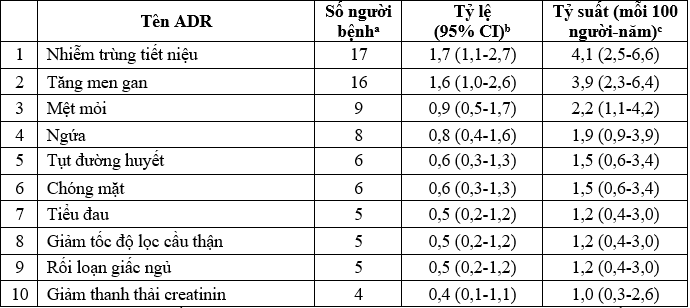
a Người bệnh gặp nhiều ADR khác nhau trong cùng một hạng mục được tính một lần ở hạng mục đó. Người bệnh gặp nhiều ADR ở các hạng mục khác nhau được tính một lần cho mỗi hạng mục. Bảng sắp xếp theo thứ tự giảm dần của số biến cố.
b [(Số bệnh nhân gặp biến cố) / (tổng số bệnh nhân)] × 100.
c [(Số bệnh nhân gặp biến cố) / (tổng số ngày theo dõi của tất cả bệnh nhân / 365,25)] × 100.
Trong các ADR có thể liên quan đến dapagliflozin, nhiễm trùng đường tiết niệu có tỷ lệ mắc cao nhất (1,7%, tương ứng với tỷ suất 4,1/ 100 người bệnh-năm), sau đó là tăng men gan ( 1,6% tương ứng với tỷ suất 3,9/ 100 người bệnh-năm) và mệt mỏi (0,9%, tương ứng với tỷ suất 2,2/ 100 người bệnh-năm). Số lượng và tỷ lệ người bệnh gặp ADR liên quan đến chức năng thận như giảm eGFR (0,5 % tương tứng tỷ suất 1,2/ 100 người bệnh-năm hoặc giảm thanh thải creatinin (0,4% tương ứng với tỷ suất 1,0/ 100 người bệnh-năm) không đáng kể. Tỷ lệ mới mắc tụt đường huyết có thể liên quan tới dapagliflozin thấp ( 0,6%, tương ứng 1,5/ 100 người bệnh-năm).
3.4. Các yếu tố ảnh hưởng tới xuất hiện ADR có thể liên quan đến dapagliflozin
Các yếu tố ảnh hướng tới sự xuất hiện của các ADR có thể liên quan đến dapagliflozin được trình bày trong hình 3.
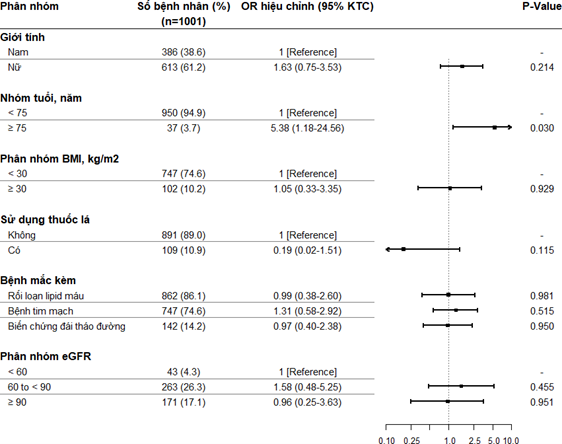
eGFR: Tốc độ lọc cầu thận ước tính (mL/phút/1.73m2)
Hình 1. Các yếu tố ảnh hưởng đến sự xuất hiện ADR có thể liên quan đến dapagliflozin Phân tích hồi quy đa biến cho thấy người cao tuổi trên 75 tuổi (OR = 5,38, 95% CI: 1,18 – 24,56, p = 0,030); có khả năng gặp ADR liên quan đến dapagliflozin cao hơn người dưới 75 tuổi.
4. BÀN LUẬN
Nghiên cứu này báo cáo về tính an toàn của Forxiga (dapagliflozin) khi sử dụng thực tế trên người bệnh ĐTĐ típ 2 tại Việt Nam.
Kết quả nghiên cứu cho thấy dapagliflozin dung nạp tốt khi khởi trị trên người bệnh ĐTĐ típ 2 và không phát sinh các vấn đề mới về an toàn trong thời gian theo dõi 24 tuần. Các phát hiện về tính an toàn trong nghiên cứu này nhất quán khi so sánh với kết quả của các nghiên cứu công bố trước đây, cũng như so với thông tin trên tờ hướng dẫn sử dụng của Forxiga đã được phê duyệt tại Việt Nam.
Trong nghiên cứu này, 12% bệnh nhân đã ghi nhận gặp ít nhất một ADR trong thời gian theo dõi kéo dài 24 tuần. Mặc dù vậy, cần nhấn mạnh rằng đa số các ADR này xảy ra ở mức độ nhẹ hoặc trung bình, và sự xuất hiện của các ADR nghiêm trọng là rất hiếm gặp.
Trong thời gian theo dõi, chỉ 4,8 % trong số người bệnh điều trị bằng dapagliflozin được chỉ định ngừng hoặc tạm ngừng điều trị do ADR. Tỷ lệ này tương tự so với nghiên cứu của Jabbour (4,3%) trong phân tích tổng hợp dữ liệu từ 13 TNLS (3).
Các ADR đều hồi phục sau quá trình điều trị và không để lại các di chứng. Như vậy, kết quả nghiên cứu của chúng tôi chỉ ra rằng dapagliflozin dung nạp tốt trên người khởi trị và không gợi ý các nguy cơ mới về an toàn. Điều này tương tự với kết luận của các nghiên cứu từ dữ liệu đời thực khác, như nghiên cứu của Alguwaihes tại Ả rập hay của Viswanathan tại Ấn Độ (2, 4).
Trong số các ADR, nhiễm trùng tiết niệu là ADR có tỷ lệ mắc cao nhất. Tỷ lệ mắc nhiễm trùng tiết niệu trong nghiên cứu này (1,7%) tương tự với tỷ lệ khảo sát được trong TNLS (nghiên cứu đa trung tâm DECLARE-TIMI 58 [1,5%]) cũng như trong nghiên cứu đời thực (nghiên cứu của Alguwaihes tại Ả rập [1%]) (5, 6). Tương tự với các nghiên cứu trên, các trường hợp nhiễm trùng tiết niệu trong nghiên cứu này đều xuất hiện ở mức độ nhẹ và trung bình, phục hồi nhanh chóng và không dẫn tới chỉ định phải dừng dapagliflozin vĩnh viễn.
Mặc dù vậy, các nghiên cứu trước đây cũng cho thấy nhiễm trùng tiết niệu có thể tái phát, gây ảnh hưởng tới chất lượng cuộc sống và tuân thủ điều trị của người bệnh. Bên cạnh đó, thời gian quan sát trong nghiên cứu này (24 tuần, so với 4,2 năm trong nghiên cứu DECLARE-TIMI 58) có thể tương đối ngắn để đánh giá tần suất và tác động của nhiễm trùng tiết niệu đối với cuộc sống của các đối tượng nghiên cứu.
Phân tích các yếu tố ảnh hưởng của chúng tôi cho thấy người bệnh trên 75 tuổi có xác suất xuất hiện/hoặc phát hiện ADR cao hơn so với người bệnh dưới 75 tuổi, tương tự với phát hiện của Fioretto khi nghiên cứu tổng hợp dữ liệu từ khoảng 30 TNLS (7). Mặc dù không phát hiện thấy tăng nguy cơ xuất hiện các ADR nghiêm trọng trong nhóm đối tượng này, đây cũng là thông tin cần lưu ý đối với bác sỹ điều trị trong quá trình sử dụng thuốc sau này.
Theo hiểu biết của chúng tôi, đây là nghiên cứu đời thực với cỡ mẫu lớn nhất được thực hiện tại Việt Nam để giám sát hậu mãi một biệt dược đã được cấp phép lưu hành. Tuy nhiên, nghiên cứu này cũng có hạn chế so với các nghiên cứu TNLS là chưa phát hiện được một số ADR hiếm gặp nhưng quan trọng của dapagliflozin như nhiễm toan ceton. Trong phân tích của Cahn và cộng sư từ dữ liệu của nghiên cứu DECLARE-TIMI 58 trên 17143 người ĐTĐ típ 2, mặc dù hiếm gặp, tần suất xuất hiện của nhiễm toan ceton cao hơn ở nhóm dapagliflozin so với nhóm placebo (0,77% so với 0,36%, p = 0.030) (8).
Việc không phát hiện được các biến cố hiếm gặp như nhiễm toan ceton trong nghiên cứu này có thể giải thích do cỡ mẫu hạn chế (1001 so với 17143 của nghiên cứu DECLARE-TIMI 58), do thời gian quan sát ngắn (24 tuần so với 4,2 năm của của nghiên cứu DECLARE-TIMI 58) hoặc do đặc điểm của thiết kế nghiên cứu (tương tự như nghiên cứu quan sát của Alguwaihes cũng không phát hiện được những ADR như vậy).
Nghiên cứu này thu thập dữ liệu đi theo tiến trình điều trị thường quy của cơ sở nghiên cứu. Do đó, nghiên cứu sẽ gặp khó khăn khi phát hiện các ADR hiếm hoặc hoặc trọng điểm vì để phát hiện các ADR này thường đòi hỏi quá trình thu thập dữ liệu phải được thiết kế riêng, ví dụ sử dụng biểu mẫu báo cáo riêng và/hoặc thực hiện xét nghiệm bổ sung hoặc thăm khám có chủ đích. Bên cạnh đó, nghiên cứu này chỉ thực hiện trên người bệnh sử dụng Forxiga, không bao gồm các biệt dược khác của dapagliflozin.
Do đó, kết quả nghiên cứu có thể gặp hạn chế khi ngoại suy về tính an toàn của các thuốc generic khác của dapagliflozin, cũng như các SGLT2i khác.
5. KẾT LUẬN
Kết quả nghiên cứu của chúng tôi trên 1001 người bệnh ĐTĐ típ 2 khởi trị bằng Forxiga (dapagliflozin) trong 24 tuần theo dõi cho thấy thuốc dung nạp tốt và không gây lo ngại về các tín hiệu an toàn mới. Thông tin an toàn của thuốc nhất quán với các phát hiện từ các TNLS và nghiên cứu dữ liệu đời thực trước đó, cũng như tờ hướng dẫn sử dụng của Forxiga đã được phê duyệt tại Việt Nam.
Lời cảm ơn: Để hoàn thành nghiên cứu này, nhóm nghiên cứu xin trân trọng cảm ơn các nghiên cứu viên và các bệnh viện đã tham gia nghiên cứu DAPA PMS: TS.BS.Trần Quang Nam (BV Đại học Y dược Tp.Hồ Chí Minh), PGS.TS.BS. Đỗ Quang Huân (Viện Tim Tp.Hồ Chí Minh), BS.CK2. Chu Thị Thanh Phương (BV Nhân dân 115), PGS.TS.BS. Đỗ Trung Quân (BV Bạch Mai), GS.BS. Nguyễn Quang Tuấn (BV Tim Hà Nội), TS.BS.Lê Quang Toàn (BV Nội tiết Trung Ương), BS.CK2.Nguyễn Thanh Phong (BV An Sinh), BS.CK2. Trần Đỗ Lan Phương (BV Nhân dân Gia Định).
Nhà tài trợ nghiên cứu: AstraZeneca
Khai báo mâu thuẫn lợi ích: Phương Lễ Trí và Nguyễn Công Lương: hiện đang là nhân viên AstraZeneca Việt Nam
TÀI LIỆU THAM KHẢO
- The World Health Organization. The growing burden of diabetes in Viet Nam. 2016 [17 January 2022]. Available from: https://who.int/vietnam/news/featur e-stories/detail/the-growing-burden-of- diabetes-in-viet-nam.
- Wiviott SD, Raz I, Bonaca MP, Mosenzon O, Kato ET, Cahn A, et Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. The New England journal of medicine. 2019;380(4):347-57.
- Jabbour S, Seufert J, Scheen A, Bailey CJ, Karup C, Langkilde Dapagliflozin in patients with type 2 diabetes mellitus: A pooled analysis of safety data from phase IIb/III clinical trials. Diabetes, obesity & metabolism. 2018;20(3):620-8.
- Viswanathan V, Singh KP. Use of Dapagliflozin in the Management of Type 2 Diabetes Mellitus: A Real-World Evidence Study in Indian Patients (FOREFRONT). Diabetes technology & therapeutics. 2019;21(8):415-22.
- Akinci B. Dapagliflozin and Cardiovascular Outcomes in Type 2 Diabetes. The New England journal of medicine. 2019;380(19):1881.
- Alguwaihes AM. Safety of Dapagliflozin in Patients with Type 2 Diabetes Mellitus in Saudi Arabia: A Post Authorization Safety Study. Diabetes therapy : research, treatment and education of diabetes and related disorders. 2021;12(7):1979-92.
- Fioretto P, Mansfield TA, Ptaszynska A, Yavin Y, Johnsson E, Parikh S. Long- Term Safety of Dapagliflozin in Older Patients with Type 2 Diabetes Mellitus: A Pooled Analysis of Phase IIb/III Studies. Drugs & aging. 2016;33(7):511-22.
- Cahn A, Raz I, Bonaca M, Mosenzon O, Murphy SA, Yanuv I, et al. Safety of dapagliflozin in a broad population of patients with type 2 diabetes: Analyses from the DECLARE-TIMI 58 study. Diabetes, obesity & metabolism. 2020;22(8):1357-68.
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam




