NGHIÊN CỨU LÂM SÀNG NGẪU NHIÊN, ĐỐI CHỨNG, SO SÁNH VIỆC ĐỊNH LIỀU BIASP 30 THEO BỆNH NHÂN VÀ ĐỊNH LIỀU BIASP 30
THEO NGHIÊN CỨU VIÊN Ở BỆNH NHÂN ĐÁI THÁO ĐƯỜNG TÝP 2
CHƯA KIỂM SOÁT TỐT VỚI INSULIN NPH
Abdelmjid Chraibi. Shoorook Al-Herz. Bich Dao Nguyen, Djoko W. Soeatmadji. Anil Shinde. Balasubramanian Lakshmivenkataraman. Samir H. Assaad-Khalil.
ABSTRACT
An RCT Investigating Patient-Driven Versus Physician-Driven Titration of BIAsp 30 in Patients with Type 2 Diabetes Uncontrolled Using NPH Insulin
Introduction: The aim of this study was toconfirm the efficacy of patient-driven titration of BIAsp 30 in terms of glycemic control, bycomparing it to physician-driven titration of BIAsp 30, in patients with type 2 diabetes in North Africa, the Middle East, and Asia. Methods: A 20-week, open-label, randomized, two-armed, parallel-group, multicenter study in Egypt, Indonesia, Morocco, Saudi Arabia, and Vietnam. Patients (n=155) with type 2 diabetes inadequately controlled using neutral protamine Hagedorn (NPH) insulin were randomizedto either patient-driven or physician-drivenBIAsp 30 titration. Results: The noninferiority of patient-drivencompared to physician-driven titration with respect to the reduction in HbA1c was confirmed.The estimated mean change in HbA1c from baseline to week 20 was -1.27% in thepatient-driven arm and -1.04% in the physician-driven arm, with an estimated treatment difference of -0.23% (95% confidence interval: -0.54; 0.08). After 20 weeks of treatment, theproportions of patients achieving the target of HbA1c <7.5% were similar between titrationarms; the proportions of patients achieving the target of B6.5% were also similar. Both titration algorithms were well tolerated, and hypoglycemic episode rates were similar in botharms. Conclusions: Patient – driven titration of BIAsp 30can be as effective and safe as physician – driventitration in non-Western populations. Overall,the switch from NPH insulin to BIAsp 30 waswell tolerated in both titration arms and led toimproved glycemic control. A limitation of thestudy was the relatively small number of patients recruited in each country.
Chịu trách nhiệm chính: Abdelmjid Chraibi
Ngày nhận bài: 25/7/2017
Ngày phản biện khoa học: 29/7/2017
Ngày duyệt bài: 3/8/2017
TÓM TẮT
Đặt vấn đề: Mục tiêu của nghiên cứu này là nhằm xác định hiệu quả của việc bệnh nhân tự điều chỉnh liều BIAsp 30 so với việc bác sĩ điều chỉnh liều xét trên vấn đề kiểm soát glucose máu trên các bệnh nhân đái tháo đường týp 2 ở Bắc Phi, Trung Đông, và Châu Á. Phương pháp: Nghiên cứu 20 tuần, ngẫu nhiên, nhãn mở, hai nhóm song song, đa trung tâm được tiến hành tại Ai Cập, Indonesia, Ma-rốc, Ả-rập Xê-út và Việt Nam. Bệnh nhân (n = 155) đái tháo đường týp 2 không kiểm soát được đầy đủ đường huyết với insulin NPH được phân ngẫu nhiên vào một trong hai nhóm: nhóm do bệnh nhân tự điều chỉnh liều và nhóm do bác sĩ điều chỉnh liều BIAsp 30. Kết quả: Sự không kém hơn về việc bệnh nhân tự điều chỉnh liều so với bác sĩ điều chỉnh liều xét về mặt giảm HbA1C đã được khẳng định. Thay đổi trung bình HbA1c ước tính từ thời điểm trước nghiên cứu đến tuần 20 là -1,27% ở nhóm bệnh nhân tự điều chỉnh liều và -1,04% ở nhóm bác sĩ tự điều chỉnh liều, với sự khác biệt điều trị ước tính là -0,23% (95% CI là: -0,54; 0,08). Sau 20 tuần điều trị, tỉ lệ bệnh nhân đạt được mục tiêu HbA1c <7,5% tương tự nhau giữa các nhóm; Tỷ lệ bệnh nhân đạt được mục tiêu ≤ 6,5% cũng tương tự. Cả hai cách điều chỉnh liều đều được dung nạp tốt và tỷ lệ hạ đường huyết tương tự nhau ở cả hai nhóm điều trị. Kết luận: Việc bệnh nhân tự điều chỉnh liều BIAsp 30 có hiệu quả tương tự với bác sĩ điều điều chỉnh liều tại các quần thể nghiên cứu không thuộc Tây Âu. Nhìn chung, việc chuyển sử dụng từ NPH insulin sang BIAsp 30 được dung nạp tốt trong cả hai nhóm nghiên cứu và đều dẫn đến việc cải thiện kiểm soát glucose máu tốt hơn. Hạn chế của nghiên cứu này là cỡ mẫu bệnh nhân tại mỗi quốc gia tham gia nghiên cứu là tương đối nhỏ.
Các tác giả
A.Chraibi .Medical School of Agadir, Agadir, Morocco e-mail: [email protected]
A.Chraibi Ibn Zohr University, Agadir, Morocco
S. Al-Herz King Fahad National Guard Hospital, Riyadh, Saudi Arabia
B.D.Nguyen,Tam Duc Heart Hospital, Ho Chi Minh city, Vietnam
D. W. Soeatmadji ,Saiful Anwar General Hospital Malang, Malang, Indonesia
A.Shinde .Novo Nordisk, Dubai Healthcare City, Dubai, UAE
B, Lakshmivenkataraman. Novo Nordisk, EPIP Phase I, Whitefield, Bangalore, India
S.H.Assaad-Khalil .Alexandria Faculty of Medicine, Alexandria, Egypt
Số đăng ký thử nghiệm lâm sàng: Clinical Trials.gov NCT01589653.
Nguồn ngân sách: Novo Nordisk A/S, Denmark.
Từ khóa: Biphasic insulin aspart 30; HbA1c; NPH insulin; Titration
I. GIỚI THIỆU
Tỷ lệ mắc đái tháo đường týp 2 đang gia tăng trên toàn thế giới, nhưng tăng đáng kể và đặc biệt cần chú ý là ở các nước không thuộc Tây Âu do các nước này đang trải qua sự tăng trưởng nhanh chóng về kinh tế xã hội và đô thị hoá cùng với những thay đổi liên quan đến chế độ ăn uống và tuổi thọ. Khoảng 8,8% người trưởng thành trên toàn thế giới được ước tính hiện mắc đái tháo đường, trong đó đái tháo đường týp 2 chiếm 95% gánh nặng bệnh tật. Tỷ lệ đái tháo đường hiện nay cao nhất ở Ả-rập Xê-út (17,6%), Ai Cập (16,7%), Bahrain (15,6%), UAE (14,6%) và Kuwait (14,3%) [1]. Đến năm 2040, tỷ lệ mắc đái tháo đường được dự báo sẽ tăng lên tới mức làm ảnh hưởng đến 10% dân số toàn cầu, gây áp lực ngày càng tăng lên các nguồn lực y tế và gây ra gánh nặng kinh tế lớn [1].
Mục đích của việc quản lý đái tháo đường týp 2 là giảm thiểu các biến chứng lâu dài, bao gồm các bệnh mạch máu nhỏ và mạch máu lớn, đồng thời tránh được những tác dụng không mong muốn trong điều trị như hạ đường huyết và tăng cân. Các hướng dẫn hiện tại, được hỗ trợ bởi dữ liệu từ Nghiên cứu Đái tháo đường Vương Quốc Anh (UKPDS), khuyến cáo nên kiểm soát glucose máu (BG) để giảm HbA1c xuống dưới 7% ở hầu hết các bệnh nhân [2-4].
Đái tháo đường týp 2 là một bệnh tiến triển đòi hỏi phải tăng cường liên tục và tối ưu hóa điều trị để đạt được và duy trì các mục tiêu HbA1c. Các chiến lược tăng cường phụ thuộc vào đặc điểm, nhu cầu và phù hợp của bệnh nhân, nhưng hầu hết các bệnh nhân cuối cùng sẽ cần được điều trị bằng insulin do mất chức năng tế bào beta [2, 5, 6]. Insulin nền, như là insulin tác dụng kéo dài hoặc insulin tác dụng trung bình (NPH), thường được sử dụng như là liệu pháp khởi trị insulin. Khi insulin nền không kiểm soát glucose máu đầy đủ, có thể xem xét thêm insulin tác dụng nhanh liên quan bữa ăn(liệu pháp insulin nền- insulin bữa ăn nhanh theo bữa ăn), với số mũi tiêm tăng dần. Phác đồ insulin trộn sẵn (hỗn hợp/2pha), cung cấp cả các thành phần insulin tác dụng nhanh và tác dụng trung bình/kéo dài trong một công thức, cũng có thể được sử dụng để khởi trị hoặc điều trị tăng cường insulin [3, 7] và được sử dụng rộng rãi như là liệu pháp khởi trị insulin ở Châu Phi, Trung Đông, và khu vực Đông Nam Á [1, 8-10].
Insulin Biphasic aspart 30 (BIAsp 30: NovoMix 30) là một insulin hỗn hợp/ trộn sẵn của insulin aspart (IAsp), trong đó 30% IAsp tác dụng nhanh có thể hòa tan được và 70% còn lại là IAsp protamine kết tinh tác dụng trung bình/tác dụng nhanh [11]. BIAsp 30 bao gồm cả insulin bữa ănvà insulin nền do vậy có thể cải thiện kiểm soát glucose máu ở những bệnh nhân đái tháo đường týp 2 không được kiểm soát trước đó với insulin nền [12].
Mặc dù có hướng dẫn chi tiết về việc sử dụng liệu pháp insulin, đối với nhiều bệnh nhân, việc đạt được và duy trì các mục tiêu HbA1c trong chăm sóc lâm sàng thường qui một thách thức lớn [13]. Dữ liệu địa phương cho thấy rằng chỉ có 16,4% bệnh nhân đái tháo đường týp 2 ở Ai Cập, 26,8% bệnh nhân ở Ma-rốc, 27,0% bệnh nhân ở Ả-rập Xê-út và 32,2% bệnh nhân ở Indonesia đạt được mục tiêu HbA1c <7% [8, 10, 14, 15]. Có rất nhiều rào cản thuộc về bệnh nhân và bác sĩ đối với việc khởi trị và điều trị tăng cường insulin, bao gồm thiếu kiến thức và nhận thức, và mối quan tâm về hạ đường huyết và tăng cân [16]. Các rào cản địa phương và văn hoá cũng đang tồn tại ở các nước đang phát triển. Ở Trung Đông, Châu Phi và đặc biệt ở Đông Nam Á, thường có khoảng cách giữa hướng dẫn điều trị với thực tế điều trị đái tháo đườngvà việc tiếp cận chăm sóc sức khoẻ có thể bị hạn chế do bảo hiểm y tế thấp, tỉ lệ dân số và bác sĩ thấp, nông thôn và các cộng đồng dân cư khu vực khó tiếp cận, và chi phí dịch vụ y tế [17-19].
Việc điều chỉnh liều insulin theo thời gian là cần thiết để đạt được và duy trì các mục tiêu glucose máu. Hiện nay, nhiều bệnh nhân đái tháo đường týp 2 được bác sĩ điều điều chỉnh liều tại các cơ sở chăm sóc sức khỏe ban đầu [20]. Điều chỉnh liều là một quá trình tốn nhiều thời gian, và thêm các rào cản bao gồm nhu cầu phải thường xuyên đến các phòng khám, chi phí xét nghiệm glucose máu và thiếu kiến thức và kinh nghiệm của các nhân viên y tế trong việc chuẩn độ liều.
Tự theo dõi glucose máu và tự điều chỉnh liều insulin dựa trên thuật toán đã được xác định trước (với sự giám sát lâm sàng) được thiết lập tốt ở bệnh đái tháo đường týp 1, và việc tự quản lý điều trị tương tự ở các chế độ insulin khác nhau đã được chứng minh là khả thi ở bệnh nhân đái tháo đường týp 2 [6, 21-23]. Một phác đồ điều trị dễ dàng cho việc huấn luyện và tự điều chỉnh có thể cho phép nhiều bệnh nhân khởi đầu và tối ưu hóa liệu pháp insulin, do đó giảm các lần khám tại phòng khám tiếp theo cũng như việc gọi điện thoại. Các insulin analogs trộn sẵn (hỗn hợp/2 pha) như BIAsp 30 đơn giản và thuận tiện để sử dụng, đòi hỏi ít mũi tiêm hơn so với liệu pháp insulin nền – insulin nhanh theo bữa ăn, và đặc tính về thời gian – tác dụng có khả năng dự đoán được, làm cho bệnh nhân điều chỉnh liều hàng ngày của họ một cách hiệu quả [24, 25].
Mục tiêu của nghiên cứu này là nhằm xác định hiệu quả của việc định liều BIAsp30 xét trên việc kiểm soát glucose máu giữa phương pháp bệnh nhân tự điều chỉnh liều so sánh với phương pháp do bác sĩ điều chỉnh liều trên các bệnh nhân đái tháo đường týp 2 không kiểm soát glucose máu đủ với insulin NPH ở Bắc Phi, Châu Á và Trung Đông. Nghiên cứu này sử dụng cách tiếp cận không kém hơn.
II. PHƯƠNG PHÁP
Đối tượng nghiên cứu
Bệnh nhân được tuyển chọn tại 18 địa điểm nghiên cứu tại Ai Cập, Indonesia, Marốc, Ảrập Xêút và Việt Nam từ tháng 5 năm 2012 đến tháng 7 năm 2015. Các bệnh nhân đủ điều kiện ≥18 tuổi, đã được chẩn đoán bệnh đái tháo đường týp 2 trong ít nhất 12 tháng trước khi sàng lọc, được điều trị với insulin NPH (ít nhất 3 tháng) kết hợp với liều hàng ngày ổn định tối thiểu 1500mg hoặc liều dung nạp tối đa (ít nhất 1000mg) metformin trong ít nhất 2 tháng (ngoại trừ Indonesia, liều hàng ngày được khuyến cáo là 750 mg) có hoặc không có kết hợp thuốc điều trị đái tháo đường dạng uống (OAD), có HbA1c ≥7,0% (≥ 53,0 mmol/mol) và ≤10% (≤85.8 mmol/mol) và có chỉ số khối cơ thể (BMI) ≤ 40,0 kg/m2. Các tiêu chí loại trừ chính bao gồm điều trị bằng bất kỳ thiazolidinedione, đồng vận thụ thể GLP-1, và/hoặc pramlintide trong vòng 3 tháng trước khi sàng lọc; điều trị với hơn 1 IU/kg insulin NPH /ngày; trước đó có sử dụng insulin trộn sẵn (hỗn hợp/2 pha) hoặc insulin tác dụng nhanh; nhiều hơn một cơn hạ đường huyết nghiêm trọng trong 12 tháng trước; suy thận hoặc suy gan; hoặc bệnh võng mạc tăng sinh hoặc bệnh lýhoàng điểm cần điều trị
Thiết kế nghiên cứu
Đây là một thử nghiệm nhãn mở, ngẫu nhiên, hai nhóm song song, đa trung tâm bao gồm thời gian sàng lọc kéo dài 2 tuần, giai đoạn tập huấn kéo dài 4 tuần và thời gian duy trì là 16 tuần. Bệnh nhân được phân ngẫu nhiên theo tỷ lệ 1: 1 để được điều trị bằng BIAsp 30 hai lần mỗi ngày (BID) do bệnh nhân tự điều chỉnh liều hoặc do bác sĩ điều chỉnh liều. Tất cả các bệnh nhân ngưng insulin và OAD trước đây của họ, trừ việc dùng metformin trước nghiên cứu. Liều và phác đồ dùng metformin không thay đổi trong suốt thời gian nghiên cứu. Bệnh nhân có liều khởi đầu BIAsp 30 tương đương liều insulin NPH trước đây của họ chia thành hai liều bằng nhau, tiêm dưới da bằng bút tiêm FlexPen (Novo Nordisk, Bagsvaerd, Đan Mạch) ngay trước bữa ăn sáng và ngay trước bữa ăn tối (chiều). Việc điều điều chỉnh liều BIAsp 30 ở cả hai nhóm được thực hiện theo phương pháp điều chỉnh theo khuyến cáo của BIAsp 30 được ghi trong tài liệu tóm tắt đặc tính sản phẩm [26] và dựa trên các giá trị glucose huyết tương tự đo được (SMPG) hai lần mỗi ngày trong ba ngày trước đó (Bảng 1). Bệnh nhân được cung cấp máy đo glucose máu và các que thử glucose máu được hiệu chuẩn theo huyết thanh để ghi lại SMPG. Tất cả các phép đo được thực hiện với máu mao mạch được tự động hiệu chuẩn với các giá trị glucose huyết tương tương ứng (PG). Điều chỉnh liều BIAsp 30 được thực hiện mỗi tuần một lần trong giai đoạn tập huấn và mỗi tuần thứ hai trong giai đoạn duy trì. Những bệnh nhân tham gia vào nhóm do bệnh nhân tự điều chỉnh liều có ba lần khám bệnh sau khi chia ngẫu nhiên (tuần 4, 12 và 20) và liên hệ qua điện thoại khi cần thiết. Những bệnh nhân tham gia trong nhóm bác sĩ điều chỉnh liều có 6 lần khám bệnh (tuần 2, 4, 8, 12, 16 và 20) và liên lạc qua điện thoại 1 tuần sau lần khám trước đó nếu một trong các liều này đã được thay đổi và vào bất kỳ thời điểm nào nếu thấy cần thiết.
Bảng 1: Quy định hiệu chỉnh liều BIAsp 30 cho cả hai nhóm nghiên cứu
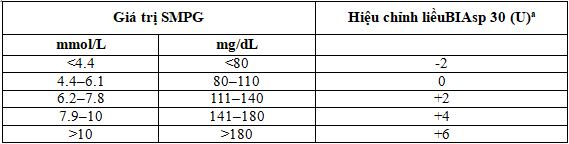
Điều chỉnh liều BIAsp được dựa trên SMPG thấp nhất đo trước bữa ăn sáng và trước bữa ăn tối(chiều) trong 3 ngày trước. Giá trị SMPG thấp nhất trước bữa ăn sáng được sử dụng để điều chỉnh liều bữa tối sau và giá trị SMPG thấp nhất trước bữa ăn tối đã được sử dụng để điều chỉnh liều bữa sáng hôm sau SMPG glucose máu tự đo, đơn vị đo: U
aKhông tăng liều nếu có hạ đường huyết [≤3.9 mmol/L (70 mg/dL)] xảy ra trong 3 ngày trước đó
Các quy định về điều chỉnh liều, hiệu quả, đánh giá an toàn, và các phương pháp phân tích thống kê được sử dụng trong nghiên cứu này cũng giống như những mô tả trong một nghiên cứu khác đã được công bố trước đây [27]. Tất cả các thủ tục nghiên cứu được thực hiện thủ tuân theo các tiêu chuẩn đạo đức của Hội Đồng Đạo Đức (cấp bệnh viện và quốc gia), phù hợp với Tuyên bố Helsinki năm 1964 và bản sửa đổi vào năm 2013. Chấp thuận tham gia nghiên cứu được thông báo đến bệnh nhân và được sự đồng ý của tất cả các bệnh nhân trước khi thực hiện nghiên cứu. Đề cương nghiên cứu đã được Bộ Y tế Ai Cập thông qua, cũng như Ủy ban Đạo đức của Khoa Y tại Đại học Alexandria, Ai Cập. Số nhận dạng của thử nghiệm lâm sàng trên ClinicalTrials.gov là NCT01589653.
Các đánh giá an toàn và hiệu quả
Kết cục chính đánh giá sự thay đổi HbA1c từ thời điểm trước nghiên cứu đến tuần 20. Các kết cục phụ hỗ trợ gồm có: tỷ lệ bệnh nhân đạt được mục tiêu của Hiệp hội Đái tháo đường Hoa Kỳ về mục tiêu HbA1c <7,0% và mục tiêu HbA1c là ≤6,5% sau 20 tuần điều trị có và không có các cơn hạ đường huyết nặng và nhẹ trong 12 tuần cuối của thử nghiệm; thay đổi nồng độ glucose huyết tương lúc đói (FPG) so với trước nghiên cứu; dung mao SMPG tại 7 thời điểm (các giá trị glucose máu PG được đo trước và 90 phút sau khi bắt đầu ăn sáng, ăn trưa và bữa tối (chiều) , và trước khi đi ngủ); thời gian đến khi đạt PG mục tiêu sử dụng SMPG đo tại 2 điểm, thời điểm trước bữa ăn sáng và trước bữa ăn tối (chiều) và cả hai đều trong khoảng giới hạn 4.4-6.1 mmol/L (80-110 mg/dL)]; sự hài lòng của bệnh nhân được đánh giá bằng bộ câu hỏi đánh giá tác động liên quan đến điều trị đái tháo đường (TRIM-D) [28]; và đánh giá việc sử dụng nguồn lực nhân viên y tế (thăm phòng khám, gọi điện thoại đến phòng khám, và sử dụng que thử glucose máu).
An toàn và khả năng dung nạp được đánh giá xét trên các cơn hạ đường huyết và các biến cố bất lợi (AEs) trong quá trình điều trị. Một cơn hạ đường huyết được xác định là xuất hiện trong quá trình điều trị nếu khởi phát xảy ra sau lần dùng BIAsp 30 đầu tiên và không muộn hơn ngày cuối cùng của thử nghiệm. AE được xác định là xuất hiện khi điều trị nếu xảy ra lúc khởi phát hoặc sau ngày đầu tiên dùng BIAsp 30 và không chậm hơn 7 ngày sau ngày cuối.
Các cơn hạ đường huyết nhẹ được xác địnhlà một cơn có các triệu chứng phù hợp với tình trạng hạ đường huyết [được chứng minh bởi PG <3,1 mmol/L (<56 mg/dL) hoặc tất cả các giá trị BG <2,8 mmol/L (<50 mg/dL)] bởi chính bệnh nhân, hoặc bất kỳ giá trị PG nào không có triệu chứng <3,1 mmol/L (56 mg/dL) hoặc toàn bộ giá trị BG <2,8 mmol/L (<50 mg/dL). Hạ đường huyết nghiêm trọng được xác định là một cơn hạ đường huyết đòi hỏi sự trợ giúp của người khác để dùng carbohydrate, glucagon hoặc các hoạt động hồi sức khác. Cơn hạ đường huyết có triệu chứng được xác định là một cơn, trong đó các triệu chứng điển hình của hạ đường huyết đi kèm với nồng độ PG là≤3.9 mmol/L (≤70 mg/dL). Cơn hạ đường huyết không triệu chứng được xác định là một cơn không kèm theo các triệu chứng điển hình về hạ đường huyết, nhưng với nồng độ PG ≤3.9 mmol/L (≤70 mg/dL). Cơn hạ đường huyết có thể có triệu chứng được xác định như là một cơn, trong đó có các triệu chứng của hạ đường huyết không kèm theo hạ PG (nhưng các triệu chứng có lẽ là do nồng độ PG ≤3.9 mmol/L (≤70 mg/dL)]. Hạ đường huyết tương đối được xác định là một cơn hạ đường huyết trong đó người bệnh báo cáo bất kỳ triệu chứng điển hình nào về hạ đường huyết và giải thích những triệu chứng này là dấu hiệu của hạ đường huyết, nhưng với nồng độ PG ước tính là >3,9 mmol/L [70 mg/dL] [29]. Cơn hạ đường huyết trong khoảng thời gian bắt đầu từ 00:00 đến 05:59 (bao gồm cả hai) được xác định là một cơn hạ đường huyết về đêm.
Phân tích thống kê
Các bộ phân tích trong nghiên cứu được định nghĩa theo hướng dẫn ICH-E9[30]. Bộ phân tích đầy đủ (FAS) bao gồm tất cả các bệnh nhân được phân ngẫu nhiên, và các phân tích thống kê trên bộ phân tích FAS được dựa trên nguyên tắc dự định điều trị (ITT). Các bệnh nhân trong bộ phân tích này là các bệnh nhân “phân ngẫu nhiên’’. Các giá trị bị khuyết được ước tính theo phương pháp giá trị cuối chuyển ra sau (LOCF). Bộ phân tích theo đề cương nghiên cứu (PP) bao gồm các bệnh nhân trong nhóm bệnh nhân tự điều chỉnh liều hoặc nhóm bác sĩ điều chỉnh liều trong thời gian nhiều hơn 12 tuần, có lần khám đánh giá thu thập được kết điểm chính của nghiên cứu và không có các sai lệch đề cương lớn làm hảnh hưởng đến kết cục chính. Bộ phân tích an toàn (SAS) bao gồm các bệnh nhân được dùng ít nhất một liều BIAsp 30. Bệnh nhân trong bộ phân tích PP và bộ phân tích SAS được xem là các bệnh nhân “được điều trị’’. Cỡ mẫu nghiên cứu được tính toán dựa trên kiểm định t, kiểm định một bên với mức ý nghĩa 2,5% để kiểm định giả thuyết không có sự khác biệt giá trị trung bình HbA1c giữa các nhóm điều trị (kết cục chính). Cỡ mẫu tối thiểu cần có dựa trên kết cục chính, với công suất thống kê ít nhất 80%, trên bộ phân tích PP là 162 bệnh nhân với giả định độ lệch chuẩn (SD) là 0.9%. Ước tính số bệnh nhân bị loại khỏi bộ phân tích là 10%, số lượng bệnh nhân cần phân ngẫu nhiên là 180 bệnh nhân. Mặc dù thời gian tuyển bệnh đã được kéo dài, nghiên cứu đã phải kết thúc trước khi tuyển đủ bệnh nhân vìkhông có tìm được bệnh nhân đủ điều kiện tham gia nghiên cứu. Kết cục chính của nghiên cứu là thay đổi HbA1c tính từ thời điểm trước nghiên cứu đến tuần 20, phân tích sử dụng mô hình hồi quy tuyến tính với nhóm điều trị, phân tầng điều trị (metformin đơn trị so với metformin + các OAD), và quốc gia là các yếu tố phân tích, giá trị HbA1c tại thời điểm trước nghiên cứu là đồng biến trong mô hình phân tích. Phương pháp bệnh nhân tự điều chỉnh liều được xác định là không kém hơn bác sĩ điều chỉnh liều nếu giá trị trên của khoảng tin cậy 95% (CI) của sự khác biệt thay đổi HbA1C giữa hai nhóm nghiên cứu sau 20 tuần điều trị so sánh với thời điểm trước nghiên cứu giữa hai nhóm ≤0.4%.
Các phân tích độ nhạy được thực hiện với tất cả các dữ liệu HbA1c đo được sau khi phân ngẫu nhiên bệnh nhân tại các thời điểm đánh giá sử dụng mô hình ảnh hưởng hỗn hợp đo lường lặp lại (MMRM). Trong mô hình này, các yếu tố gồm nhóm điều trị, thời gian, tương tác giữa điều trị – thời gian, HbA1c tại thời điểm trước nghiên cứu, phân tầng và vùng nghiên cứu là các yếu tố cố định, và bệnh nhân là yếu tố ngẫu nhiên. Dựa trên mô hình này, sự khác biệt điều trị được ước tính sau 4, 12, và 20 tuần điều trị.
Tỷ lệ bệnh nhân đạt mục tiêu HbA1c< 7.0% và ≤6.5% sau 20 tuần điều trị không kèm theo hoặc có kèm theo các cơn hạ đường huyết (hạ đường huyết nặng có triệu chứng, hạ đường huyết nặng và nhẹ) được phân tích riêng trên mô hình hồi quy logistic trong đó các yếu tố nhóm điều trị, phân tầng và quốc gia là yếu tố phân tích và HbA1c tại thời điểm trước nghiên cứu là đồng biến.
Thay đổi tính từ điểm trước nghiên cứu giá trị FPG sau 20 tuần điều trị được phân tích sử dụng mô hình hồi quy tuyến tính trong đó yếu tố nhóm điều trị, phân tầng và quốc gia là yếu tố phân tích và HbA1c tại thời điểm trước nghiên cứu là đồng biến.
Mô hình ảnh hưởng hỗn hợp được xây dựng dựa trên giá trị SMPG tại 7 thời điểm tại tuần 20. Mô hình này bao gồm nhóm điều trị, thời gian, tương tác giữa nhóm điều trị và thời gian, phân tầng và quốc gia là các yếu tố cố định và bệnh nhân là yếu tố ngẫu nhiên.
Gia tăng đường huyết (PG) sau ăn cho mỗi bữa ăn được tính toán từ dữ liệu dung mạo PG tại 7 thời điểm đánh giá dựa trên sự khác biệt giá trị PG trước khi ăn và 90 phút sau khi ăn. Gia tăng PG sau khi ăn cho mỗi bữa ăn được phân tích sử dụng mô hình hồi quy tuyến tính trong đó nhóm điều trị, phân tầng và quốc gia là các yếu tố phân tích và giá trị tại điểm mốc tương ứng là đồng biến.
Thời gian đến khi đạt được PG mục tiêu được đánh giá sử dụng dung mạo SMPG được đo tại 2 thời điểm. Kết cục không có biến cố được phân tích dựa trên mô hình nguy cơ tương xứng của Cox trong đó nhóm điều trị, phân tầng và quốc gia là các yếu tố phân tích. Các bệnh nhân bị mất dữ liệu và những bệnh nhân không đạt được mục tiêu trong thời gian điều trị được xem là dữ liệu bị cắt tại ngày cuối cùng điều trị.
Bộ câu hỏi sử dụng trong nghiên cứu là bộ câu hỏi TRIM-D, trong đó ghi nhận tổng số điểm và điểm số trong 5 phân nhóm. Sau khi ghi nhận điểm số trên 20 câu hỏi, điểm số sẽ được chuyển sang thang điểm 0-100 trong đó điểm số càng cao thể hiện tình trạng sức khỏe càng tốt. Điểm số tổng cộng và điểm số trong từng phân nhóm được phân tích riêng sử dụng mô hình hồi quy tuyến tính trong đó nhóm điều trị, phân tầng và quốc gia là các yếu tố phân tích, và giá trị điểm số tại điểm mốc tương ứng là đồng biến. Số các cơn hạ đường huyết được phân tích sử dụng mô hình hồi quy nhị thức âm với hàm log-link, trong đó offset được thiết lập là logarithm của thời gian cơn hạ đường huyết xuất hiện khi điều trị. Trong mô hình này, nhóm điều trị, phân tầng và quốc gia là các yếu tố phân tích.
Thay đổi trọng lượng cơ thể sau 20 tuần điều trị so sánh với điểm mốc trước điều trị được phân tích sử dụng mô hình hồi quy tuyến tính trong đó nhóm điều trị, phân tầng và quốc gia là các yếu tố phân tích, trọng lượng cơ thể trước nghiên cứu là đồng biến.
III. KẾT QUẢ
Đối tượng nghiên cứu và nghiên cứu viên
Trong số 280 bệnh nhân được sàng lọc, 155 bệnh nhân được chọn ngẫu nhiên, trong đó có 88,4% hoàn thành nghiên cứu (Hình 1). Có 125 bệnh nhân thất bại sàng lọc; 84 bệnh nhân không đạt được tiêu chí HbA1c bao gồm (≥7% và ≤10%) và 26 bệnh nhân bị mất dấu và ngừng nghiên cứu. Tỷ lệ bỏ cuộc là 9,2% (7 trong số 76 bệnh nhân) và 13,9% (11 trong số 79 bệnh nhân), tương ứng trong nhóm nghiên cứu do bệnh nhân định liều và nhóm bác sĩ định liều. Đặc điểm tại thời điểm trước nghiên cứu là tương đối giống nhau giữa các nhóm nghiên cứu (Bảng 2). Nhìn chung, tuổi trung bình là 54,7 năm, thời gian mắc bệnh đái tháo đường là 9,5 năm, HbA1c là 8,6%, và chỉ số BMI là 29,0 kg/m2, trong đó nam giới chiếm 25,2% số đối tượng nghiên cứu.
Tại thời điểm sàng lọc, 16,1% bệnh nhân có bệnh lý thần kinh do đái tháo đường, 5,2% bệnh nhân có bệnh lý mạch máu lớn, 3,2% có bệnh võng mạc đái tháo đường, và 3,2% có bệnh thận đái tháo đường. Trong nhóm do bác sĩ điều chỉnh liều, điều chỉnh liều được thực hiện bởi các bác sĩ đa khoa (n = 2), bác sĩ chuyên khoa (n = 21), và bác sĩ nội khoa (n = 15).
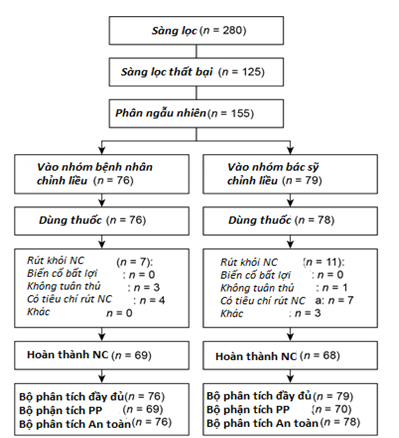
Biểu đồ 1. Bệnh nhân đăng ký, phân ngẫu nhiên và phân tích. PP= Theo đề cương nghiên cứu
Bảng 2. Nhân khẩu học và đặc điểm cơ bản của bệnh nhân được phân ngẫu nhiên
chuyển đổi từ một chế độ điều trị insulin NPH sang BIAsp 30 BID
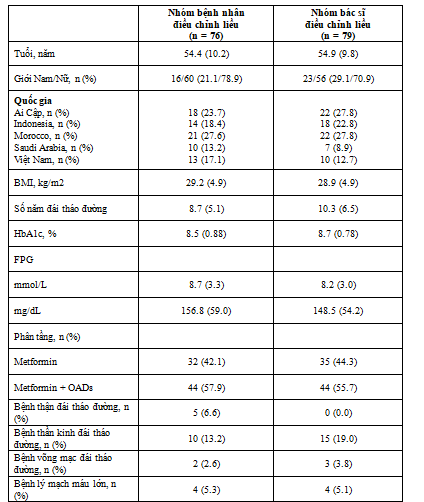 BID:hai lần một ngày, BMI:chỉ số khối cơ thể, FPG:đường huyết lúc đói, M/F Nam/Nữ, NPH: neutral protamine Hagedorn, OAD:thuốc đái tháo đường dùng đường uốngCác dữ liệu được trình bày là trung bình (SD) trừ khi có chỉ dẫn khác
BID:hai lần một ngày, BMI:chỉ số khối cơ thể, FPG:đường huyết lúc đói, M/F Nam/Nữ, NPH: neutral protamine Hagedorn, OAD:thuốc đái tháo đường dùng đường uốngCác dữ liệu được trình bày là trung bình (SD) trừ khi có chỉ dẫn khác
Hiệu quả
HbA1c trung bình quan sát được giảm trong suốt nghiên cứu ở cả hai nhóm điều điều chỉnh liều (Hình. 2a). Việc giảm HbA1c phân tích trên FAS cho thấy cao hơn về mặt số lượng trong 4 tuần điều trị đầu tiên ở nhóm bác sĩ định liều so với nhóm bệnh nhân định liều.
Giá trị trung bình ước tính [sai số chuẩn (SE)] giảm HbA1c từ lúc trước nghiên cứu đến tuần 20 tương ứng là -1.27 (0.11)% và -1,04 (0.11)% trong nhóm bệnh nhân tự điều chỉnh liều so với nhóm bác sĩ điều chỉnh liều, phân tích trên bộ dữ liệu FAS, với một sự khác biệt điều trị ước tính (ETD; nhóm bệnh nhân điều chỉnh liều – nhóm bác sĩ điều chỉnh liều) là -0,23% (95% CI -0,54; 0,08). Tính không kém hơn của việc điều trị do bệnh nhân tự điều chỉnh liều so với bác sĩ điều chỉnh liều xét trên việc giảm HbA1c được xác lập khi phân tích trên FAS, trong đó giới hạn trên của 95% CI hai bên là ≤0.4%. Phân tích kết cục chính trên bộ phân tích PP cũng cho kết quả tương tự.
Các phân tích độ nhạy MMRM cũng ủng hộ những phát hiện trong phân tích chính, với sự khác biệt điều trị ước tính ETD là -0,15% (95% CI -0,49; 0,19) sau 20 tuần điều trị.
Nhiều bệnh nhân đạt mức mục tiêu HbA1c <7,0% (<53,0 mmol/mol) và ≤6.5% (≤47.5 mmol/mol) ở nhóm bệnh nhân điều chỉnh liều so với nhóm bác sĩ điều chỉnh liều ở tuần 20 (Hình. 2b). Hơn nữa, cũng có nhiều bệnh nhân đạt mức HbA1c mục tiêu <7,0% (<53,0 mmol/mol) hoặc ≤ 6,5% (≤7.5 mmol/mol) mà không có các cơn hạ đường huyết nặng hoặc nhẹ trong nhóm bệnh nhân tự điều chỉnh liều nhiều hơn nhóm bác sĩ điều chỉnh liều ở tuần 20 (Hình.2c).
FPG giảm ở cả hai nhóm điều trị trong suốt nghiên cứu (Hình. 3a). Giá trị trung bình ước tính (SE) thay đổi FPG từ lúc trước nghiên cứuđến tuần 20 là -0,95 (0,28); -17,04 (5.10) mg/dL ở nhóm bệnh nhân điều chỉnh liều và -0,67 (0,28); -12,05 (5.10) mg/dL ở nhóm bác sĩ điều chỉnh liều, với ETD giữa hai nhóm là -0,28 mmol/L (95% CI -1,07; 0,52); -4,99 mg/dL (95% CI -19,32; 9,34). Điều trị bằng BIAsp 30 giảm dung mạo SMPG đo tại 7 thời điểm so với thời điểm trước nghiên cứu trong cả hai nhóm điều chỉnh liều [ETD xét chung là: 0.2 mmol/L (95% Cl -0.3; 0.7); 4,3 mg/dL (95% CI -4,72; 13.37)] (Hình 3b.). Sau 20 tuần điều trị, các giá trị PG sau bữa ăn trung bình quan sát được tương tự nhau giữa hai nhóm vào bữa sáng, bữa trưa và bữa tối (chiều).
Mức tăng trung bình sau tất cả các bữa ăn quan sát được là 1,8 mmol/L (33,3 mg/dL) ở nhóm bệnh nhân điều chỉnh liều và 2,0 mmol/L (35,1 mg/dL) ở nhóm bác sĩ điều chỉnh liều.
Đến cuối nghiên cứu, 57,9% bệnh nhân ở nhóm bệnh nhân điều chỉnh liều và 70,9% bệnh nhân ở nhóm bác sĩ điều chỉnh liều đạt được mục tiêu SMPG 2điểm.
Thời gian để đạt được mục tiêu SMPG 2 điểm đầu tiên cũng tương tự nhau ở cả hai nhóm điều trị [14,4 tuần (95% CI 12,3; 19,9) cho nhóm bệnh nhân điều chỉnh liều và 13,9 tuần (95% CI 10,1; 14,1) cho nhóm bác sĩ điều chỉnh liều].
Kết quả do bệnh nhân tự báo cáo và sử dụng chăm sóc y tế
Điểm số TRIM-D tổng cộng và trong phạm vicá thể trong hai nhóm điều chỉnh liều tương tự nhau.
Tổng số điểm TRIM-D trung bình tăng từ 66,9 lên 75,1 trên tổng số 100 ở nhóm bệnh nhân điều chỉnh liều và từ 65,9 lên 72,5 trên tổng số 100 ở nhóm bác sĩ điều chỉnh liều.
Phù hợp với thiết kế thử nghiệm, số lần khám tại bệnh viện ít hơn ở nhóm bệnh nhân điều chỉnh liều [trung bình (SD) 4,8 (0,65) lần / bệnh nhân] so với nhóm bác sĩ điều chỉnh liều [7,5 (1,42) lần / bệnh nhân] , và giá trị trung bình (SD) tổng số que thử BG sử dụng cho mỗi bệnh nhân trong nghiên cứu 20 tuần cao hơn một chút ở nhóm bệnh nhân điều chỉnh liều [37,5 (15,22) cho mỗi bệnh nhân] so với nhóm bác sĩ điều chỉnh liều [31,3 (20,33) mỗi bệnh nhân].
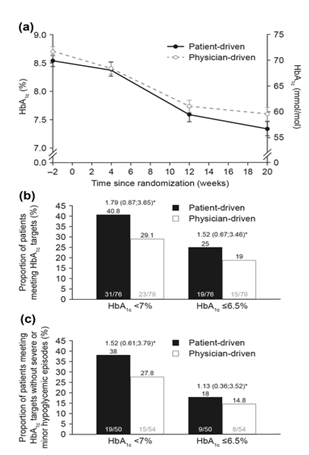
Hình. 2 a Trung bình (± SE) mức HbA1c (LOCF) theo thời gian; b tỷ lệ bệnh nhân quan sát được có nồng độ HbA1c (LOCF) < 7% hoặc≤6.5% ở tuần thứ 20; c tỷ lệ bệnh nhân quan sát được đạt mục tiêu HbA1c (LOCF) mà không có cơn hạ đường huyết nặng và nhẹ ở tuần thứ 20. Dữ liệu từ FAS. * Odds ratio ước tính (95% CI) so sánh giữa nhóm bệnh nhân điều chỉnh liều so với nhóm bác sĩđiều chỉnh liều. Hồi quy logistic với điều trị, phân tầng, địa phương và HbA1c ban đầu là biến giải thích. Cơn hạ đường huyết được định nghĩa là cơn với các triệu chứng phù hợp với hạ đường huyết được xác định bằng PG < 3.1 mmol/L (< 56 mg/dL) hoặc tất cả các giá trị BG < 2.8 mmol/L(< 50 mg/dL) và xử lý bởi các bệnh nhân tự / mình, hoặc bất kỳ giá trị PG không có triệu chứng < 3.1 mmol/L (56 mg/dL) hoặc tất cả các giá trị BG < 2.8 mmol/L (< 50 mg/dL). Hạ đường huyết nghiêm trọng được định nghĩa là một cơn hạ đường huyết đòi hỏi phải có sự hỗ trợ của người khác để dùng carbohydrate, glucagon, hoặc hành động hồi sức khác. BG glucose trong máu, CI Khoảng tin cậy, FAS bộ phân tích đầy đủ, LOCF giá trị cuối chuyển ra sau, PG glucose huyết tương, SE sai số chuẩn.
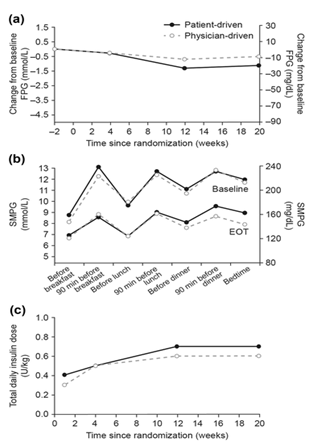
Hình. 3 a Trung bình thay đổi so với ban đầu FPG (LOCF); b dữ liệu SMPG 7 điểm so sánh giữa ban đầu và sau 20 tuần điều trị (EOT); c tổng liều insulin hàng ngày. Dữ liệu từ FAS. EOT kết thúc điều trị, FPG đường huyết lúc đói, LOCF giá trị cuối chuyển ra sau, SMPG glucose huyết tương tự đo
Liều BIAsp
Phần lớn các đối tượng tham gia nghiên cứu thuộc bộ phân tích SAS trong nhóm bệnh nhân điều chỉnh liều (84,2%) và nhóm bác sĩ điều chỉnh liều (75,9%) đã sử dụng BIAsp 30 hơn 20 tuần, mà không có sự khác biệt rõ ràng về thời gian điều trị giữa các nhóm (27,45 và 28,13 đối tượng – năm tương ứng trong nhóm bệnh nhân điều chỉnh liều và bác sĩ điều chỉnh liều). Tổng liều trung bình hàng ngày của BIAsp 30 cao hơn về số lượng ở nhóm bệnh nhân điều chỉnh liều so với nhóm bác sĩ điều chỉnh liều trong suốt nghiên cứu. Sau 20 tuần điều trị, liều insulin trung bình (SD) trong bộ phân tích FAS là 0,7 (0,31) U/kg ở nhóm bệnh nhân điều chỉnh liều và 0,6 (0,23) U/kg ở nhóm bác sĩ điều chỉnh liều (Hình. 3c ).
An toàn
Trong số 154 đối tượng tham gia n/c trong bộ phân tích an toàn SAS, 77 đối tượng trải qua một hoặc nhiều hơn một cơn hạ đường huyết trong thời gian n/c 20 tuần (Bảng 3). Tỷ lệ các cơn hạ đường huyết là 608,4 so với 789,2 trên 100 bệnh nhân – năm trong nhóm bệnh nhân điều chỉnh liều và nhóm bác sĩ điều chỉnh liều (Bảng 3). Chỉ có ba cơn hạ đường huyết nặng: hai cơn được báo cáo bởi một bệnh nhân tham gia nghiên cứu ở nhóm bệnh nhân điều chỉnh liều và một trong nhóm bác sĩ điều chỉnh liều. Tỷ lệ tương đối ước tính (RR) giữa điều trị theo bệnh nhân điều chỉnh liều và bác sĩ điều chỉnh liều là 0.74 (95% CI: 0.44, 1.23) đối với cáccơn hạ đường huyết chung trong thời gian nghiên cứu theo phân loại ADA, 0.66 (95% CI: 0.32, 1.34) đối với các cơn hạ đường huyết nặng hoặc nhẹ, và 1.07 (95% CI: 0.46, 2.49) và 0.82 (95% CI: 0.27, 2.53) đối với các cơn hạ đường huyết ban đêm và cơn hạ đường huyết ban đêm nặng hoặc cơn hạ đường huyết nhẹ, tương ứng.
Bệnh nhân tăng cân ở cả hai nhóm điều chỉnh liều. Sự thay đổi tuyệt đối về trọng lượng cơ thể (SD) là 1,4 (3,5) kg ở nhóm bệnh nhân điều chỉnh liều và 1,9 (4,1) kg trong nhóm bác sĩ điều chỉnh liều [ETD -0,26 kg (95% CI: -1,45, 0,93)].
Tỉ lệ chung các biến cố bất lợi(AE) xuất hiện trong thời gian nghiên cứu cao hơn ở nhóm bệnh nhân điều chỉnh liều so với nhóm bác sĩ điều chỉnh liều (324,2 so với 302,2 lần/100 bệnh nhân – năm sử dụng) (Bảng 4). Năm biến cố bất lợi nghiêm trọng được báo cáo trong nhóm bác sĩ điều chỉnh liều và tất cả được đánh giá là “không có liên quan đến sản phẩm nghiên cứu” theo nghiên cứu viên.
Không có vấn đề an toàn nào được quan sát thấy qua đánh giá các dấu hiệu sinh tồn, khám sức khoẻ, hoặc xét nghiệm.
IV. BÀN LUẬN
Nghiên cứu đa trung tâm, ngẫu nhiên, có đối chứng này cho thấy, sau khi chuyển từ insulin NPH sang BIAsp 30, kết quả ở nhóm bệnh nhân điều chỉnh liều không kém hơn so với nhóm bác sĩ điều chỉnh liều xét trên sự thay đổi HbA1c tính từ điểm trước nghiên cứu tới 20 tuần sau điều trị
Bảng 3. Tóm tắt các cơn hạ đường huyết trong thời gian điều trị theo phân loại của ADA
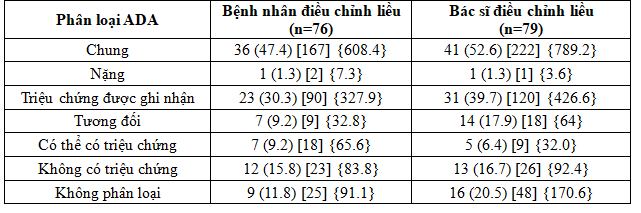
Dữ liệu trình bày n (%) [E] {tỷ lệ}
% phần trăm số đối tượng, ADA Hội Đái Tháo Đường Hoa Kỳ, AE biến cố bất lợi, E Số cơn, n số đối tượng nghiên cứu, tỷ lệ là tỷ lệ trên 100 bệnh nhân- năm dùng thuốc
Bảng 4. Tóm tắt các biến cố bất lợi trong quá trình điều trị
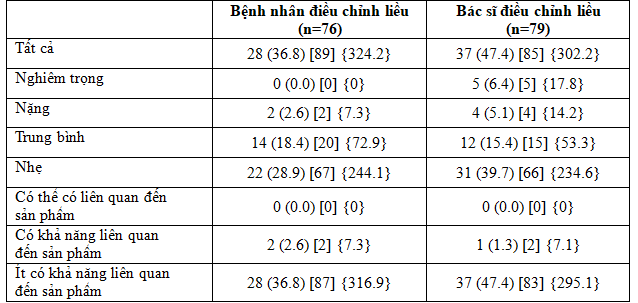 Dữ liệu trình bày n (%) [E] {tỷ lệ}
Dữ liệu trình bày n (%) [E] {tỷ lệ}
% phần trăm số đối tượng, ADA Hội Đái Tháo Đường Hoa Kỳ, AE biến cố bất lợi, E Số cơn, n số đối tượng nghiên cứu, tỷ lệ là tỷ lệ trên 100 bệnh nhân- năm dùng thuốc
Điều quan trọng cần lưu ý là một trong những hạn chế chính của nghiên cứu này là số bệnh nhân được chọn ngẫu nhiên thấp. Việc tuyển chọn bệnh nhân đã được kết thúctrước khi tuyển đủ bệnh nhân do số nhỏ bệnh nhân đủ điều kiện điều trị bằng insulin NPH tại các địa điểm nghiên cứu. Tuy nhiên, kết quả của nghiên cứu này phù hợp với các nghiên cứu trước đó đã báo cáo việc tự điều chỉnh liều insulin là có hiệu quả trong việc cải thiện kiểm soát đường huyết ở bệnh nhân đái tháo đườngtýp 2 [6, 21-23]. Ví dụ, nghiên cứu ATLAS cho thấy việc điều chỉnh liều insulin glargine theo bệnh nhân không kém hơn so với bác sĩ điều chỉnh liều xét trên kiểm soát glucose máu gần mục tiêu ở những bệnh nhân Châu Á bị đái tháo đường týp 2 không kiểm soát được với các thuốc điều trị đái tháo đường dạng uống [31, 32].
Trong nghiên cứu này, giảm HbA1c lớn hơn về mặt số lượng trong 4 tuần đầu tiên điều trị ở nhóm bác sĩ điều chỉnh liều so với nhóm bệnh nhân tự điều chỉnh liều. Tuy nhiên, sau 12 tuần, giảm HbA1c tương đương nhau giữa hai nhóm. Ngoài ra, việc chỉnh tăng liều insulin cũng mạnh mẽ hơn trong nhóm bác sĩ điều chỉnh liều trong 4 tuần đầu tiên của nghiên cứu.
Quan sát này chỉ ra rằng, ban đầu, bệnh nhân đang học cách đánh giá bằng cách sử dụng quy định điều chỉnh liều và, khi thấy thoải mái, bệnh nhân có thể đạt được kiểm soát glucose máu dự kiến. Các kết quả khác của hiệu quả (FPG, PG và SMPG) dường như tương đương giữa hai phương pháp điều chỉnh liều, gợi ý thêm rằng điều chỉnh liều do bệnh nhân có thể thành công như điều điều chỉnh liều của bác sĩ. Sự hài lòng của bệnh nhân, được đo bằng điểm TRIM-D, cũng tương tự ở cả hai phương pháp điều chỉnh liều.
Giảm mạnh hơn về mặt số lượng HbA1c tính từ trước nghiên cứu đến tuần 20 ở nhóm bệnh nhân điều chỉnh liều có thể là do sự điều chỉnh liều insulin mạnh hơn của bệnh nhân so với các bác sĩ trong thời gian duy trì của nghiên cứu. Tuy nhiên, việc sử dụng liều điều trị insulin cao hơn và giảm HbA1c ở nhóm bệnh nhân điều chỉnh liều không làm tăng các trường hợp tăng glucose máu, cho thấy rằng, với sự huấn luyện đầy đủ, việc điều chỉnh liều BIAsp 30 của bệnh nhân không làm tăng mối lo ngại về an toàn.
Đây là nghiên cứu lâm sàng ngẫu nhiên đầu tiên chứng minh rằng việc bệnh nhân tự điều chỉnh liều cũng hiệu quả như bác sĩ điều chỉnh liều xét trên mục tiêu HbA1c ở những bệnh nhân chuyển từ insulin NPH sang BIAsp 30 tại các quốc gia không thuộc Tây Âu. Một nghiên cứu trên thực tế lâm sàng quy mô nhỏ tại Hà Lan đã chỉ ra rằng những bệnh nhân đái tháo đường týp 2 chuyển từ chế độ dùng insulin, bao gồm insulin NPH, sang dùng BIAsp 30 và sẵn sàng tự điều chỉnh liều có thể cải thiện kiểm soát đường huyết [33].
Các nghiên cứu ngẫu nhiên trước đây đã chứng minh sự không kém hơn của việc bệnh nhân tự điều chỉnh liều BIAsp 30 so với bác sĩ điều chỉnh liều, các nghiên cứu này được thực hiện ở nhóm bệnh nhân khác với nghiên cứu hiện tại. Thử nghiệm INITIATEplus thu nhận các bệnh nhân đái tháo đường týp 2chưa sử dụng insulin kiểm soát kém với OAD [20], và một nghiên cứu khác thu nhận bệnh nhân Trung Quốc chuyển từ insulin trộn sẵn/ tự trộn sang BIAsp 30 [34]. Ngược lại, thử nghiệm SimpleMix, được thực hiện ở Argentina, Trung Quốc, Ấn Độ, Ba Lan và Anh ở những bệnh nhân đái tháo đường týp 2 không kiểm soát được với các insulin analogs nền, không thể chứng minh được tính không kém hơn của việc bệnh nhân tự điều chỉnh liều BIAsp so với bác sĩ điều chỉnh liều [27].
Trong nghiên cứu hiện tại, kiểm soát glucose máu được cải thiện sau khi chuyển từ insulin NPH sang BIAsp 30 ở cả hai nhóm, điều này làm nổi bật giá trị của việc tăng cường insulin ở bệnh nhân đái tháo đường týp 2. Các insulin analogshiện đại có lợi thế về giảm nguy cơ hạ đường huyết và tăng cân, cũng như khả năng tiên đoán được tác động insulin tốt hơn so với các chế phẩm insulin người truyền thống [35].Ngoài ra, các insulin analogs trộn sẵn (hỗn hợp/2 pha) mang lại lợi ích là sử dụng đơn giản, với ít mũi tiêm hơn và hiệu quả tương tự và an toàn như là phác đồ insulin nền – insulin nhanh [36,37].
Với sự gia tăng số lượng bệnh nhân đái tháo đường và nguồn lực nhân viên y tế hạn chế, đặc biệt là ở các quốc gia không thuộc Tây Âu, nhu cầu bệnh nhân tự điều chỉnh liều sẽ cao hơn. Trong nghiên cứu này, bệnh nhân trong nhóm tự điều chỉnh liều ít đến khám bác sĩ hơn cho thấy việc tự điều chỉnh liều làm giảm việc sử dụng dịch vụ chăm sóc y tế. Trong một thử nghiệm tương tự ở Trung Quốc, việc tự điều chỉnh liều BIAsp 30 ở bệnh nhân có liên quan đến việc sử dụng dịch vụ chăm sóc y tế ít hơn và chi phí thấp hơn so với phương pháp điều trị theo bác sĩ điều chỉnh liều và việc này không ảnh hưởng đến kiểm soát glucose máu [38].
Các vấn đề chính khi quyết định xem bệnh nhân hoặc bác sĩ ai sẽ là người điều điều chỉnh liều insulin và thành công của việc bệnh nhân tự điều chỉnh liều phụ thuộc vào động lực của bệnh nhân muốn tự quản lý bệnh của họ hay không.
Điều này bị ảnh hưởng bởi các yếu tố như tuổi tác, tình trạng kinh tế xã hội, hiểu biết về sức khoẻ và khả năng tính toán, và các khía cạnh văn hoá của chăm sóc y tế ở các quốc gia khác nhau. Sự hiểu biết về y tế kém và khả năng tính toán kém liên quan đến kiến thức về bệnh thấp, ít hành vi tự quản lý, khó hiểu các hướng dẫn điều chỉnh liều, và kết cục bệnh đái tháo đường tồi tệ hơn [6]. Sự trao quyền và giáo dục bệnh lý đóng vai trò quan trọng trong việc cải thiện hành vi tự chăm sóc, chất lượng cuộc sống và kết cục ở bệnh nhân đái tháo đường [39, 40]. Nghiên cứu này cho thấy rằng, sau 4 tuần tập huấn, bệnh nhân ở các nước không thuộc Tây Âu có thể tự định liều BIAsp 30 một cách hiệu quả và an toàn bằng cách sử dụng một quy trình đã được xác định trước.
V. KẾT LUẬN
Đây là nghiên cứu ngẫu nhiên đầu tiên để minh chứng rằng việc bệnh nhân tự điều chỉnh liều BIAsp 30 BID ít nhất cũng có hiệu quả và an toàn như việc bác sĩ điều chỉnh liều BIAsp 30 BID ở những bệnh nhân đái tháo đường týp 2, không thuộc các nước Tây Âu, và không còn kiểm soát được glucose máuvới insulin NPH.
LỜI CẢM ƠN
Xin chân thành gửi lời cám ơn đến:
Bệnh viện Nguyễn Tri Phương, TS.BS. Trần Quang Khánh – nghiên cứu viên chính tại bệnh viện
Bệnh viện Đại học Y dược TPHCM, ThS.BS. Diệp Thị Thanh Bình – nghiên cứu viên chính tại bệnh viện
Bệnh viện Nhân dân 115, TS.BS Trần Quang Nam – nghiên cứu viên chính tại bệnh viện,
Bệnh viện Bạch Mai, PGS.TS.BS Nguyễn Khoa Diệu Vân – nghiên cứu viên chính tại bệnh viện,
Bệnh viện Chợ Rẫy,Cùng tất cả các quý đồng nghiệp và các bệnh nhân đã tham gia và hỗ trợ nghiên cứu BIAsp 3968 tại Việt Nam được hoàn thành.
PGS.TS.BS. Nguyễn Thị Bích Đào – Chủ nhiệm đề tài
Nghiên cứu được tài trợ bởi Novo Nordisk A / S, Đan Mạch. Phí viết bài được hỗ trợ bởi Watermeadow Medical, một công ty của Ashfield, bộ phận của UDG Healthcare plc.
Việc viết bài và đăng bài được hỗ trợ trình bởi Helen Parker và Helen Marshall của Watermeadow Medical, một công ty của Ashfield, bộ phận của UDG Healthcare plc, được tài trợ bởi Novo Nordisk A / S.
Tất cả các tác giả có tên trong bài báo đều đáp ứng tiêu chuẩn của Ủy ban Quốc tế các Biên tập viên Tạp chí Y học (ICMJE) đối với quyền tác giả của bản thảo này, chịu trách nhiệm chung về tính toàn vẹn của tác phẩm, và đã phê duyệt để được công bố kết quả.
Chúng tôi cảm ơn tất cả các bệnh nhân, các nghiên cứu viên, và các thành viên tham gia nghiên cứu, những người đã tham gia vào việc thực hiện nghiên cứu thử nghiệm này.
Công bố thông tin. Anil Shinde là nhân viên của Novo Nordisk. Balasubramanian Lakshmivenkataraman là nhân viên của NovoNordisk. Abdelmjid Chraibi nhận được hỗ trợ tài chính từ Novo Nordisk để thực hiện nghiên cứu, chi phí báo cáo viên và tài trợ hội nghị từ Novo Nordisk bên ngoài công việc được đệ trình. Shoorook Al-Herznhận được hỗ trợ tài chính để thực hiện nghiên cứu. Djoko W. Soeatmadji là nhân viên của Đại học Bwarijaya, nhận được hỗ trợ tài chính từ Novo Nordisk để thực hiện nghiên cứu, chi phí báo cáo viên và tài trợ hội nghị từ Novo Nordisk bên ngoài công việc được đệ trình. SamirH. Assaad-Khalilvà Bich Dao Nguyen không có gì để công bố.
Tuân thủ Nguyên tắc Đạo đức. Tất cả các thủ tục nghiên cứu đều tuân theo các tiêu chuẩn đạo đức của ủy ban có trách nhiệm về thử nghiệm trên con người (cấp cơ sở và quốc gia), phù hợp với Tuyên bố Helsinki năm 1964, và bản sửa đổi vào năm 2013. Phiếu chấp thuận tham gia nghiên cứu này được thu thập từ tất cả các bệnh nhân. Quy trình nghiên cứu đã được Bộ Y tế Ai Cập phê duyệt, cũng như Ủy ban Đạo đức của Khoa Y tại Đại học Alexandria, Alexandria, Ai Cập phê duyệt.
Dữ liệu sẵn có. Các tác giả sẽ cung cấp các bộ dữ liệu thu được trong nghiên cứu và/hoặc được phân tích trong nghiên cứu khi có các yêu cầu hợp lý.
Truy cập mở. Bài viết này được công bố và cung cấp theo các điều khoản của Giấy phép Quốc tế – 4.0 Sáng kiến phổ cập chung phi thương mại (http://creativecommons.org /licenses/ by-nc / 4.0/), trong đó cho phép sử dụng tùy ý vì mục đích phi thương mại, được phép phân phối và tái bản dưới bất kỳ hình thức nào, miễn là có trích dẫn tác giả và nguồn cung cấp, và kèm theo đường dẫn đến Giấy phép quốc tế – Sáng kiến phổ cập chung phi thương mại, và ghi rõ nếu có những thay đổi đã được thực hiện.
TÀI LIỆU THAM KHẢO
- International Diabetes Federation. IDF diabetes atlas. 7th ed. Brussels: International Diabetes Federation; 2015.
- American Diabetes Association. Standards of medical care in diabetes— Diabetes Care. 2016; 39(Suppl. 1):S1–109.
- IDF Clinical Guidelines Task Force. Global guideline for type 2 diabetes. Brussels: International Diabetes Federation; 2012. www.idf.org. Accessed Aug 2016.
- UK Prospective Diabetes Study (UKPDS) Group. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet. 1998; 352:837–53.
- Colagiuri S, Dickinson S, Girgis S, Colagiuri R. National evidence based guideline for blood glucose control in type 2 diabetes. Canberra: Diabetes Australia and the NHMRC; 2009. www.diabetesaustralia. com.au/For-Health-Professionals/Diabetes-NationalGuidelines/. Accessed Feb 23, 2017.
- Khunti K, Davies MJ, Kalra S. Self-titration of insulin in the management of people with type 2 diabetes: a practical solution to improve management in primary care. Diabetes Obes Metab. 2013;15(8): 690–700.
- Inzucchi SE, Bergenstal RM, Buse JB, et al. Management of hyperglycemia in type 2 diabetes, 2015: a patient-centered approach: update to a position statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes Care. 2015;38(1):140–9.
- Assaad-Khalil SH, Zaki A, Guindy MAS, Megallaa MH. Assessment of patient characteristics, metabolic control and therapeutic management of diabetic patients in Egypt: results from the cross-sectional wave-2006 of the International Diabetes Management Practices Study (IDMPS). J Egypt Soc Endocrinol Metab Diabetes. 2011;43(2): 3–14.
- Al-shaqha WM, Al-Janabi FA, Chaudhary AA, Alkharfy KM. Insulin prescribing practices in Saudi Arabia. World J Pharm Sci. 2015;4(2):29–40.
- Chadli A, El Aziz S, El Ansari N, Ajdi F, Seqat M, Latrech H, Belmejdoub G. Management of diabetes in Morocco: results of the International Diabetes Management Practices Study (IDMPS)—wave 5. Ther Adv Endocrinol Metab. 2016;7(3):101–9.
- Weyer C, Heise T, Heinemann L. Insulin aspart in a 30/70 premixed formulation. Pharmacodynamic properties of a rapid-acting insulin analog in stable mixture. Diabetes Care. 1997;20(10):1612–4.
- Gumprecht J, Benroubi M, Borzi V, et al. Intensification to biphasic insulin aspart 30/70 (BIAsp 30, NovoMix 30) can improve glycemic control in patients treated with basal insulins: a subgroup analysis of the IMPROVETM observational study. Int J Clin Pract. 2009;63(6):966–72.
- Khunti K, Nikolajsen A, Thorsted BL, Andersen M, Davies MJ, Paul SK. Clinical inertia with regard to intensifying therapy in people with type 2 diabetes treated with basal insulin. Diabetes Obes Metab. 2016;18:401–9.
- Al-Elq AH. Current practice in the management of patients with type 2 diabetes mellitus in Saudi Arabia. Saudi Med J. 2009;30(12):1551–6.
- Soewondo P, Soegondo S, Suastika K, Pranoto A et al. The DiabCare Asia 2008 study—outcomes on control and complications of type 2 diabetic patients in Indonesia. Med J Indones. 2010;9(4):235–44.
- Zafar A, Stone MA, Davies MJ, Khunti K. Acknowledging and allocating responsibility for clinical inertia in the management of type 2 diabetes in primary care: a qualitative study. Diabet Med. 2015;32(3):407–13.
- Almaatouq MA, Al-Arouj M, Amod A, Assaad-Khalil SH, Assaad SN, et al. Barriers to the delivery of optimal antidiabetic therapy in the Middle East and Africa. Int J Clin Pract. 2014;68(4):503–11.
- World Health Organization. Density of physicians (total number per 1000 population, latest available year). 2016. http://www.who.int/gho/health_ workforce/physicians_density/en/. Last accessed Oct 2016.
- Soewondo P, Ferrario A, Tahapary DL. Challenges in diabetes management in Indonesia: a literature review. Glob Health. 2013;9:63.
- Rolla A. Pharmacokinetic and pharmacodynamic advantages of insulin analogues and premixed insulin analogues over human insulins: impact on efficacy and safety. Am J Med. 2008;121(6 Suppl):S9–19.
- Oyer DS, Shepherd MD, Coulter FC, Bhargava A, Brett J, Chu PL, Trippe BS, INITIATEplus Study Group. A(1c) control in a primary care setting: self-titrating an insulin analog pre-mix (INITIATEplus trial). Am J Med. 2009;122(11):1043–9.
- Davies M, Storms F, Shutler S, Bianchi-Biscay M, Gomis R. Improvement of glycemic control in patients with poorly controlled type 2 diabetes: comparison of two treatment algorithms using insulin glargine. Diabetes Care. 2005;28:1282–8.
- Meneghini L, Koenen C, Weng W, Selam JL. The usage of a simplified self-titration dosing guideline (303 Algorithm) for insulin detemir in patients with type 2 diabetes—results of the randomized, controlled PREDICTIVE 303 study. Diabetes Obes Metab. 2007;9:902–13.
- Bell DS, Clements RS Jr, Perentesis G, Roddam R, Wagenknecht L. Dosage accuracy of self-mixed vs premixed insulin. Arch Intern Med. 1991;151(11):2265–9.
- Rolla AR, Rakel RE. Practical approaches to insulin therapy for type 2 diabetes mellitus with premixed insulin analogues. Clin Ther. 2005;27(8):1113–25.
- NovoNordiskA/S.EUSmPCforInsulinNovoMix30. EPAR_-_Product Information/human/000 308/WC 500029441. pdf. Accessed Nov 2016.
- Gao Y, Luquez C, Lynggaard H, Andersen H, Saboo B. The SimpleMix study with biphasic insulin aspart 30: a randomized controlled trial investigating patient-driven titration versus investigator-driven titration. Curr Med Res Opin. 2014;30(12):2483–92.
- Brod M, Hammer M, Christensen T, et al. Understanding and assessing the impact of treatment in diabetes: the Treatment-Related Impact Measures for Diabetes and Devices (TRIM-Diabetes and TRIM-Diabetes Device). Health Qual Life Endpoints. 2009;9(7):83.
- Workgroup on Hypoglycemia, American Diabetes Association. Defining and reporting hypoglycemia in diabetes: a report from the American Diabetes Association Workgroup on Hypoglycemia. Diabetes Care. 2005;28(5):1245–9.
- International Conference on Harmonisation. ICH Harmonised Tripartite Guideline: statistical principles for clinical trials. Geneva: ICH; 1998.
- Garg SK, Admane K, Freemantle N, et al. Patient-led versus physician-led titration of insulin glargine in patients with uncontrolled type 2 diabetes: a randomized multinational ATLAS study. Endocr Pract. 2015;21(2):143–57.
- ATLAS Study Group. Titration of insulin glargine in patients with type 2 DM in Asia: physician-versus patient-led? Rationale of the Asian Treat to Target Lantus Study (ATLAS). Diabetes Technol Ther. 2011;13(1):67–72.
- Ligthelm RJ. Self-titration of biphasic insulin aspart 30/70 improves glycemic control and allows easy intensification in a Dutch clinical practice. Prim Care Diabetes. 2009;3:97–102.
- Yang W, Zhu L, Meng B, et al. Subject-driven titration of biphasic insulin aspart 30 twice daily is non-inferior to investigator-driven titration in Chinese patients with type 2 diabetes inadequately controlled with premixed human insulin: a randomized, open-label, parallel-group, multicenter trial. J Diabetes Investig. 2016;7(1):85–93.
- Hartman I. Insulin analogs: impact on treatment success, satisfaction, quality of life, and adherence. Clin Med Res. 2008;6(2):54–67.
- Giugliano D, Chiodini P, Maiorino MI, Bellastella G, Esposito K. Intensification of insulin therapy with basal-bolus or premixed insulin regimens in type 2 diabetes: a systematic review and meta-analysis of randomized controlled trials. Endocrine. 2016;51:417–28.
- Malek R, Ajili F, Assaad-Khalil SH, Shinde A, Chen JW, Van den Berg E. Similar glucose control with basal-bolus regimen of insulin detemir plus insulin aspart and thrice-daily biphasic insulin aspart 30 in insulin-naı ¨ve patients with type 2 diabetes: results of a 50-week randomized clinical trial of stepwise insulin intensification. Diabetes Metab. 2015;41(3):223–30.
- Yang J, Liu K, Kiu L, et al. Health care utilizations and costs of insulin patient-driven titration versus physician-driven titration: evidence based on a clinical trial of biphasic insulin aspart 30 twice daily in people with type 2 DM in China. Value Health. 2014;17:A719–813.
- Hernandez-Tejada MA, Campbell JA, Walker RJ, Smalls BL, Davis KS, Egede LE. Diabetes empowerment, medication adherence and self-care behaviors in adults with type 2 diabetes. Diabetes Technol Ther. 2012;14(7):630–4.
- Funnell MM, Anderson RM. Empowerment and self-management of diabetes. Clin Diabetes. 2004; 22(3): 123–7.
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam




