TỈ LỆ GIẢM ĐỘ LỌC CẦU THẬN Ở NGƯỜI BỆNH
ĐÁI THÁO ĐƯỜNG TÍP 2
ĐIỀU TRỊ NGOẠI TRÚ TẠI BV NGUYỄN TRI PHƯƠNG
TS. Lê Tuyết Hoa, ThS. Nguyễn Thị Quỳnh Châu
Bộ Môn Nội, Đại Học Y Phạm Ngọc Thạch
Abstract
Background Data on the decline in kidney function in a single population of diabetic patients are limited. The study explores the proportion of type 2 diabetics with reduced eGFR and clinical factors attributed to the low eGFR. Methods A cross-sectional study in 2013 (216 patients with T2D aged 35-75) was done to collect data on anthropometry, duration of diabetes, blood pressure, lipidemia profiles, HbA1c, albuminuria and serum creatinin. eGFR according to MDRD was calculated for male and female. Reduced/low eGFR was assessed as eGFR <60 ml/min/1.73m2. Univariate regression analyses and stepwise regression models were used to identify significant clinical risk factors for renal outcome. Results 111 patients had albuminuria, (50.9% micro- and 19.4% macroalbumin) and 20.8% (n=45) of reduced eGFR. Advanced age, female, long duration of diabetes, overweight/obesity and albuminuria significantly associated with low eGFR. Conclusions The high proportion of decline in eGFR in the tertiary city-hospital highlights the need of reinforcing the preventive measures. Modifiable risk factors of low eGFR in diabetic patients should be early targeted in treatment.
1. MỞ ĐẦU
Gánh nặng bệnh tật của bệnh đái tháo đường (ĐTĐ) không chỉ ở số người mắc bệnh ngày càng nhiều mà còn do các biến chứng mạn tính tăng theo thời gian. ĐTĐ đặc biệt típ 2 là bệnh nguyên chính trong số những người phải khởi trị thay thế thận. Bệnh ĐTĐ làm tăng nguy cơ bệnh thận giai đoạn cuối gấp 10 – 20 lần so với dân số chung [1-2]. Một dấu ấn sinh hóa của bệnh thận mạn đã được xác định là albumin niệu, đây còn là chỉ điểm nguy cơ lâm sàng và tiên đoán giảm chức năng thận trong tương lai.
Nhưng độ lọc cầu thận mới được xem là chỉ số chính dùng chẩn đoán và phân loại giai đoạn bệnh thận theo Hướng dẫn Thực hành lâm sàng về Bệnh thận mạn KDOQI-CKD[3]. Những năm gần đây, theo Hiệp Hội ĐTĐ Hoa Kỳ, để sàng lọc bệnh thận mạn ở người ĐTĐ cần đánh giá hàng năm tỉ số ACR nước tiểu và độ lọc cầu thận.
Đã có khá nhiều nghiên cứu trong nước đánh giá tỉ lệ albumin niệu, nguy cơ tim mạch trên người bệnh có albumin niệu, yếu tố nguy cơ xuất hiện albumin niệu…Nhưng chưa biết đầy đủ về mức giảm độ lọc cầu thận hiện tại ở cộng đồng người ĐTĐ, sự tiến triển đến bệnh thận giai đoạn cuối ở người có bệnh thận sớm.
Nghiên cứu này được thực hiện nhằm xác định tỉ lệ giảm độ lọc cầu thận ở người ĐTĐ típ 2 điều trị ngoại trú tại BV NTPP và nhận diện một số yếu tố lâm sàng đi kèm với giảm eGFR.
2. PHƯƠNG PHÁP NGHIÊN CỨU
2.1 Thiết kế nghiên cứu – Cỡ mẫu
Nghiên cứu cắt ngang. Chọn mẫu liên tục từ những BN ĐTĐ típ 2 đang điều trị ngoại trú tại phòng khám Nội Tiết BV Nguyễn Tri Phương, từ tháng 08/2012 đến 04/2013. Cỡ mẫu được tính theo công thức:
Z= 1,645 (với α = 0.1); p= 0,40 [7]; d= 0,06 (sai số cho phép của một ước lượng).
n tính toán được là 180
2.2 Đối tượng nghiên cứu
Tiêu chuẩn chọn bệnh:
- BN ĐTĐ típ 2, tuổi từ 35 –75
- Đang điều trị ngoại trú tại phòng khám Nội Tiết BV NTP ít nhất 6 tháng
- Tình trạng lâm sàng ổn định
- Có đường huyết và huyết áp khá ổn định ít nhất 3 tháng
- Bệnh nhân đồng ý tham gia nghiên cứu
Tiêu chuẩn loại trừ:
- Tình trạng lâm sàng không ổn như có bệnh đi kèm khác nặng (tai biến mạch máu não, suy tim, đau thắt ngực không ổn định, cơn tăng HA cấp cứu /khẩn cấp, suy gan, Cushing, Basedow…)
- Có biến chứng cấp của ĐTĐ (hạ đường huyết, tăng đường huyết cấp)
- Sốt, nhiễm trùng
- Mang thai, cho con bú
- Tổng phân tích nước tiểu có bất kỳ hồng cầu, bạch cầu, trụ hạt
- Những người không đồng ý làm xét nghiệm albumin niệu sáng sớm 2 lần và creatinin máu nhịn đói
2.3 Các biến số cần thu thập
Đặc điểm cá nhân: tuổi, giới, chỉ số khối cơ thể, vòng bụng, thói quen hút thuốc lá. Thời gian bệnh đái tháo đường. Trị số huyết áp tâm thu và tâm trương. Có dùng thuốc hạ áp ức chế men chuyển hay ức chế thụ thể.
Lấy máu tĩnh mạch thử glucose máu, HbA1c, cholesterol toàn phần, LDL cholesterol, HDL cholesterol, triglyceride, creatinin huyết tương. Tổng phân tích nước tiểu. Tỉ số ACR (Albumin: Creatinin) nước tiểu buổi sáng.
2.4 Phương pháp thu thập số liệu – Tiêu chuẩn chẩn đoán
Phỏng vấn ghi nhận hút thuốc lá (không từng hút, trước đây có hút nhưng đã ngưng trong vòng 3 tháng, hoặc đang hút).
- ĐTĐ: theo tiêu chuẩn của WHO năm 1998 hoặc BN đã được chẩn đoán ĐTĐ týp 2 có hay không đang dùng thuốc hạ đường huyết.
- Đo HA tại phòng khám ít nhất 2 lần cách nhau 10 phút, lấy số trung bình. Tăng huyết áp khi huyết áp tâm thu ≥ 140 mmHg và/hoặc huyết áp tâm trương ≥ 90mmHg, hoặc bệnh nhân được chẩn đoán tăng HA từ trước và đang dùng thuốc hạ áp.
- Đo cân nặng, vòng eo (đặt thước đo ở khoảng giữa xương sườn cuối và mào chậu, đo khi BN đang thở ra).
- Thừa cân /béo phì dựa vào tiêu chuẩn của WHO dành cho Châu Á năm 2000. Cân nặng lý tưởng khi BMI 18.5-22.9 kg/m2, dư cân khi 23-24.9 kg/m2, béo phì khi BMI ≥ 25 kg/m2.
- Béo phì vùng bụng: tiêu chuẩn cho người Đông Nam Á, khi vòng eo > 90 cm ở nam, > 80 cm ở nữ
- Rối loạn lipid máu: theo tiêu chuẩn của ATP III
- Cholesterol toàn phần: ≥ 5.2 mmol/L
- (LDL cholesterol: ≥ 3.4 mmol/L)
- HDL cholesterol: nam ≤ 1 mmol/L, nữ ≤ 1.2 mmol/L
- Triglyceride: ≥ 2.3 mmol/L
- Phân loại mức albumin niệu: ACR 30-299 mg/g là albumin niệu lượng, A/C≥ 300 mg/g là albumin niệu lượng nhiều. Chỉ những giá trị ACR ổn định qua ít nhất 2 lần thử mới đưa vào phân tích
- Creatinin huyết thanh: tại thời điểm nghiên cứu và so sánh với creatinin máu 2-3 tháng trước có ghi nhận trong sổ khám bệnh. Nếu hai trị số creatinin chênh nhau không quá ±10% mới xem là ổn định. Giá trị eGFR tại thời điểm nghiên cứu được đưa vào phân tích. eGFR < 60ml/ph/1.73m2 da được xem là giảm.
- Độ lọc cầu thận ước tính (eGFR) theo công thức MDRD (Modification of Diet in
Renal Disease)
MDRD= 186.3 x [creatinin huyết tương {µmol/L}/ 88.5]-1.154 x tuổi {năm}-0.203
(nếu là nữ, nhân với 0.742).
Các xét nghiệm sinh hóa thực hiện tại phòng xét nghiệm trung tâm BV NTP
- HbA1c được đo bằng phương pháp sắc ký lỏng hiệu năng cao, thuốc thử của Biorad Inc.
- Lipid máu: cholesterol toàn phần, HDL cholesterol, triglyceride bằng phương pháp enzyme so màu máy Olympus (Beckman Coulter, AU 650)
- Albumin niệu được đo bằng phương pháp so màu với máy Olympus (Beckman Coulter, AU 650)
- Đo creatinin huyết thanh và creatinin niệu bằng phương pháp test màu Jaffe máy Olympus
- Tổng phân tích nước tiểu bằng que nhúng dipstick 10 thông số
2.5 Phân tích thống kê
Thống kê mô tả được sử dụng. Để phân tích những khác biệt về đặc điểm BN, dung test cho biến liên tục (tuổi trung bình, huyết áp, A1c, các trị số mỡ máu) và X2 test cho các biến thứ tự (phân nhóm albumin niệu, giai đoạn bệnh thận phân theo eGFR). Tỉ lệ giảm eGFR được tính toán.
Khi xét mối liên hệ giữa các yếu tố nguy cơ với kết cục giảm eGFR, phương pháp hồi qui đa biến được sử dụng.
Các biến số có ý nghĩa thống kê trong phân tích đơn biến và một số yếu tố quan trọng trên lâm sàng liên quan đến kết cục (ví dụ: hút thuốc lá, thời gian bệnh, tăng HA, mức kiểm soát đường huyết) sẽ được đưa vào mô hình đa biến để tìm sự liên quan độc lập với kết cục khi đã kiểm soát các yếu tố còn lại (như giới, tuổi, thời gian bệnh). Các phép kiểm được xem là có ý nghĩa thống kê khi p < 0,05.
3. KẾT QUẢ
3.1 Đặc điểm của dân số nghiên cứu
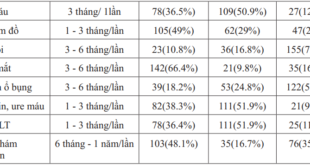
216 người tham gia nghiên cứu gồm 125 nữ 91 nam. Đa số BN là cư dân thành phố Hồ Chí Minh (88,9%).
Tuổi trung bình 58,8 (10,83). Chỉ số khối cơ thể trung bình 23,8 kg/m2 (3,26).
BMI trung bình 23,8 kg/m2. Béo bụng ghi nhận ở 21 nam (27,5%) và 69 nữ (55,2%). Trong các BN nam, có 42 người (46,2%) còn hút thuốc lá trong vòng 3 năm gần đây.
Thời gian bệnh trung bình 7,5 năm. Có 43 BN (19,9%) mắc bệnh dưới 2 năm, 87 BN (40,26%) mắc bệnh ít nhất 10 năm. HbA1c trung bình 8,5% (4,9-15,9).
Chỉ có 76 người (35,2%) có HbA1c ≤ 7,5%. 127 BN (58,8%) tăng huyết áp và hầu hết đều được dùng nhóm UCMC/UCTT (191 BN, 86,6%).
Trị số HA trung bình là 129,1/78,1 mmHg. 60 BN (27,8%) tại thời điểm nghiên cứu không kiểm soát được HA (không đạt < 140/80 mmHg).
Bảng 1. Đặc điểm của dân số nghiên cứu (n=216)

*tính trên nam giới (không có nữ hút thuốc lá)
Có 69 BN (31,9%) tăng cholesterol máu, 23 BN (10,6%) tăng triglyceride, 80 BN (42,1%) có HDL thấp trong đó nam là 48 (38,3%), nữ là 32 (41,7%).
3.2 Biến chứng thận
111 BN (50,9%) có albumin niệu, gồm 68 BN albumin niệu lượng trung bình (31,5%) và 42 BN (19,4%) albumin niệu lượng nhiều. Giá trị trung bình của độ lọc cầu thận ước tính là 73,5 ml/ph/1,73m2 (21,7-128,5). Có 45 BN (20,83%) giảm eGFR, trong đó 30 BN (63,8%) bệnh thận mạn giai đoạn 3a và 17 BN (36,2%) bệnh thận mạn giai đoạn 3b và 4. Không có người bệnh thận giai đoạn cuối.
3.3 Các yếu tố liên quan đến giảm eGFR
Phân tích đơn biến
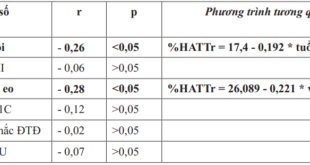
Các yếu tố đi kèm giảm eGFR được trình bày trong bảng 2. Tuổi cao, giới nữ, hút thuốc lá, nữ béo bụng, thời gian bệnh ĐTĐ dài, không kiểm soát tốt đường huyết (HbA1c > 7%), tăng huyết áp (cả hai số), albumin niệu đi kèm với giảm độ lọc cầu thận. Nhưng bất thường lipid máu không khác nhau giữa hai nhóm eGFR.
Bảng 2. Các yếu tố liên quan đến giảm eGFR trong phân tích đơn biến

*chỉ xét trên nam giới; ** ≥ 10 năm, vẫn khác biệt có ý nghĩa thống kê; $: ml/ph/1,73m2
Phân tích đa biến: Kết quả phân tích đa biến các YTNC giảm eGFR được trình bày trong bảng 3. Tuổi, giới nữ, hút thuốc lá, thời gian bệnh ĐTĐ dài, albumin niệu (+) làm tăng nguy cơ giảm eGFR có ý nghĩa.
Bảng 3.Tỉ số số chênh đã điều chỉnh liên quan đến giảm eGFR trong phân tích đa biến

OR của mỗi biến số được điều chỉnh với tất cả các biến khác, có ý nghĩa được ước tính bằng Wald X2 và p. Tuổi, thời gian bệnh (là biến liên tục) được tăng mỗi 1 tuổi hoặc 1 năm mắc bệnh.
Khi xét mô hình không có albumin niệu thì BMI cao đi kèm với giảm eGFR, nhưng
không tăng tỉ số số chênh theo mức tăng BMI (bảng 4). Sau khi điều chỉnh với tuổi, giới, hút thuốc lá, thời gian bệnh, Hb1Ac và huyết áp, thừa cân béo phì đi kèm với giảm eGFR có ý nghĩa.
Bảng 4. Tỉ số số chênh của BMI được điều chỉnh với các yếu tố tuổi, giới, thời gian bệnh, hút thuốc lá, HbA1c và huyết áp (phân tích đa biến).

*Không có ý nghĩa nếu BMI là biến liên tục
4. BÀN LUẬN
Đây là nghiên cứu cắt ngang trên nhóm người ĐTĐ típ 2 có thời gian bệnh trung bình 7,5 năm điều trị ngoại trú tại BV tuyến thành phố, tỉ lệ giảm eGFR 20,83% là khá cao. Tỉ lệ này ước tính còn thấp hơn thực tế bởi những người bệnh thận giai đoạn cuối không đến phòng khám nội tiết. Trong nước, chúng tôi chưa tìm thấy số liệu về giảm eGFR ở người bệnh ĐTĐ. Kết quả này tương đồng với báo cáo của nghiên cứu NHANES IV (1999-2004): trên 1462 BN ĐTĐ típ 2 ≥ 20 tuổi trong đó 15,6% có thời gian bệnh dưới 2 năm và 36,2% mắc bệnh trên 10 năm, tỉ lệ bệnh thận mạn ở giai đoạn là 20% [4]. Kết quả nghiên cứu cũng lặp lại kết quả của nghiên cứu cắt ngang DEMAND thực hiện tại cơ sở y tế của nhiều quốc gia: 11.573 BN ĐTĐ típ 2 có 22,35% eGFR giảm (theo MDRD), trong đó bệnh thận giai đoạn cuối là 0,15% [5]. Khác với các số liệu vừa trình bày, nghiên cứu UKPDS công bố tỉ lệ giảm độ lọc cầu thận thấp hơn: 5032 người ĐTĐ típ 2 sau 7,5 năm mắc ĐTĐ có khoảng 13% BN bị giảm Clcreatinin-Cockroft Gault (trên biểu đồ Kaplan Meier), và sau 15 năm tỉ lệ này là 29%. Một nghiên cứu đoàn hệ cộng đồng thực hiện trên 3667 BN ĐTĐ típ 2 có eGFR ban đầu ≥ 60 mL/ph/1,72m2 mắc bệnh trung bình 7,5 năm (1,3-13,7 năm), theo dõi sau 5 năm, 11% tiến triển đến giảm eGFR [7]; có thể ước đoán tỉ lệ giảm eGFR của nhóm mắc ĐTĐ 7,5 năm không dưới 17%. Những kết quả này gợi ý tỉ lệ giảm eGFR ở người ĐTĐ típ 2 ở các quốc gia có thể không khác nhau nhiều (sau khi điều chỉnh tuổi và thời gian mắc bệnh) dù chủng tộc hay chất lượng điều trị có thay đổi.
Không có sự đồng bộ giữa albumin niệu và giảm độ lọc cầu thận. Trên người giảm eGFR, có đến 18% không có albumin niệu cho thấy giảm eGFR vẫn có thể xuất hiện trước albumin niệu.
Chúng ta không thể dùng albumin niệu để chẩn đoán bệnh thận mạn hoặc để tiên đóan tiến triển của chức năng lọc của 18% này, mà nên xem xét những chỉ điểm lâm sàng khác. Bằng chứng này ủng hộ việc không nên chỉ thử albumin niệu để sàng lọc bệnh thận mạn ở người ĐTĐ. Nghiên cứu UKPDS cũng ghi nhận ngay từ lúc giai đoạn nhận bệnh đã có 61% BN không có albumin niệu và 39% không hề xuất hiện albumin niệu suốt thời gian nghiên cứu. Trong phân tích cắt ngang của NHANES III, 30% BN ĐTĐ típ 2 có suy thận mạn không có tiểu albumin, không bệnh lý võng mạc ĐTĐ [8]. Phân tích dữ liệu của 3431 BN ĐTĐ típ 2 ở một bệnh viện quận, có đến 13,5% BN có eGFR < 60ml/ph/1,73m2 nhưng không có albumin niệu độc lập với tuổi [9]. Nhóm không có albumin niệu vẫn tiếp tục giảm eGFR hàng năm -2,58%, nhóm albumin lượng vừa giảm -3,49% và nhóm albumin niệu lượng nhiều giảm -6,58% [9]. Dù không có albumin niệu, giảm eGFR vẫn là nguy cơ tử vong cho người có hoặc không có bệnh ĐTĐ [10,11].
Nghiên cứu này ghi nhận yếu tố tiên đoán giảm eGFR là tuổi tác, nữ giới, thời gian bệnh dài và albumin niệu. Kết quả này tương đồng với rất nhiều nghiên cứu trước. Dù tỉ lệ nam nữ trong nghiên cứu này gần như nhau, nữ vẫn đi kèm với giảm eGFR trong phân tích đa biến. Trong hai nghiên cứu DEMAND và UKPDS, nam giới có vẻ là yếu tố bảo vệ [5,6]. Những nghiên cứu cộng đồng trước đây cũng ghi nhận giới nữ bị suy giảm chức năng thận nhiều hơn [12-14]. Nghiên cứu UKPDS báo cáo nữ giảm độ thanh thải creatinin nhiều hơn nam rõ rệt [6]. Liệu ở nữ, khi dùng Clcr có thể đã đánh giá thấp độ lọc cầu thận dù đã hiệu chỉnh với giới tính ? Các công thức tính eGFR hiện có cho kết quả đôi chút khác biệt nhất là khi liên quan đến giới tính (như MDRD) và thành phần cơ thể (như Clcreatinin).
Trong nghiên cứu này, dư cân không có liên quan với albumin niệu (số liệu không được trình bày (p= 0,63)) nhưng ảnh hưởng rõ rệt lên giảm eGFR.
Khi điều chỉnh với tuổi, giới, hút thuốc lá, thời gian ĐTĐ theo khuyến cáo của WHO [15] và với tăng HA, thừa cân vẫn còn là yếu tố nguy cơ giảm eGFR trong phân tích đa biến. Afghahi nhận thấy BMI cao và dư cân tiên đoán giảm eGFR-MDRD nhưng BMI thấp lại đi kèm với giảm Clcr-CG [7].
Ngoài ra, trên người không ĐTĐ, BMI > 25kg/m2 cũng đi kèm với tăng nguy cơ tương đối bệnh thận giai đoạn cuối [16]. Vừa béo phì vừa có bệnh thận sẽ thúc đẩy tiến triển nhanh đến suy thận [17,18]. Đã có bằng chứng bệnh thận mạn liên quan đến béo phì: rối loạn chức năng nội mạc, đạm niệu vi lượng, giảm eGFR [19]. Tăng mức lọc cầu thận lâu ngày đưa đến tổn thương và xơ hóa mao mạch cầu thận ở người béo phì [20].
Thời gian bệnh có liên quan mật thiết với sụt giảm eGFR. Mỗi năm mắc bệnh nguy cơ bị sụt giảm eGFR tăng thêm 5% (bảng 3). Một nghiên cứu cộng đồng (n=1253) trên những người tuổi trung bình 68, thời gian bệnh 10,4 năm, được theo dõi 5,3 năm ghi nhận mỗi năm có 3,7% tiến đến bệnh thận rõ rệt [21]. Tốc độ tiến triển từ protein niệu đến tăng gấp đôi creatinin máu/bệnh thận giai đoạn cuối là 2,3%/năm (UKPDS) [22].
Albumin niệu đi kèm với nguy cơ giảm eGFR trong nghiên cứu này phù hợp với rất nhiều nghiên cứu cắt ngang [5], quan sát đoàn hệ [7], ngẫu nhiên có kiểm chứng [6] trước đây.
Những nghiên cứu theo dõi nhiều năm đều khẳng định albumin niệu ban đầu có ảnh hưởng lên diễn tiến của eGFR theo thời gian, thường là giảm nhanh eGFR so với người không có albumin niệu [9,21,23]. Tại Nhật, một nghiên cứu theo dõi những bệnh nhân ĐTĐ típ 2 ngoại trú (n=1303) cho thấy người không có albumin niệu vào lúc tham gia nghiên cứu rất ít tiến triển đến eGFR < 30ml/ph (<0,2%) so với nhóm albumin niệu lượng nhiều (24%) sau 3 năm [24].
Những BN vừa có albumin niệu vừa bệnh võng mạc thì tốc độ giảm eGFR nhanh nhất [25]. Chỉ có một nghiên cứu lẻ trên BN ngoại trú tại một trung tâm (n=301) ghi nhận protein niệu có ảnh hưởng trên giảm isotopic GFR không khác so với nhóm albumin lượng ít (3mL/ph/năm vs 2,8mL/ph/năm) [26].
Nghiên cứu cho thấy tăng HbA1c, tăng HA, tăng triglyceride/cholesterol không tương quan có ý nghĩa với giảm eGFR. Cùng là thiết kế cắt ngang, nghiên cứu DEMAND cũng không ghi nhận tăng HA tâm thu là yếu tố tiên đoán giảm Clcr [5], trong khi nhiều nghiên cứu khác nhấn mạnh mối liên hệ này [6,7,27]. Bất thường lipid máu, nhất là tăng triglyceride thường đi kèm trong bệnh béo phì và đề kháng insulin, góp vai trò quan trọng trong xuất hiện và tiến triển bệnh thận ĐTĐ đã được ghi nhận [7,28]. Nghiên cứu này là cắt ngang lại có cỡ mẫu nhỏ không đủ đánh giá các yếu tố nguy cơ trên (đường huyết, huyết áp, lipid máu); hơn nữa đã được can thiệp chuyên khoa nên hai nhóm không có sự khác biệt rõ ở những đặc điểm này.
5. KẾT LUẬN
Tỉ lệ giảm eGFR ở người bệnh ĐTĐ khá cao tại BV tuyến thành phố, chỉ ra nhu cầu dự phòng ở cộng đồng.
Với những yếu tố liên quan với giảm độ lọc cầu thận đã tìm thấy, chúng ta có thể dễ dàng nhận ra những đối tượng nguy cơ. Hai yếu tố nguy cơ can thiệp được là albumin niệu và thừa cân cần được chú ý trong điều trị dự phòng.
Không thể chỉ dựa vào albumin niệu mà sàng lọc bệnh thận mạn, những chỉ dấu khác như tuổi, thời gian bệnh, eGFR có thể tin cậy hơn. Một số yếu tố nguy cơ giảm eGFR khác như kiểm soát đường huyết, huyết áp, lipid máu cần được khảo sát thêm ở những nghiên cứu dọc lớn.
TÓM TẮT
Đặt vấn đề và mục tiêu: Đái tháo đường (ĐTĐ) là nguyên nhân hàng đầu gây bệnh thận giai đoạn cuối. Tử vong gia tăng đáng kể ở người có độ lọc cầu thận giảm. Chưa được báo cáo đầy đủ về độ lọc cầu thận trên người bệnh ĐTĐ típ 2. Nghiên cứu này khảo sát tỉ lệ giảm độ lọc cầu thận cùng các yếu tố liên quan ở người ĐTĐ típ 2. Phương pháp nghiên cứu: Nghiên cứu mô tả cắt ngang, thực hiện trên 216 người bệnh ĐTĐ típ 2 khám ngoại trú tại bệnh viện Nguyễn Tri Phương. Albumin niệu được xác định khi có ít nhất hai mẫu nước tiểu (trong 3 tháng) có tỉ lệ A/C niệu ≥ 30mg/g. Chẩn đoán giảm độ lọc cầu thận khi độ lọc cầu thận ước tính eGFR- MDRD < 60 ml/phút/1,73 m2da không thay đổi trong 3-6 tháng. Phân tích hồi qui đa biến trên những yếu tố như tuổi, giới, BMI, thời gian bệnh, tăng huyết áp, HbA1c, albumin niệu để đánh giá sự liên quan giữa chúng với nguy cơ giảm eGFR.
Kết quả: 89% đối tượng tham gia nghiên cứu sống tại TPHCM, tuổi trung bình 58,8 ± 10,8, BMI 23,8 ± 3,26 kg/cm2, mắc bệnh ĐTĐ nhiều năm (7,5 ± 6,3 năm), không kiểm soát tốt đường huyết (HbA1c trung bình 8,5 ± 1,9%), huyết áp trung bình 129/78 mmHg (± 13,9/9,5). Có 111 bệnh nhân (50,9%) tiểu albumin, trong đó 42 (19,4%) albumin niệu lượng nhiều; có 45 bệnh nhân (20,8%) giảm eGFR. Các yếu tố liên quan có ý nghĩa với giảm eGFR là lớn tuổi, nữ, nhiều năm mắc đái tháo đường, thừa cân béo phì và albumin niệu.
Kết luận: Nghiên cứu cho thấy tỉ lệ bệnh thận mạn ở người ĐTĐ típ 2 khá cao, 20,8% có giảm eGFR.
Những yếu tố liên quan đến giảm độ lọc cầu thận được tìm thấy là những yếu tố dễ dàng được nhận diện sớm và có thể can thiệp tích cực từ tuyến y tế cơ sở để dự phòng biến chứng thận cho người bệnh đái tháo đường.
TÀI LIỆU THAM KHẢO
- USRDS (2003). The United States Renal Data System. Am J Kidney Dis; 42 (Suppl 5):1-230 Web of Science
- Brancati FL, Whelton PK, Randall BL (1997). Risk of the end-stage renal disease in diabetes mellitus: a prospective cohort study of men screened for MRFIT. Multiple risk factor intervention Trial. JAMA 278:2069-2074
- KDOQI Clinical Practice Guidelines for Chronic Kidney Disease (2012). National Kidney Foundation, Inc. Available online at www.kidney.org/professionals/kdoqi/guidelines_ckd/toc.htm. Truy cập ngày 19/07/ 2013
- Koro CE, Lee BH Bowlin SJ (2009) Antidiabetic medication use and prevalence of chronic kidney disease among patients with type 2 diabetes mellitus in the United States. Clin Ther 31 (11):2608-2617
- Dwyer JP, Parving HH, Hunsicker LG (2012). Renal dysfunction in the presence of normoalbuminuria in type 2 diabetes: Results from the DEMAND Study. Cardiorenal Med 2:1-10
- Retnakaran R, Cull CA, Thorne KI (2006). Risk factors for renal dysfunction in type 2 diabetes. UKPDS 74. Diabetes 55:1832-1839
- Afghahi H, Cederholm J, Eliasson B (2011). Risk factors for the development of albuminuria and renal impairment in type 2 diabetes – the Swedish National Diabetes Register (NDR). Nephrol Dial Transplant 26:1236-1243
- Kramer H, Nguyen Q, Curham G 92003) Renal insufficiency in the absense of albuminuria and retinopathy among adults with type 2 diabetes mellitus. JAMA 289:3273-3277
- Hoefield RA, Kalra PA, Baker PG (2011). The use of eGFR and ACR to predict decline in renal function in people with diabetes. Nephrol Dial Transplant 26(3):887-892
- Nag S, Bilous R, Kelly W (2007) All cause and cardiovascular mortality in diabetic subjects increases significantly with reduced estimated glomerular filtration rate: 10 years’data from the South Tees Diabetes Mortality Study. Diabet Med 24:10-17
- Go AS, Chertow GM, Fan D (2004). Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N Eng J Med 351:1296-1305
- Clase CM, Garg AX, Kiberd BA 92002). Prevalence of low glomerular filtration ratein nondiabetic Americans: Third National Health and Nutrition Exammination Survey (NHANES III) J Am Soc Nephrol 13:1338-1349
- Stevens PE, O’Donoghue DJ, Lusignan S (2007) Chronic kidney disease management in the United Kingdom: NEOERICA project results. Kidney Int 72:92-99;
- Viktorsdottir O, Palsson R, Andresdottir MB (2005). Prevalence of CKD based on estimated glomerular filtration rate and proteinuria in Icelandic adults. Nephrol Dial Transplant 20:1799-1807
- WHO. Report of a WHO Consultation (2000). Obesity: preventing and managing the global epidemic. Who Health Organ Tech Rep Ser 894:1-253
- Hsu CY, McCulloch CE, Iribarren C (2006). Body mass index and risk for end-stage renal disease. Ann Intern Med 14:21-28
- Ejerblad E, Fored CM, Lindblad P (2006). Obesity and risk for chronic renal failure. J Am Soc Nephrol 17:1695-1702
- Praga M, Morales E (2006). Obesity, proteinuria and progression of renal failure. Curr Opin Nephrol Hypertens 15:481-486
- Kambham N. Markowitz GS, Valeri AM (2001). Obesity –related glomerulopathy: an emerging epidemic. Kidney Int 59:1498-1509
- Bosma RJ, Krikken JA, Homan van der Heide (2006). Obesity and renal hemodynamics. Contrib Nephrol 151:184-202
- Bruno G, Merletti F, Biggeri A (2003). Progression to overt nephropathy in type 2 diabetes. The Casale Monferrato Study. Diabetes Care 26 (7):2150-2155.
- Adler AI, Stevens RJ, Manley SE (2003). Development and progression of nephropathy in type 2 diabetes: The UKPDS 64. Kidney Int 63:225-232
- Yokoyama H, Kanno S, Takahashi S (2011). Risk for glomerular filtration rate decline in association with progression of albuminuria in type 2 diabetes. Nephrol Dial Transplant 26(3):2924-2930
- Viberti GC, Hill RD, Jarrett RJ, Argyropoulos A, Mahmud U, Keen H. Microalbuminuria as a predictor of clinical nephropathy in insulin-dependent diabetes mellitus. Lancet 1982;1:1430-1432
- Moriya T, Tanaka S, Kawasaki R (2013) Diabetic retinopathy and microalbuminuria can predict macroalbuminuria and renal function decline in Japanese type 2 diabetic patients (Japan Diabetes complications study). Diab Care 36:2803-2809
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam