I. TÓM TẮT
COVID-19 ảnh hưởng đến mọi nơi trên thế giới và vẫn là một thách thức đối với loài người. Virus SARS-CoV-2 được chứng minh là ảnh hưởng đến nhiều cơ quan và hệ thống bao gồm cả tuyến giáp vì những cơ quan này này biểu hiện nhiều protein enzym chuyển đổi angiotensin 2 (ACE2), có chức năng như một thụ thể cho sự xâm nhập của virus vào các tế bào. Hơn nữa, một số nhóm dân số bao gồm người lớn tuổi và những người có bệnh đi kèm dễ bị tổn thương hơn bởi COVID-19 và các biến chứng của nó. Các báo cáo gần đây cho thấy nhiễm SARS-CoV-2 có thể gây ra bệnh Graves (cường giáp tự miễn) ở những bệnh nhân hậu nhiễm COVID-19. Các yếu tố có thể làm tăng nguy cơ tử vong của bệnh nhân COVID-19 vẫn chưa được biết hoàn toàn và nhận thức rõ ràng về nhóm người dễ bị tổn thương cũng là điều cần thiết. Bài tổng quan này tóm tắt ngắn gọn các đặc điểm của bệnh Graves như các triệu chứng, các yếu tố nguy cơ, bao gồm các yếu tố môi trường, di truyền, miễn dịch và các yếu tố khác, các rối loạn liên quan và các lựa chọn điều trị. Nó mô tả toàn diện những tiến bộ gần đây trong bệnh Graves do SARS-CoV-2 gây ra và vai trò quan trọng của các yếu tố tự miễn trong việc gây ra bệnh. Bài tổng quan cũng thảo luận về những rủi ro có thể có của nhiễm SARS-CoV-2 và COVID-19 liên quan ở những người bị cường giáp. Hơn nữa, nó giải thích bệnh tuyến giáp và mối liên quan của nó với mức độ nghiêm trọng của COVID-19.
II. GIỚI THIỆU
COVID-19 là một hội chứng hô hấp cấp tính nghiêm trọng do virus SARS-CoV-2 gây ra. Trên toàn cầu, căn bệnh này đã nổi lên như một đại dịch và tính đến ngày 11 tháng 5 năm 2021, ~ 159.727.874 người bị ảnh hưởng và 3.319.141 người đã không thể chống chọi lại căn bệnh này trong khi phần lớn trong số họ đến từ Bắc Mỹ, Châu Âu và Ấn Độ mặc dù dịch bệnh bắt đầu từ Trung Quốc . Tỷ lệ tử vong chung của những người nhiễm COVID-19 dao động từ ~ 0,07–9,3%. Hơn nữa, cả tỷ lệ lây nhiễm và tử vong dự kiến sẽ tăng lên tỷ lệ thuận khi dịch bệnh lây lan nhanh chóng trên các lục địa khác nhau, và việc không ngăn chặn được virus có thể dẫn đến nhiều tác động tiêu cực hơn dự kiến.
Đáng chú ý, những bệnh nhân có các bệnh đi kèm từ trước được chứng minh là mắc bệnh ở mức độ nặng hơn và dễ dẫn đến tử vong. Nhiều bệnh lý đi kèm liên quan đến cơ quan quan trọng bao gồm đái tháo đường, tăng huyết áp, bệnh tim và bệnh phổi mãn tính đã được báo cáo có liên quan đến tử vong do COVID-19. Một nghiên cứu gần đây đã phân tích 1590 trường hợp COVID-19 và phát hiện ra rằng các đối tượng mắc bệnh đi kèm có kết quả lâm sàng kém hơn so với nhóm đối chứng. Tiên lượng xấu của COVID-19 được quan sát thấy khi tuổi càng cao kết hợp với bệnh nặng.
SARS-CoV-2 khai thác ACE2 giống như một thụ thể cho sự xâm nhập ban đầu của nó. Biểu hiện ACE2 đã được chứng minh là hiện diện cao hơn trong các tế bào biểu mô của phổi, tim, thận, mạch máu, ruột non, tinh hoàn, mô mỡ và tuyến giáp. Có khả năng tuyến giáp bị ảnh hưởng bởi virus vì các tế bào tuyến giáp biểu hiện phổ biến protein ACE2 (Hình 1). Một nghiên cứu hồi cứu và đơn trung tâm đã đánh giá các chức năng tuyến giáp và mức IL-6 trong 287 trường hợp COVID-19 được nhận vào các đơn vị chăm sóc không tích cực (NICU) và kết quả cho thấy COVID-19 có thể tương quan đáng kể với nguy cơ nhiễm độc giáp cao do sự kích hoạt hệ thống miễn dịch thường gây ra bởi nhiễm virus SARS-CoV-2. Các báo cáo gần đây cho thấy SARS-CoV-2 có thể ảnh hưởng đến tuyến giáp và gây ra bệnh Graves, một bệnh cường giáp tự miễn trong các trường hợp sau COVID-19.
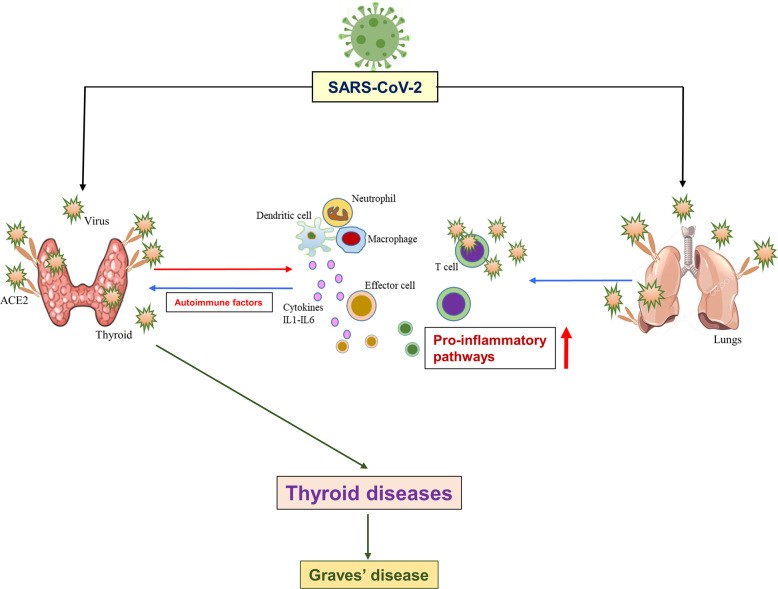
Hình 1: SARS-CoV-2 và tuyến giáp. Sơ đồ cho thấy các con đường có thể nhiễm trùng tuyến giáp. Protein thụ thể virus, ACE2 được biểu hiện nhiều ở tuyến giáp tương tự như các cơ quan khác bao gồm cả vòm họng và phổi, tạo điều kiện cho sự lây nhiễm virus. Nhiễm trùng ở các cơ quan khác cũng có thể truyền virus và / hoặc các tế bào miễn dịch tấn công tuyến giáp
III. BỆNH GRAVES: TÓM TẮT NHỮNG ĐIỀU CƠ BẢN
Hormone tuyến giáp rất quan trọng trong sự điều hòa quá trình trao đổi chất của tế bào, nhịp tim, nhiệt độ cơ thể, huyết áp và nhiều quá trình sinh lý quan trọng khác. Bệnh Graves –– một rối loạn liên quan đến tự miễn ảnh hưởng đến tuyến giáp, đây là cách giải thích phổ biến nhất cho bệnh cường giáp. Điều này ảnh hưởng chủ yếu đến nữ giới hơn nam giới với tỷ lệ 5–10: 1 và đạt đỉnh điểm ở độ tuổi trung niên mặc dù nó cũng có thể ảnh hưởng đến các nhóm tuổi thấp hơn (trẻ em và thanh thiếu niên). Mặc dù tỷ lệ phổ biến của cường giáp là ~ 2–3% trong dân số nói chung, nhưng tỷ lệ này đang tăng nhanh ở phụ nữ trong khi tỷ lệ hiện mắc là ~ 5% ở phụ nữ lớn tuổi. Tình trạng cường giáp thường thấy ở những người hút thuốc. Trong số các nguyên nhân khác nhau của cường giáp, u tuyến độc tuyến giáp và bệnh Graves thường được phát hiện tương ứng ở phụ nữ lớn tuổi và trẻ hơn.
Bệnh Graves chủ yếu được đặc trưng bởi bướu cổ lan tỏa và tăng tiết hormone tuyến giáp. Các triệu chứng phát triển dần dần và chủ yếu bao gồm giảm cân ngoài ý muốn, không dung nạp nhiệt độ, yếu cơ, mất ngủ, nhịp tim nhanh, tăng tiết mồ hôi, khó chịu, bồn chồn, hồi hộp/lo lắng và mệt mỏi. Ngoài ra, những bệnh nhân mắc bệnh này có thể có các triệu chứng như móng tay giòn, rụng tóc, tăng phản xạ, tăng cảm giác thèm ăn, tăng nhu động ruột, chu kỳ kinh nguyệt không đều ở nữ và rối loạn cương dương ở nam. Bệnh Graves đôi khi liên quan đến việc lồi nhãn cầu ra khỏi hốc mắt, được gọi là bệnh mắt Graves. Hiếm gặp hơn, bệnh Graves phát triển các tổn thương da làm da dày, cứng đỏ gọi là phù niêm trước xương chày. Bệnh Graves có thể gây suy tim sung huyết và loãng xương.
Mặc dù bệnh Graves là một bệnh liên quan đến tự miễn, nhiều thành phần khác bao gồm các yếu tố môi trường, di truyền và miễn dịch học cũng có thể góp phần đáng kể vào bệnh nguyên của căn bệnh này (Bảng 1). Bệnh Graves thường liên quan đến hiệu giá cao của các globulin miễn dịch kích thích tuyến giáp, kích hoạt thụ thể TSH theo cách tương tự như chính TSH (Bảng 2). Nó thường được điều trị bằng các loại thuốc kháng giáp (Antithyroid Drugs: ATDs) như Thionamid, Iod phóng xạ, hoặc cắt bỏ tuyến giáp tùy thuộc vào một số yếu tố bao gồm tuổi của bệnh nhân và mức độ bệnh. Methimazole là ATD được sử dụng phổ biến nhất để điều trị tình trạng này, được Hiệp hội Tuyến giáp Hoa Kỳ (ATA) và Hiệp hội Nội tiết Lâm sàng Hoa Kỳ (AACE) chấp thuận như là liệu pháp đầu tay, đặc biệt là ở bệnh nhân trẻ (<18 tuổi), trong khi Propylthiouracil được sử dụng trong những trường hợp đặc biệt, đặc biệt là trong trường hợp thai non tháng và bệnh nhân xuất hiện tình trạng cơn bão giáp. Iod phóng xạ được sử dụng phổ biến nhất để điều trị bệnh Graves ở Mỹ. Phẫu thuật (cắt tuyến giáp) được sử dụng như một liệu pháp dứt điểm để loại bỏ một phần hoặc toàn bộ tuyến giáp, thường có thể dẫn đến suy giáp và cần bổ sung hormone tuyến giáp suốt đời. Thuốc chẹn beta (Propranolol) được kê đơn để ngăn chặn hormone được tiết ra sớm hơn trong máu và liệu pháp sẽ không được rút lại khi hormone tuyến giáp đạt trong giới hạn bình thường. Theo các hướng dẫn hiện có, đối với bệnh nhân được điều trị với ATD, một khi đã đạt trạng thái bình giáp, sẽ được điều trị được tiếp tục trong 12–18 tháng với bệnh nhân và chắc chắn rằng bệnh nhân vẫn ở trạng thái tuyến giáp trước khi ngừng điều trị. Corticosteroid, Prednisone được sử dụng để điều trị các trường hợp bệnh mắt Graves nặng để giảm viêm mô quanh mắt.
Bảng 1: Các yếu tố liên quan đến bệnh Graves
|
Yếu tố môi trường |
Yếu tố di truyền | Yếu tố miễn dịch học |
Những yếu tố khác |
| Hút thuốc lá
Tiếp xúc với bức xạ Tiếp xúc trực tiếp với etanol (tiêm) Điều trị bằng thuốc ức chế điểm kiểm tra miễn dịch (Immune – checkpoint) Iod Điều trị với IL-1α, IL-2, IFN α và γ Sử dụng thuốc điều trị HIV Sử dụng alemtuzumab |
CTLA-4 CD-40 HLA Class-II Gene TG Gen TSHR |
Kích hoạt tế bào T bằng các kích thích đa dòng
Phản ứng chéo với các kháng nguyên tuyến giáp và môi trường Biểu hiện HLA-DR không thích hợp Di truyền HLA , CTLA-4 và các gene đáp ứng miễn dịch khác Các dòng tế bào T hoặc B bị đột biến Sự tồn tại của một số tế bào T và tế bào B tự hoạt động Kích thích tuyến giáp bằng các cytokine Tái tiếp xúc với các kháng nguyên do tổn thương tế bào tuyến giáp Tế bào T điều hòa giảm hoặc rối loan chức năng |
Giới tính nữ
Chấn thương tâm thần Tăng động giao cảm TSH Giảm cân |
IL interleukin, IFN interferon, HIV human immunodeficiency virus, CTLA-4 cytotoxic T-lymphocyte associated protein 4-A, CD40 cluster of differentiation 40, HLA human leukocyte antigen, TG thyroglobulin, TSHR thyroid stimulating hormone receptor, T cell T lymphocytes, B cell B lymphocytes, TSH thyroid stimulating hormone
Bảng 2: Các kháng thể liên quan bệnh Graves
|
Kháng thể |
Mức độ biểu hiện |
|
TSAb |
Cao |
|
TSBAb |
Cao |
|
TBII |
Hiếm khi tăng cao |
|
Anti-TPOAb |
Tăng (80%) |
|
Anti-TGAb |
Tăng (50%) |
|
Các kháng thể phản ứng với chất hỗ trợ Iod |
Có thể phát hiện |
|
Các kháng thể liên kết với protein pendrin có tác dụng hỗ trợ Iod |
Có thể phát hiện |
|
Các kháng thể nhận biết các thành phần của cơ ở mắt và / hoặc nguyên bào sợi |
Có thể phát hiện |
|
Kháng thể DNA |
Có thể phát hiện (hiệu giá thấp) |
|
Các kháng thể phản ứng với tế bào thành (dạ day) |
Có thể phát hiện (không thường xuyên) |
| Các kháng thể liên kết với tiểu cầu |
Có thể phát hiện |
TSAb thyroid stimulating antibody, TSBAb TSH-stimulation blocking antibody, TBII thyrotropin-binding inhibitory immunoglobulin, anti-TPO antibody anti-thyroid peroxidase antibody, anti-TGAb anti-thyroglobulin antibody, DNA deoxyribonucleic acid
IV. SARS-CoV-2 GÂY RA BỆNH GRAVES
Gần đây, một nghiên cứu đã công bố hai bệnh nhân mắc bệnh Graves có liên quan đến COVID-19. Các trường hợp khác sau đó đã được báo cáo. Tính đến ngày hôm nay, năm trường hợp mắc bệnh Graves do nhiễm SARS-CoV-2 đã được mô tả bởi ba nhóm nghiên cứu độc lập, trong đó hai nhóm từ Tây Ban Nha và một từ Hoa Kỳ. Tất cả các trường hợp cường giáp này đều được chẩn đoán ở phụ nữ ít nhất 30–60 ngày kể từ ngày khởi đầu COVID-19. Tất cả những bệnh nhân này đều trong độ tuổi từ 21–61. Trong 5 trường hợp, có 3 trường hợp có biểu hiện rối loạn tuyến giáp trước đó (bệnh Graves) và tất cả các đợt đều được điều trị bằng thuốc kháng giáp (ATD). Một trường hợp có tiền sử bệnh mắt Graves trước đó đã được báo cáo điều trị bằng glucocorticoid trong 3 tháng và cô ấy đã trở về chức năng tuyến giáp bình thường cho đến khi bắt đầu mắc COVID-19. Tuy nhiên, tất cả các trường hợp đều được điều trị thích hợp và thuyên giảm trong nhiều năm, và lượng hormone tuyến giáp trong giới hạn bình thường trong những lần khám trước đó. Để chẩn đoán COVID-19, tất cả các trường hợp được báo cáo là đã được kiểm tra bằng realtime PCR (RT-PCR). Mặc dù ban đầu hai trường hợp không dương tính nhưng sau 4 ngày, siêu âm phổi kiểm tra phát hiện viêm phổi kẽ phù hợp với dương tính COVID-19 trong một trường hợp. Ngoài ra, các kháng thể IgM và IgG đối với SARS-CoV-2 cũng được thử nghiệm cho kết quả dương tính trên cùng một bệnh nhân. Trường hợp còn lại được xác nhận là dương tính với COVID-19 sau đó do IgG dương tính và viêm phổi hai bên.
Tất cả các bệnh nhân thường bị đánh trống ngực. Ngoài triệu chứng này, hai trường hợp có biểu hiện hồi hộp, một trường hợp có biểu hiện mệt mỏi và một trường hợp khác phát triển chứng run. Phân tích các hormone tuyến giáp được xác định là giảm hormone TSH trong huyết thanh, tăng Triiodothyronine (FT3) và Thyroxine (FT4). Ngoài ra, kháng thể-thụ thể hormone kích thích kháng giáp (anti-TSHR-Ab), Thyroperoxidase (TPOAb), và kháng thể Thyroglobulin (TgAb) được phát hiện là dương tính. Sự hấp thu Iod được tăng lên với sự hấp thu chất đánh dấu phóng xạ đồng nhất với khoảng 30–61% sau 2 giờ và 45,7–62% vào 24 giờ sau khi dùng 131I (100 μCi). Siêu âm tuyến giáp cho thấy sự tăng sinh của nhu mô tuyến giáp. Tất cả các hồ sơ lâm sàng đã được đánh giá của bệnh nhân, sự hấp thu Iod của tuyến giáp tăng cường và TSHR-Ab dương tính đều cho thấy bệnh nhân mắc bệnh Graves. Tất cả các bệnh nhân được điều trị với liều lượng từ 10–40 mg Methimazole (MMI) hàng ngày trong ba tháng. Bệnh nhân đạt đến tình trạng bình giáp ba tháng sau đó và tiếp tục dùng thuốc hàng ngày với liều 5 mg MMI và bệnh mắt không xấu đi. Trong hai trường hợp, propranolol đã được chứng minh là kết hợp với MMI có thể giúp cải thiện cả các triệu chứng và chức năng tuyến giáp (Bảng 3).
Bảng 3: Đặc điểm lâm sàng của bệnh nhân mắc bệnh Graves do SARS-CoV-2
|
Đặc điểm lâm sàng # |
Case #1 | Case #2 | Case #3 | Case #4 | Case #5 |
Giá trị bình thường |
|
Dân tộc |
Tây ban nha | Tây ban nha | Tây ban nha | Tây ban nha | Hoa Kỳ | |
|
Tuổi |
60 |
53 |
45 |
61 |
21 |
|
| Giới tính | Nữ | Nữ | Nữ | Nữ |
Nữ |
|
| Các triệu chứng | Đánh trống ngực
Lo lắng Mệt mỏi |
Suy nhược
Run Đánh trống ngực |
Đánh trống ngực
Lo lắng |
Đánh trống ngực | Nhịp tim nhanh
Đánh trống ngực Lo lắng Khó thở |
|
|
Tiền sử trước đây |
Có, bệnh Graves ở tuổi 23 và thuyên giảm kể từ khi 25 tuổi |
Không |
Có, bệnh Graves. Hai đợt cường giáp.
Năm 2008 (ATD trong 22 tháng) – tái phát Trong năm 2015 (ATD trong 25 tháng) – tái phát. Vào năm 2018 bệnh mắt của Graves (Corticosteroid trong 3 tháng). Bình thường trước khi nhiễm SARS-CoV-2. |
Có, bệnh Graves. Hai đợt.
Năm 2004 (điều trị bằng ATD) – tái phát. Năm 2014 (điều trị bằng ATD) – tái phát. Bình thường kể từ năm 2016. |
Không. Mẹ có tiền sử suy giáp. | |
|
Chẩn đoán sau khi khởi phát COVID-19 |
> 1 tháng |
> 2 tháng | > 1 tháng | 1 tháng |
<1 tháng |
|
|
TSH |
<0,01 mIU / mL |
<0,01 mIU / mL | <0,005 µIU / mL | <0,001 µIU / mL | <0,01 µIU / mL |
0,3–5 mIU / mL |
|
FT3 |
7,93 pmol / L |
Không được thực hiện | Không được thực hiện | Không được thực hiện | 15,2 pg / mL |
2,63–5,7 pmol / L |
|
FT4 |
16 pmol / L |
36,5 pmol / L | > 7,7 ng / dL | 2,66 ng / dL | 3,8 ng / dL |
9–19 pmol / L |
|
Anti-TSHr Ab |
2,13 IU / L |
6,07 IU / L | 28,7 mIU / mL | 1,31 IU / L | 17 IU / L |
<1,75 IU / L |
|
Thyroperoxidase Ab |
1343 IU / mL |
3239 IU / mL | Không được thực hiện | Không được thực hiện | Không được thực hiện |
<100 IU / mL |
|
Thyroglobulin Ab |
199 IU / mL |
1617 IU / mL | Không được thực hiện | Không được thực hiện | Không được thực hiện |
<138 IU / mL |
| Hấp thu Iod của tuyến giáp (2 giờ và 24 giờ) * |
30% & 45,7% |
61% & 62% | Không được thực hiện | Cao |
Không được thực hiện |
|
|
Điều trị |
Thiamazole và Propranolol | Thiamazole và Propranolol | Methimazole (MMI) 40 mg / ngày. Cải thiện trong 3 tháng. Kê đơn 5 mg / ngày trong thời gian theo dõi. | Methimazole (MMI) 10 mg / ngày.
Cải thiện trong 3 tháng. Kê đơn 5 mg / ngày trong thời gian theo dõi. |
Methimazole (MMI) 30 mg / ngày.
Thuốc chẹn beta hai lần mỗi ngày và cải thiện trong 3 tháng. Tiếp tục với Thionamide và ngừng sử dụng thuốc chẹn beta. |
|
|
Tài liệu tham khảo |
Mateu-Salat et al. 2020 [ 6 ]. |
Mateu-Salat et al. 2020 [ 6 ]. | Jiménez-Blanco et al. 2021 [ 7 ]. | Jiménez-Blanco et al. 2021 [ 7 ]. |
Harris et al. 2021 [ 12 ]. |
F female, FT3 free triiodothyroinine, FT4 free thyroxine, TSH thyroid-stimulating hormone, Anti-TSHR Ab anti-thyroid stimulating hormone receptor antibody, ATD anti-thyroid drug, Ab antibody. *, sau khi sử dụng 100 μCi iốt ( 131 I), #, các giá trị được đưa ra như vậy từ các bài công bố
V. BỆNH GRAVES DO SARS-CoV-2 GÂY RA: VAI TRÒ QUAN TRỌNG CỦA CÁC YẾU TỐ MIỄN DỊCH
Bệnh Graves thường gây ra cường giáp, đặc biệt là ở phụ nữ tuổi trung niên. Trong số 5 trường hợp mắc bệnh Graves liên quan đến COVID-19, có 3 bệnh nhân có tiền sử bệnh Graves trong quá khứ, bệnh thuyên giảm trong nhiều năm và cho biết vẫn duy trì chức năng tuyến giáp bình thường cho đến khi mắc bệnh nhiễm trùng. Ngoài ra, stress cũng có liên quan đến sự tái phát của bệnh Graves. Hơn nữa, nhiều bệnh nhiễm trùng do virus đã được coi là các yếu tố môi trường và được báo cáo là đóng vai trò trung tâm trong cơ chế bệnh sinh của các rối loạn tuyến giáp liên quan đến tự miễn. Do đó, 5 trường hợp được trình bày đồng thời cho thấy nhiễm SARS-CoV-2 có thể gây ra bệnh Graves. Nhiều bệnh tự miễn do COVID-19 gây ra bao gồm thiếu máu tan máu tự miễn, hội chứng Guillain – Barré và ban xuất huyết giảm tiểu cầu tự miễn đã được báo cáo trong năm qua, đặc biệt kể từ khi bùng phát SARS-CoV-2 vào tháng 12 năm 2019. Ngoài ra, nhiều trường hợp viêm tuyến giáp bán cấp. đã được báo cáo gần đây. Kết quả nghiên cứu nhanh chóng về các bệnh tự miễn liên quan đến COVID-19 cho thấy virus SARS-CoV-2 có thể đóng một vai trò như một nguyên nhân gây ra bệnh tự miễn tiềm ẩn hoặc mới khởi phát. Như thường thấy ở các rối loạn tự miễn dịch khác, tình trạng tăng viêm liên quan đến nhiễm SARS-CoV-2 có khả năng gây ra dòng thác miễn dịch kích hoạt/tái kích hoạt bệnh Graves. Các nghiên cứu trước đây đã phát hiện mức IL-6 tăng lên trong bệnh Graves. Tương tự, dòng thác siêu viêm liên quan đến SARS-CoV-2 cũng được tìm thấy được điều hòa đặc biệt bởi các tế bào T trợ giúp type 1 (Th1) và IL-6. Ngược lại, cơ chế bệnh sinh của bệnh Graves có thể được chứng minh là qua trung gian phản ứng tự miễn dịch của Th2. Có thể hình dung rằng các cytokine có thể thực hiện nhiều hiệu ứng tín hiệu phức tạp khi liên kết với các thụ thể của chúng trong tế bào. Sự hiểu biết gần đây về các chức năng quan trọng của các tế bào lympho T mới (Th17 và Th22) và các cytokine của chúng trong cơ chế bệnh sinh bệnh tuyến giáp tự miễn (Autoimmune Thyroid Disease: AITD) cho thấy sự quan trọng phải xem xét lại vai trò Th1 và Th2 trong sinh lý bệnh của không chỉ bệnh Graves mà còn cả Hashimoto viêm tuyến giáp.
Ban đầu, biểu hiện kiểu hình của sự tự miễn tuyến giáp được cho rằng là sự cân bằng giữa các đáp ứng miễn dịch của Th1 và Th2. Đáp ứng miễn dịch chủ yếu qua trung gian Th1 có khả năng kích hoạt các con đường chết theo chương trình trong các tế bào nang tuyến giáp có thể dẫn đến phá hủy các tế bào tuyến giáp. Mặt khác, hoạt động miễn dịch qua trung gian Th2 có khả năng kích hoạt các tế bào lympho B đặc hiệu với kháng nguyên để tạo ra TSHR-Abs dẫn đến tăng sinh tế bào tuyến giáp và tăng hoạt động của tuyến giáp. Ví dụ, trong một số trường hợp, stress đã được báo cáo làm thay đổi sự cân bằng Th1 và Th2 sang Th2 có lợi cho sự phát triển của bệnh Graves, trong khi việc giảm stress / ức chế miễn dịch đảo ngược tác động đối với Th1 dẫn đến viêm tuyến giáp tự miễn sau sinh. Tế bào T đã được chứng minh là có khả năng duy trì tình trạng viêm mãn tính trong bệnh Graves vì tế bào Th1 và Th2 được phát hiện trong vùng thâm nhiễm nội giáp và phản ứng dễ dàng với cả peptit TSHR và kháng nguyên TSHR. Các gen thụ thể tế bào T (TCR) đã được phát hiện trong tế bào T, chúng xâm nhập vào tuyến giáp trong bệnh Graves, phản ánh sự nhân lên vô tính và nó cho thấy bản chất cơ bản của phản ứng tế bào T trong quá trình này. Một số khác biệt cũng được tìm thấy trong việc sử dụng TCR cụ thể ở một số bệnh nhân vì tế bào T có thể xác định TSHR, chỉ khi các phân tử MHC ở đúng bối cảnh.
Hơn nữa, tế bào T CD4 + điều hòa (Tregs) ức chế các tế bào T tác động, và bất kỳ sự thiếu hụt nào trong Tregs đều dẫn đến sự phát triển của tự miễn. Sự biểu hiện của chuỗi α của thụ thể IL-2 (CD25), chủ yếu là trên bề mặt tế bào (CD4 + T) và yếu tố phiên mã FoxP3 là cực kỳ quan trọng đối với sự tiến hóa và duy trì chức năng Treg. Người ta nhận thấy rằng các tế bào T CD4 + non có thể biệt hóa thành Th1, Th2, Th17 và Tregs, và nó hoàn toàn phụ thuộc vào cytokine milieu. Các nghiên cứu về dòng tế bào và mô hình động vật đã xác định rằng tế bào T CD4 + biểu hiện sự phân cực của một số cytokine chủ yếu về phía các tế bào Th17, nơi sản xuất ra cytokine, IL-17. Các nghiên cứu này cũng cho thấy IL-12, IL-4, yếu tố tăng trưởng chuyển dạng-β (TGF-β), và IL-6 + TGF-β nghiêng về các tế bào Th1, Th2, Tregs và Th17, tương ứng. Bên cạnh đó, thay vì sự khác biệt của hoạt động Treg, Th17, hoặc Th1 được cho là nguyên nhân dẫn đến sự phát triển và tiến triển của bệnh tự miễn.
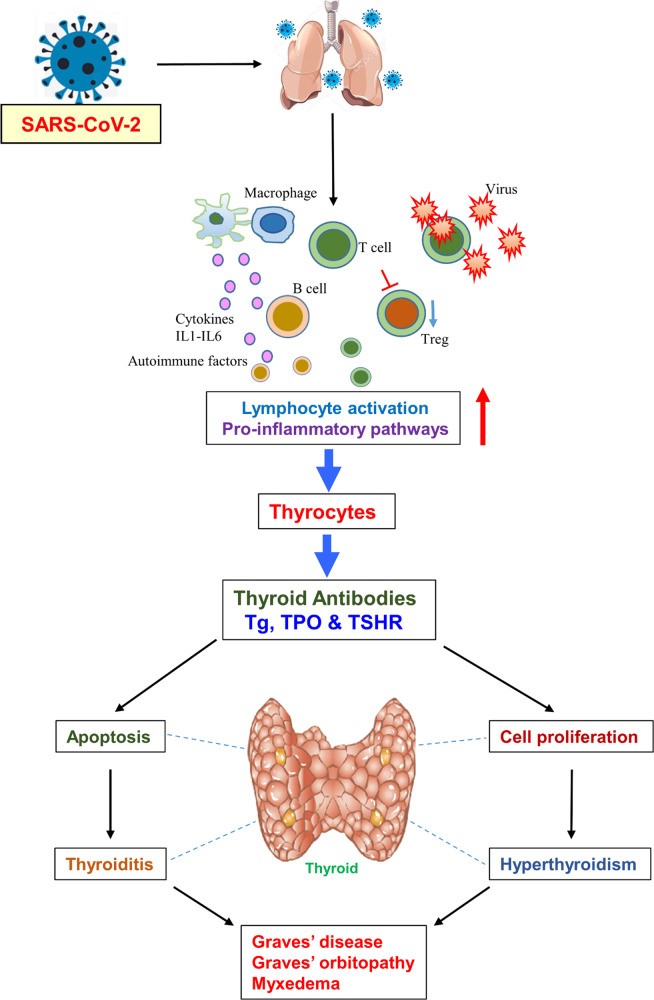
Sự phát triển của bệnh Graves đã được ghi nhận ở 1 bệnh nhân được cấy ghép tế bào gốc tự thân chọn lọc CD34 + và hai trường hợp khác mắc bệnh Graves trong số 25 trường hợp được cấy tế bào gốc tạo máu tự thân cho thấy tầm quan trọng của tế bào Th17 trong bệnh Graves. Đáng chú ý, mức độ gia tăng của các cytokine IL-6 và TGF-β đã được phát hiện trước khi nồng độ Th17 tăng cao trong những trường hợp đó phản ánh rằng việc mồi các tế bào này (tế bào gốc tự thân) bằng IL-6 và TGF-β là cần thiết để kích hoạt các tế bào Th17 gây bệnh và sự tiến hóa liên tiếp của các tế bào B đặc hiệu TSHR tự hoạt động (Hình 2). Một nghiên cứu hiện tại đã chứng minh rằng tình trạng siêu viêm liên quan đến nhiễm SARS-CoV-2 có thể gây ra Th17. Những kết quả này cho thấy bệnh Graves do virus gây ra có khả năng là qua trung gian Th17. Tuy nhiên, cần tiến hành các nghiên cứu sâu hơn để khẳng định kết luận này.
VI. BỆNH NHÂN CƯỜNG GIÁP CÓ DỄ BỊ NHIỄM SARS-CoV-2 KHÔNG?
Hệ thống renin-angiotensin-aldosterone (RAAS) đã được báo cáo là được kích hoạt trong bệnh cường giáp và có thể làm tăng chức năng renin ở tim và nồng độ angiotensin II (Ang II). Bên cạnh đó, thụ thể angiotensin II ở tim loại 2 (thụ thể AT2) được chứng minh là được điều hòa để đáp ứng với cường giáp, cho thấy rằng có sự thay đổi các phân tử chính của hệ RAAS trong bệnh cường giáp. Sử dụng men chuyển (ACE) hoặc thuốc ức chế thụ thể angiotensin II loại 1 (thụ thể AT1) được chứng minh là làm giảm RAAS trong tăng sinh tế bào tim do hormone tuyến giáp tăng cường và cho thấy RAAS đóng vai trò quan trọng trong phì đại cơ tim qua trung gian hormone tuyến giáp.
Hơn nữa, nó đã được chứng minh rằng yếu tố tự điều hòa gây ra phì đại có thể làm tăng cường ACE. Nồng độ Angiotensin 1-7 trong huyết tương không bị thay đổi do cường giáp, tuy nhiên, lượng Angiotensin 1-7 trong tim tăng cao trong bệnh phì đại tim do hormone tuyến giáp kích hoạt. Ngoài ra, hoạt động enzym tăng cường đáng kể của ACE2 đã được phát hiện trong tim của động vật cường giáp có thể là lý do làm tăng Ang 1-7. Một cách nhất quán, mức Ang 1-7 trong tim gia tăng được chứng minh là có liên hệ với sự gia tăng protein thụ thể Mas. Những kết quả này phản ánh rằng các thành phần chống điều hòa của RAAS tăng nhanh trong bệnh cường giáp có thể góp phần điều hòa sự phì đại của tim để đáp ứng với hormone tuyến giáp.
Vai trò của ACE2 trong mối liên hệ giữa phì đại cơ tim và COVID-19 là hợp lý. ACE2 bao gồm miền peptidase (PD) và miền giống Collectrin (CLD) kết thúc bằng chuỗi xoắn xuyên màng có một phần tế bào (~ 40 gốc) tương ứng ở đầu N và đầu C. ACE2 khu trú nhiều trong các tế bào biểu mô của phổi, tim, thận, mạch máu, ruột non, tinh hoàn, mô mỡ và tuyến giáp, và nó kiểm soát sự co mạch và huyết áp. Miền peptidase của enzyme ACE2 xúc tác Ang II thành một phân tử nhỏ hơn là Ang 1–7, và ở một mức độ nào đó Ang I thành Ang 1–9 và sau đó được chuyển hóa bởi một số enzyme khác nhau thành Ang 1–7. Ngoài ra, ACE2 / Ang 1–7 đóng vai trò chủ chốt trong việc chống viêm và chống oxy hóa để bảo vệ phổi chống lại hội chứng suy hô hấp cấp (ARDS). Biểu hiện ACE2 tăng lên ở bệnh nhân cường giáp có thể do phì đại tim và do đó điều này có thể giải thích sự gia tăng khuynh hướng tổn thương phổi nghiêm trọng và ARDS ở những người bị COVID-19 và cường giáp.
Sự biểu hiện quá mức của ACE2 có tác dụng bất lợi đối với bệnh nhân COVID-19. SARS-CoV-2 sử dụng ACE2 để xâm nhập vào các tế bào phổi của vật chủ dưới dạng gai protein (S) SARS-CoV-2 trên phần bên ngoài virion liên kết trực tiếp với PD của ACE2. Điều quan trọng, khi bệnh nhân cường giáp phì đại / tăng huyết áp được điều trị bằng thuốc ức chế men chuyển (ACEi) hoặc thuốc chẹn thụ thể Ang II (ARB) và sử dụng thuốc kích thích ACE2, biểu hiện ACE2 tăng lên đáng kể ở những bệnh nhân đó để đối trọng với mức tăng của Ang-I và Ang-II vì phản ứng thích nghi. Hơn nữa, các loại thuốc khác nhau bao gồm Pioglitazone, Ibuprofen và Liraglutide cũng được báo cáo là có tác dụng điều hòa ACE2 ở động vật. Do đó, ACE2 tăng cao sẽ tạo điều kiện cho SARS-CoV-2 xâm nhập vào tế bào phổi. Nhất trí với ý kiến này, 1 nghiên cứu gần đây kết luận rằng những bệnh nhân bị bệnh nặng bị nhiễm COVID-19 có tỷ lệ hạ Kali máu cao hơn do thải Kali qua thận. Điều này có thể là do giảm điều hòa ACE2, sau đó là sự xâm nhập của SARS-CoV-2 có thể làm giảm thoái biến Ang II, tăng biểu hiện thụ thể AT2, tăng tiết aldosterone, và do đó làm tăng sự mất Kali qua nước tiểu. Các nhà khoa học đã đề xuất rằng bình thường hóa sớm Kali huyết thanh ở bệnh nhân COVID-19 có thể tiên lượng tốt hơn. Do đó, tăng cường biểu hiện không bình thường của ACE2 thúc đẩy hai quá trình sinh lý, một mặt, nó giúp xâm nhập SARS-CoV-2 trong tế bào, mặt khác, nó bất lực trong việc bảo vệ khỏi tổn thương phổi do enzym ACE2 bị phân giải bởi SARS-CoV-2 làm tăng nguy cơ biến chứng và gây bất ổn cho bệnh nhân, dẫn đến tình trạng tử vong (Hình 3). Nhiều hiểu biết về cơ chế đã được chứng minh rằng cường giáp có thể gây ra phì đại tim và tăng biểu hiện ACE2. Hơn nữa, sự biểu hiện của ACE2 đã được chứng minh là thành phần quan trọng đối với nhiễm SARS-CoV-2. Các nghiên cứu này cùng giả thuyết rằng những người bị cường giáp dường như có nhiều nguy cơ bị nhiễm SARS-CoV-2 và các biến chứng liên quan đến COVID-19. Phù hợp với quan điểm này, 1 nghiên cứu gần đây đã báo cáo trường hợp đầu tiên bị cơn bão giáp liên quan đến SARS-CoV-2 ở một bệnh nhân có tiền sử mắc bệnh Graves. Trong hầu hết các trường hợp, cơn bão giáp có thể xuất hiện do cường giáp kéo dài mà không được điều trị, về cơ bản, chúng khởi phát do một vấn đề có sẵn cấp tính hoặc từ chối điều trị, là một trong những nguyên nhân chính gây ra các trường hợp cường giáp được phát hiện sớm trong quá trình nhiễm trùng. Như trong trường hợp đã được nghiên cứu này, SARS-CoV-2 cũng có thể gây ra cơn bão giáp ở những người có tiền sử bệnh Graves trước đây cho thấy rằng sự nổi bật của SARS-CoV2 trong cơn bão giáp trạng.
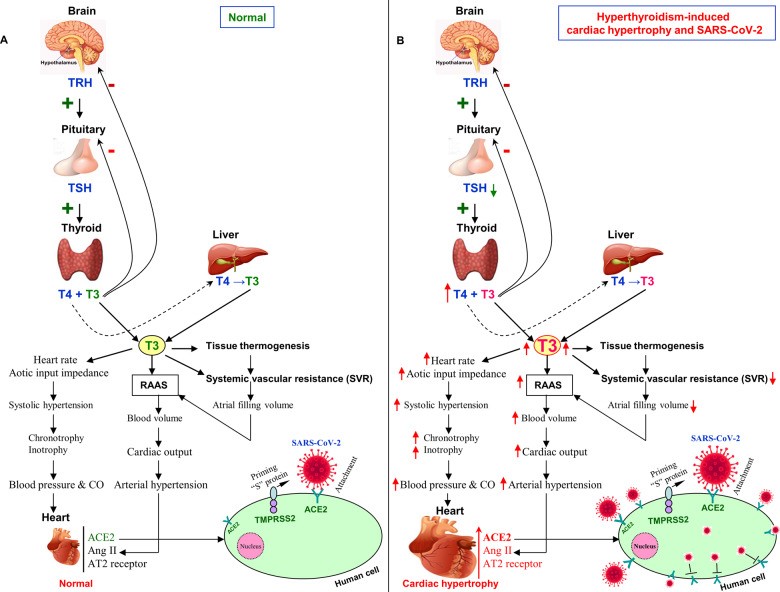
Hình 3: Phì đại cơ tim do cường giáp và vai trò của nó trong nguy cơ mắc COVID-19. a Hình minh họa cho thấy chức năng tuyến giáp bình thường. Điều hòa qua trung gian hormone tuyến giáp đối với các con đường sinh lý tế bào khác nhau bao gồm RAAS và tính nhạy cảm ít hơn đối với nhiễm SARS-CoV-2. B Sơ đồ cho thấy phì đại do cường giáp và nguy cơ tăng cường khi mắc SARS-CoV-2. Cường giáp điều hòa các tín hiệu khác nhau bao gồm RAAS dẫn đến phì đại cơ tim, tăng cường biểu hiện của thụ thể ACE2, Ang II và Mas bằng các thành phần chống điều hòa của RAAS. ACE2 được biểu hiện cao giúp gia tăng sự liên kết với SARS-CoV-2. Tiếp theo là sự nhân lên nhanh chóng của virus và điều hòa sự biểu hiện ACE2 giảm, điều này dẫn đến giảm sự phân hủy của Ang II, dẫn đến tăng tiết aldosterone và thải Kali ở thận, làm tăng rõ rệt tỷ lệ bệnh tật và tử vong liên quan đến tim và thận do COVID-19 ở người bệnh
VII. THUỐC KHÁNG GIÁP VÀ COVID-19
Bệnh nhân cường giáp và bệnh Graves thường được điều trị bằng Methimazole hoặc Propylthiouracil (PTU). Mặc dù thuốc kháng giáp có hiệu quả trong việc điều trị bệnh Graves, nhưng chúng có thể gây ra tác dụng phụ ngay cả khi dùng liều thấp. Về cơ bản, một số tác dụng phụ này có khả năng nghiêm trọng. Ví dụ, mất bạch cầu hạt là một tác dụng phụ nghiêm trọng được nhận thấy ở 0,2–0,5% số người dùng bất kỳ loại thuốc nào trong số này.
Tương tự như vậy, bệnh nhân dùng thuốc kháng giáp cũng có thể bị sốt hoặc đau họng. Vì những dấu hiệu bệnh này cũng có thể trùng lặp với các triệu chứng của COVID-19, nhiều bệnh nhân dùng những loại thuốc này có thể lo ngại rằng họ bị nhiễm SARS-CoV-2 và trở nên hoảng sơk. Ngoài ra, bệnh nhân có thể nhầm lẫn các triệu chứng của COVID-19 với tác dụng phụ của ATDs. Vì vậy, những người bị cường giáp nên đảm bảo rằng họ kiểm soát tốt hơn cường giáp bằng thuốc đầy đủ, giúp cải thiện sức khỏe tim mạch tốt và điều này có thể tăng cường phản ứng miễn dịch qua trung gian vật chủ. Vì vậy, điều mong muốn là tất cả những người có bệnh đi kèm cơ bản bao gồm cả cường giáp nên thực hiện các biện pháp phòng ngừa bổ sung để không bị nhiễm virus vì cho đến nay thuốc điều trị COVID-19 vẫn chưa được tìm ra.
VIII. BỆNH TUYẾN GIÁP CÓ LIÊN QUAN ĐẾN MỨC ĐỘ NGHIÊM TRỌNG CỦA COVID-19
Một nghiên cứu gần đây đã thực hiện một phân tích tổng hợp với tổng số 2169 trường hợp mắc bệnh COVID-19, bao gồm các bệnh nhân từ 8 báo cáo khác nhau. Kết quả thu được từ các phân tích tổng hợp cho thấy bệnh tuyến giáp tồn tại có khả năng liên quan đến tính dễ bị tổn thương do nhiễm SARS-CoV-2 và cho thấy rằng sự hiện diện của bệnh tuyến giáp có thể được coi là một yếu tố quan trọng đối với các mô hình phân tầng nguy cơ bệnh COVID-19.
Đáng chú ý là các hormone tuyến giáp rất cần thiết cho cơ chế điều hòa phản ứng miễn dịch bẩm sinh và bất kỳ sự thay đổi nào về mức độ hormone tuyến giáp đều ảnh hưởng đến khả năng miễn dịch bẩm sinh. Các phản ứng miễn dịch bẩm sinh đã được chứng minh là yếu tố đầu tiên của cơ thể để chống lại nhiễm SARS-CoV-2 và COVID-19 liên quan, thường được phản ánh bằng mức độ tăng cao đáng kể của tế bào đơn nhân CD14 + , đại thực bào, bạch cầu trung tính và giảm mức độ tế bào NK trong các trường hợp bị ảnh hưởng bởi SARS-CoV-2. Bên cạnh đó, người ta đã quan sát thấy rằng các cytokine tiền viêm bao gồm TNF-α và IL-6 được tăng cường đáng kể trong các trường hợp mắc bệnh tuyến giáp. Phù hợp với quan điểm, nồng độ cytokine tăng cao đã được tìm thấy ở những bệnh nhân COVID-19 nặng và có liên quan đến sự tiến triển của kết quả kém. Mặt khác, công dụng của corticosteroid như một phương pháp điều trị ức chế miễn dịch trong các trường hợp COVID-19 đã được chứng minh là có liên quan đến tỷ lệ nhiễm khuẩn cao, thời gian nằm viện lâu hơn và tỷ lệ tử vong cao hơn. Ngoài ra, hệ thống miễn dịch bẩm sinh cũng có thể chịu trách nhiệm trung gian cho các tổn thương cơ quan của các bệnh tự miễn. Chủ yếu, dòng thác này tạo ra các cytokine gây viêm giúp phóng đại tín hiệu viêm cục bộ ngoài việc kích hoạt các tế bào nhu mô gần hoặc các tế bào miễn dịch khác. Hơn nữa, việc tạo ra các enzym phân hủy và phân hủy chất nền hoặc các loại oxy phản ứng (ROS) dẫn đến tổn thương mô, mặc dù các dấu hiệu vi sinh vật là một trong những điều kiện tiên quyết để phát triển bệnh tự miễn.
IX. CÁC YẾU TỐ KHÁC LIÊN QUAN ĐẾN VIỆC GÂY RA BỆNH GRAVES
Các tác dụng phụ không mong muốn liên quan đến miễn dịch (immune-related adverse events: irAE) và các rối loạn tuyến giáp thường do irAE. Mặt khác, các chất bổ trợ, đặc biệt là vắc-xin đã được báo cáo là kích hoạt các phản ứng miễn dịch không mong muốn khác nhau gây ra một loạt các rối loạn tự miễn (AID) cũng bao gồm các bệnh tuyến giáp. Gần đây, hai trường hợp bệnh Graves do vắc xin SARS-CoV-2 gây ra đã được báo cáo. Tỷ lệ này được quan sát thấy ở hai nhân viên y tế sau 2–3 ngày tiêm vắc xin Pfizer-BioNTech (BNT162B2 SARS-CoV-2). Những bệnh nhân này đáp ứng tốt với các liệu pháp điều trị thông thường (Propranolol 40–60 mg, Thiamazole 10 mg có / không có Diltiazem 120 mg và Ivabradine 5 mg mỗi ngày) và hồi phục. Tình trạng tự miễn / viêm gây ra bởi chất bổ trợ được gọi là hội chứng tự miễn dịch do chất bổ trợ gây ra (Autoimmune syndromes-induced by adjuvants: ASIA). Hầu hết các thành phần của vắc xin đều an toàn nhưng một số chất bao gồm Polyethylene glycol (PEG) có khả năng hoạt động như một chất bổ trợ bằng cách tạo ra phản ứng miễn dịch, mặc dù tương đối hiếm gặp. Tuy nhiên, hiện nay được chú ý, bệnh Graves trong các trường hợp được tiêm chủng chắc chắn chỉ ra rằng đó là một hiện tượng bệnh lý của các tình trạng tự miễn gây ra bởi các chất bổ trợ. Trên thực tế, các tình trạng lâm sàng tương tự đã được quan sát thấy ở những bệnh nhân ung thư được điều trị bằng thuốc ức chế điểm kiểm soát miễn dịch (Immune-checkpoint inhibitors: ICPis). Đặc biệt, ICPis bao gồm anti-CTLA-4 (Ipilimumab và Tremelimumab) và protein chống sự chết theo chương trình của tế bào-1 (anti-programmed cell death protein-1: anti-PD-1) (Pembrolizumab và Nivolumab) đã được chứng minh là gây ra cường giáp Graves/bệnh mắt Graves trong bệnh nhân ung thư được điều trị bằng chất ức chế trạm kiểm soát miễn dich. Những bệnh nhân này được báo cáo đã được điều trị bằng Glucocorticoid hoặc Methimazole/Carbimazole trong khi hiếm khi thực hiện phẫu thuật cắt bỏ tuyến giáp. Những phát hiện này cho thấy rằng các yếu tố gây ra tình trạng tự miễn và / hoặc tình trạng viêm cũng có thể có nguy cơ gây ra bệnh Graves bất kể sự đa dạng của chúng.
X. KẾT LUẬN VÀ TRIỂN VỌNG TRONG TƯƠNG LAI
Các nghiên cứu gần đây tiết lộ rằng nhiễm SARS-CoV-2 có thể gây ra bệnh Graves, một bệnh cường giáp tự miễn trong các trường hợp sau COVID-19. Các yếu tố tự miễn khác nhau có thể làm trung gian truyền tín hiệu gây bệnh phức tạp trong bệnh cường giáp tự miễn. Các nghiên cứu trong tương lai được đảm bảo để loại trừ các yếu tố tự miễn và các con đường phân tử liên quan đến bệnh cường giáp tự miễn do SARS-CoV-2. Hơn nữa, những phát hiện liên quan cho thấy những người bị cường giáp có nguy cơ cao mắc bệnh COVID-19 nghiêm trọng và gây tử vong bất kể các yếu tố căn nguyên khác. Các tình trạng bệnh đi kèm khác nhau bao gồm cả bệnh tuyến giáp đã được báo cáo làm tăng nguy cơ của một bộ phận cộng đồng người lớn tuổi trên thế giới đối với SARS-CoV-2 và các biến chứng COVID-19 liên quan của nó mà có thể dẫn đến tử vong cao.
XI. TÀI LIỆU THAM KHẢO
1. Hoffmann M, Kleine-Weber H, Schroeder S, Krüger N, Herrler T, Erichsen S, Schiergens TS, Herrler G, Wu NH, Nitsche A, Müller MA, Drosten C, Pöhlmann S. SARS-CoV-2 cell entry depends on ACE2 and TMPRSS2 and is blocked by a clinically proven protease inhibitor. Cell. 2020;181(2):271–280.e8. doi: 10.1016/j.cell.2020.02.052. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
2. COVID-19 data portal home page. https://coronavirus.jhu.edu. Accessed on May 11, 2021.
3. Guan WJ, Liang WH, Zhao Y, Liang HR, Chen ZS, Li YM, Liu XQ, Chen RC, Tang CL, Wang T, Ou CQ, Li L, Chen PY, Sang L, Wang W, Li JF, Li CC, Ou LM, Cheng B, Xiong S, Ni ZY, Xiang J, Hu Y, Liu L, Shan H, Lei CL, Peng YX, Wei L, Liu Y, Hu YH, Peng P, Wang JM, Liu JY, Chen Z, Li G, Zheng ZJ, Qiu SQ, Luo J, Ye CJ, Zhu SY, Cheng LL, Ye F, Li SY, Zheng JP, Zhang NF, Zhong NS, He JX. Comorbidity and its impact on 1590 patients with COVID-19 in China: a nationwide analysis. Eur. Respir. J. 2020;55(5):2000547. doi: 10.1183/13993003.00547-2020. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
4. Li MY, Li L, Zhang Y, Wang XS. Expression of the SARS-CoV-2 cell receptor gene ACE2 in a wide variety of human tissues. Infect. Dis. Poverty. 2020;9(1):45. doi: 10.1186/s40249-020-00662-x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
5. Lania A, Sandri MT, Cellini M, Mirani M, Lavezzi E, Mazziotti G. Thyrotoxicosis in patients with COVID-19: the THYRCOV study. Eur. J. Endocrinol. 2020;183(4):381–387. doi: 10.1530/EJE-20-0335. [PubMed] [CrossRef] [Google Scholar]
6. Mateu-Salat M, Urgell E, Chico A. SARS-COV-2 as a trigger for autoimmune disease: report of two cases of Graves’ disease after COVID-19. J. Endocrinol. Invest. 2020;43(10):1527–1528. doi: 10.1007/s40618-020-01366-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
7. Jiménez-Blanco S, Pla-Peris B, Marazuela M. COVID-19: a cause of recurrent Graves’ hyperthyroidism? J. Endocrinol. Invest. 2021;44(2):387–388. doi: 10.1007/s40618-020-01440-0. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
8. Mullur R, Liu YY, Brent GA. Thyroid hormone regulation of metabolism. Physiol. Rev. 2014;94(2):355–382. doi: 10.1152/physrev.00030.2013. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
9. Taylor PN, Albrecht D, Scholz A, Gutierrez-Buey G, Lazarus JH, Dayan CM, Okosieme OE. Global epidemiology of hyperthyroidism and hypothyroidism. Nat. Rev. Endocrinol. 2018;14(5):301–316. doi: 10.1038/nrendo.2018.18. [PubMed] [CrossRef] [Google Scholar]
10. Antonelli A, Ferrari SM, Ragusa F, Elia G, Paparo SR, Ruffilli I, Patrizio A, Giusti C, Gonnella D, Cristaudo A, Foddis R, Shoenfeld Y, Fallahi P. Graves’ disease: epidemiology, genetic and environmental risk factors and viruses. Best. Pract. Res. Clin. Endocrinol. Metab. 2020;34(1):101387. doi: 10.1016/j.beem.2020.101387. [PubMed] [CrossRef] [Google Scholar]
11. Smith TJ, Hegedüs L. Graves’ disease. N. Engl. J. Med. 2016;375(16):1552–1565. doi: 10.1056/NEJMra1510030. [PubMed] [CrossRef] [Google Scholar]
12. Harris A, Mushref MAL. Graves’ thyrotoxicosis following SARS-CoV-2 infection. AACE Clin. Case Rep. 2021;7(1):14–16. doi: 10.1016/j.aace.2020.12.005. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
13. Vita R, Lapa D, Trimarchi F, Benvenga S. Stress triggers the onset and the recurrences of hyperthyroidism in patients with Graves’ disease. Endocrine. 2015;48(1):254–263. doi: 10.1007/s12020-014-0289-8. [PubMed] [CrossRef] [Google Scholar]
14. Prummel MF, Strieder T, Wiersinga WM. The environment and autoimmune thyroid diseases. Eur. J. Endocrinol. 2004;150(5):605–618. doi: 10.1530/eje.0.1500605. [PubMed] [CrossRef] [Google Scholar]
15. Asfuroglu Kalkan E, Ates I. A case of subacute thyroiditis associated with Covid-19 infection. J. Endocrinol. Invest. 2020;43(8):1173–1174. doi: 10.1007/s40618-020-01316-3. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
16. Ippolito S, Dentali F, Tanda ML. SARS-CoV-2: a potential trigger for subacute thyroiditis? Insights from a case report. J. Endocrinol. Invest. 2020;43(8):1171–1172. doi: 10.1007/s40618-020-01312-7. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
17. Brancatella A, Ricci D, Viola N, Sgrò D, Santini F, Latrofa F. Subacute thyroiditis after Sars-COV-2 infection. J. Clin. Endocrinol. Metab. 2020;105(7):dgaa276. doi: 10.1210/clinem/dgaa276. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
18. Salvi M, Girasole G, Pedrazzoni M, Passeri M, Giuliani N, Minelli R, Braverman LE, Roti E. Increased serum concentrations of interleukin-6 (IL-6) and soluble IL-6 receptor in patients with Graves’ disease. J. Clin. Endocrinol. Metab. 1996;81(8):2976–2979. doi: 10.1210/jcem.81.8.8768861. [PubMed] [CrossRef] [Google Scholar]
19. Costela-Ruiz VJ, Illescas-Montes R, Puerta-Puerta JM, Ruiz C, Melguizo-Rodríguez L. SARS-CoV-2 infection: the role of cytokines in COVID-19 disease. Cytokine Growth Factor Rev. 2020;54:62–75. doi: 10.1016/j.cytogfr.2020.06.001. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
20. Morshed SA, Latif R, Davies TF. Delineating the autoimmune mechanisms in Graves’ disease. Immunol. Res. 2012;54(1-3):191–203. doi: 10.1007/s12026-012-8312-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
21. Li Q, Wang B, Mu K, Zhang JA. The pathogenesis of thyroid autoimmune diseases: New T lymphocytes – Cytokines circuits beyond the Th1-Th2 paradigm. J. Cell. Physiol. 2019;234(3):2204–2216. doi: 10.1002/jcp.27180. [PubMed] [CrossRef] [Google Scholar]
22. Tsatsoulis A. The role of stress in the clinical expression of thyroid autoimmunity. Ann. N. Y. Acad. Sci. 2006;1088:382–395. doi: 10.1196/annals.1366.015. [PubMed] [CrossRef] [Google Scholar]
23. Gilbert JA, Kalled SL, Moorhead J, Hess DM, Rennert P, Li Z, Khan MZ, Banga JP. Treatment of autoimmune hyperthyroidism in a murine model of Graves’ disease with tumor necrosis factor-family ligand inhibitors suggests a key role for B cell activating factor in disease pathology. Endocrinology. 2006;147(10):4561–4568. doi: 10.1210/en.2006-0507. [PubMed] [CrossRef] [Google Scholar]
24. Lai Kwan Lam Q, King Hung O, Zheng Ko,BJ, Lu L. Local BAFF gene silencing suppresses Th17-cell generation and ameliorates autoimmune arthritis. Proc. Natl Acad. Sci. U. S. A. 2008;105(39):14993–14998. doi: 10.1073/pnas.0806044105. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
25. Salvi M, Vannucchi G, Campi I, Rossi S, Bonara P, Sbrozzi F, Guastella C, Avignone S, Pirola G, Ratiglia R, Beck-Peccoz P. Efficacy of rituximab treatment for thyroid-associated ophthalmopathy as a result of intraorbital B-cell depletion in one patient unresponsive to steroid immunosuppression. Eur. J. Endocrinol. 2006;154(4):511–517. doi: 10.1530/eje.1.02119. [PubMed] [CrossRef] [Google Scholar]
26. Chen CR, McLachlan SM, Rapoport B. Suppression of thyrotropin receptor constitutive activity by a monoclonal antibody with inverse agonist activity. Endocrinology. 2007;148(5):2375–2382. doi: 10.1210/en.2006-1754. [PubMed] [CrossRef] [Google Scholar]
27. Stassi G, De R. Maria, Autoimmune thyroid disease: new models of cell death in autoimmunity. Nat. Rev. Immunol. 2002;2(3):195–204. doi: 10.1038/nri750. [PubMed] [CrossRef] [Google Scholar]
28. Davies TF, Martin A, Concepcion ES, Graves P, Cohen L, Ben-Nun A. Evidence of limited variability of antigen receptors on intrathyroidal T cells in autoimmune thyroid disease. N. Engl. J. Med. 1991;325(4):238–244. doi: 10.1056/NEJM199107253250404. [PubMed] [CrossRef] [Google Scholar]
29. Davies TF, Martin A, Concepcion ES, Graves P, Lahat N, Cohen WL, Ben-Nun A. Evidence for selective accumulation of intrathyroidal T lymphocytes in human autoimmune thyroid disease based on T cell receptor V gene usage. J. Clin. Invest. 1992;89(1):157–162. doi: 10.1172/JCI115556. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
30. Dayan CM, Londei M, Corcoran AE, Grubeck-Loebenstein B, James RF, Rapoport B, Feldmann M. Autoantigen recognition by thyroid-infiltrating T cells in Graves disease. Proc. Natl Acad. Sci. U. S. A. 1991;88(16):7415–7419. doi: 10.1073/pnas.88.16.7415. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
31. Jackson RA, Haynes BF, Burch WM, Shimizu K, Bowring MA, Eisenbarth GS. Ia+ T cells in new onset Graves’ disease. J. Clin. Endocrinol. Metab. 1984;59(2):187–190. doi: 10.1210/jcem-59-2-187. [PubMed] [CrossRef] [Google Scholar]
32. Wall JR, Baur R, Schleusener H, Bandy-Dafoe P. Peripheral blood and intrathyroidal mononuclear cell populations in patients with autoimmune thyroid disorders enumerated using monoclonal antibodies. J. Clin. Endocrinol. Metab. 1983;56(1):164–169. doi: 10.1210/jcem-56-1-164. [PubMed] [CrossRef] [Google Scholar]
33. Martin A, Barbesino G, Davies TF. T-cell receptors and autoimmune thyroid disease-signposts for T-cell-antigen driven diseases. Int. Rev. Immunol. 1999;18(1-2):111–140. doi: 10.3109/08830189909043021. [PubMed] [CrossRef] [Google Scholar]
34. Martin A, Nakashima M, Zhou A, Aronson D, Werner AJ, Davies TF. Detection of major T cell epitopes on human thyroid stimulating hormone receptor by overriding immune heterogeneity in patients with Graves’ disease. J. Clin. Endocrinol. Metab. 1997;82(10):3361–3366. doi: 10.1210/jcem.82.10.4299. [PubMed] [CrossRef] [Google Scholar]
35. Sakaguchi S. Naturally arising Foxp3-expressing CD25+CD4+ regulatory T cells in immunological tolerance to self and non-self. Nat. Immunol. 2005;6(4):345–352. doi: 10.1038/ni1178. [PubMed] [CrossRef] [Google Scholar]
36. Bettelli E, Carrier Y, Gao W, Korn T, Strom TB, Oukka M, Weiner HL, Kuchroo VK. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells. Nature. 2006;441(7090):235–238. doi: 10.1038/nature04753. [PubMed] [CrossRef] [Google Scholar]
37. Fossiez F, Djossou O, Chomarat P, Flores-Romo L, Ait-Yahia S, Maat C, Pin JJ, Garrone P, Garcia E, Saeland S, Blanchard D, Gaillard C, Das Mahapatra B, Rouvier E, Golstein P, Banchereau J, Lebecque S. T cell interleukin-17 induces stromal cells to produce proinflammatory and hematopoietic cytokines. J. Exp. Med. 1996;183(6):2593–5603. doi: 10.1084/jem.183.6.2593. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
38. Lubberts E, Joosten LA, van de Loo FA, Schwarzenberger P, Kolls J, van den Berg WB. Overexpression of IL-17 in the knee joint of collagen type II immunized mice promotes collagen arthritis and aggravates joint destruction. Inflamm. Res. 2002;51(2):102–104. doi: 10.1007/BF02684010. [PubMed] [CrossRef] [Google Scholar]
39. Afzali B, Lombardi G, Lechler RI, Lord GM. The role of T helper 17 (Th17) and regulatory T cells (Treg) in human organ transplantation and autoimmune disease. Clin. Exp. Immunol. 2007;148(1):32–46. doi: 10.1111/j.1365-2249.2007.03356.x. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
40. Bohgaki T, Atsumi T, Koike T. Autoimmune disease after autologous hematopoietic stem cell transplantation. Autoimmun. Rev. 2008;7(3):198–203. doi: 10.1016/j.autrev.2007.11.005. [PubMed] [CrossRef] [Google Scholar]
41. Bohgaki T, Atsumi T, Koike T. Multiple autoimmune diseases after autologous stem-cell transplantation. N. Engl. J. Med. 2007;357(26):2734–2736. doi: 10.1056/NEJMc076383. [PubMed] [CrossRef] [Google Scholar]
42. Barreto-Chaves ML, Senger N, Fevereiro M, Parletta AC, Takano A. Impact of hyperthyroidism on cardiac hypertrophy. Endocr. Connect. 2020;9(3):R59–R69. doi: 10.1530/EC-19-0543. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
43. Diniz GP, Senger N, Carneiro-Ramos MS, Santos RA, Barreto-Chaves ML. Cardiac ACE2/angiotensin 1-7/Mas receptor axis is activated in thyroid hormone-induced cardiac hypertrophy. Ther. Adv. Cardiovasc. Dis. 2016;10(4):192–202. doi: 10.1177/1753944715623228. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
44. Yan R, Zhang Y, Li Y, Xia L, Guo Y, Zhou Q. Structural basis for the recognition of SARS-CoV-2 by full-length human ACE2. Science. 2020;367(6485):1444–1448. doi: 10.1126/science.abb2762. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
45. Bavishi C, Maddox TM, Messerli FH. Coronavirus disease 2019 (COVID-19) infection and renin angiotensin system blockers. JAMA Cardiol. 2020;5(7):745–747. doi: 10.1001/jamacardio.2020.1282. [PubMed] [CrossRef] [Google Scholar]
46. Lippi G, South AM, Henry BM. Electrolyte imbalances in patients with severe coronavirus disease 2019 (COVID-19) Ann. Clin. Biochem. 2020;57(3):262–265. doi: 10.1177/0004563220922255. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
47. Pastor S, Sr. Molina Á, De Celis E. Thyrotoxic Crisis and COVID-19 Infection: An Extraordinary Case and Literature Review. Cureus. 2020;12(11):e11305. doi: 10.7759/cureus.11305. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
48. Swee du S, Chng CL, Lim A. Clinical characteristics and outcome of thyroid storm: a case series and review of neuropsychiatric derangements in thyrotoxicosis. Endocr. Pract. 2015;21(2):182–189. doi: 10.4158/EP14023.OR. [PubMed] [CrossRef] [Google Scholar]
49. Boelaert K, Visser WE, Taylor PN, Moran C, Léger J, Persani L. ENDOCRINOLOGY IN THE TIME OF COVID-19: management of hyperthyroidism and hypothyroidism. Eur. J. Endocrinol. 2020;183(1):G33–G39. doi: 10.1530/EJE-20-0445. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
50. Almazeedi S, Al-Youha S, Jamal MH, Al-Haddad M, Al-Muhaini A, Al-Ghimlas F, Al-Sabah S. Characteristics, risk factors and outcomes among the first consecutive 1096 patients diagnosed with COVID-19 in Kuwait. EClinicalMedicine. 2020;24:100448. doi: 10.1016/j.eclinm.2020.100448. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
51. M. Cao, D. Zhang, Y. Wang, Y. Lu, X. Zhu, Y. Li, H. Xue, Y. Lin, M. Zhang, Y. Sun, Z. Yang, J. Shi, Y. Wang, C. Zhou, Y. Dong, P. Liu, S. M. Dudek, Z. Xiao, H. Lu, L. Peng, Clinical features of patients infected with the 2019 novel coronavirus (COVID-19) in Shanghai, China. medRxiv. 2020;2020.03.04.20030395. 10.1101/2020.03.04.20030395.
52. Liu J, Wu X, Lu F, Zhao L, Shi L, Xu F. Low T3 syndrome is a strong predictor of poor outcomes in patients with community-acquired pneumonia. Sci. Rep. 2016;6:22271. doi: 10.1038/srep22271. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
53. Shabrawishi M, Al-Gethamy MM, Naser AY, Ghazawi MA, Alsharif GF, Obaid EF, Melebari HA, Alamri DM, Brinji AS, Al Jehani FH, Almaimani W, Ekram RA, Alkhatib KH, Alwafi H. Clinical, radiological and therapeutic characteristics of patients with COVID-19 in Saudi Arabia. PLoS One. 2020;15(8):e0237130. doi: 10.1371/journal.pone.0237130. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
54. Sisó-Almirall A, Kostov B, Mas-Heredia M, Vilanova-Rotllan S, Sequeira-Aymar E, Sans-Corrales M, Sant-Arderiu E, Cayuelas-Redondo L, Martínez-Pérez A, García-Plana N, Anguita-Guimet A, Benavent-Àreu J. Prognostic factors in Spanish COVID-19 patients: a case series from Barcelona. PLoS One. 2020;15(8):e0237960. doi: 10.1371/journal.pone.0237960. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
55. Wang Y, Liu Y, Liu L, Wang X, Luo N, Li L. Clinical outcomes in 55 patients with severe acute respiratory syndrome coronavirus 2 who were asymptomatic at hospital admission in Shenzhen, China. J. Infect. Dis. 2020;221(11):1770–1774. doi: 10.1093/infdis/jiaa119. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
56. S. Yan, X. Song, F. Lin, H. Zhu, X. Wang, M. Li, J. Ruan, C. Lin, X. Liu, Q. Wu, Z. Luo, W. Fu, S. Chen, Y. Yuan, S. Liu, J. Yao, C. Lv, Clinical characteristics of coronavirus disease 2019 in Hainan, China. medRxiv (2020), 10.1101/2020.03.19.20038539.
57. Zhang JJ, Dong X, Cao YY, Yuan YD, Yang YB, Yan YQ, Akdis CA, Gao YD. Clinical characteristics of 140 patients infected with SARS-CoV-2 in Wuhan, China. Allergy. 2020;75(7):1730–1741. doi: 10.1111/all.14238. [PubMed] [CrossRef] [Google Scholar]
58. Hariyanto TI, Kurniawan A. Thyroid disease is associated with severe coronavirus disease 2019 (COVID-19) infection. Diabetes Metab. Syndr. 2020;14(5):1429–1430. doi: 10.1016/j.dsx.2020.07.044. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
59. Montesinos MDM, Pellizas CG. Thyroid hormone action on innate immunity. Front Endocrinol. (Lausanne) 2019;10:350. doi: 10.3389/fendo.2019.00350. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
60. McKechnie JL, Blish CA. The innate immune system: fighting on the front lines or fanning the flames of COVID-19? Cell Host Microbe. 2020;27(6):863–869. doi: 10.1016/j.chom.2020.05.009. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
61. Figueroa-Vega N, Alfonso-Pérez M, Benedicto I, Sánchez-Madrid F, González-Amaro R, Marazuela M. Increased circulating pro-inflammatory cytokines and Th17 lymphocytes in Hashimoto’s thyroiditis. J. Clin. Endocrinol. Metab. 2010;95(2):953–962. doi: 10.1210/jc.2009-1719. [PubMed] [CrossRef] [Google Scholar]
62. Lv LF, Jia HY, Zhang HF, Hu YX. Expression level and clinical significance of IL-2, IL-6 and TGF-β in elderly patients with goiter and hyperthyroidism. Eur. Rev. Med. Pharmacol. Sci. 2017;21(20):4680–4686. [PubMed] [Google Scholar]
63. Yang Z, Liu J, Zhou Y, Zhao X, Zhao Q, Liu J. The effect of corticosteroid treatment on patients with coronavirus infection: a systematic review and meta-analysis. J. Infect. 2020;81(1):e13–e20. doi: 10.1016/j.jinf.2020.03.062. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
64. Saferding V, Blüml S. Innate immunity as the trigger of systemic autoimmune diseases. J. Autoimmun. 2020;110:102382. doi: 10.1016/j.jaut.2019.102382. [PubMed] [CrossRef] [Google Scholar]
65. El Sabbagh R, Azar NS, Eid AA, Azar ST. Thyroid dysfunctions due to immune checkpoint inhibitors: a review. Int J. Gen. Med. 2020;13:1003–1009. doi: 10.2147/IJGM.S261433. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
66. Ruiz JT, Luján L, Blank M, Shoenfeld Y. Adjuvants- and vaccines-induced autoimmunity: animal models. Immunol. Res. 2017;65(1):55–65. doi: 10.1007/s12026-016-8819-5. [PubMed] [CrossRef] [Google Scholar]
67. O. Vera-Lastra, A. Ordinola Navarro, M. P. Cruz Domiguez, G. Medina, T. I. Sánchez Valadez, L. J. Jara, Two cases of Graves’ disease following SARS-CoV-2 vaccination: an autoimmune/inflammatory syndrome induced by adjuvants. Thyroid. (2021). 10.1089/thy.2021.0142. [PubMed]
68. Garvey LH, Nasser S. Anaphylaxis to the first COVID-19 vaccine: is polyethylene glycol (PEG) the culprit? Br. J. Anaesth. 2021;126(3):e106–e108. doi: 10.1016/j.bja.2020.12.020. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
69. Brancatella A, Viola N, Brogioni S, Montanelli L, Sardella C, Vitti P, Marcocci C, Lupi I, Latrofa F. Graves’ disease induced by immune checkpoint inhibitors: a case report and review of the literature. Eur. Thyroid J. 2019;8(4):192–195. doi: 10.1159/000501824. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
Nguồn: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8188762/
Bài viết được dịch thuật và biên tập bởi CLB Nội tiết trẻ trên DEMACVN.COM – Vui lòng không reup khi chưa được cho phép!
Người dịch: ToanTran.
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam