NHIỄM KHUẨN TIẾT NIỆU Ở NGƯỜI BỆNH ĐÁI THÁO ĐƯỜNG – KẾT QUẢ TỪ CÁC NGHIÊN CỨU TRONG BỐI CẢNH RA ĐỜI NHÓM THUỐC HẠ ĐƯỜNG HUYẾT MỚI ỨC CHẾ SGLT2
ThS. Nguyễn Thị Thu Hương*, PGS.TS. Đỗ Gia Tuyển**
*Bệnh viện Nội tiết Trung Ương, ** Bệnh viện Bạch Mai
1. Đại cương
Đái tháo đường (ĐTĐ) là bệnh mạn tính không lây có tốc độ phát triển nhanh chóng. Biến chứng của bệnh ĐTĐ không những làm ảnh hưởng tới chất lượng cuộc sống của người bệnh mà còn là gánh nặng cho toàn xã hội. Ngoài các tổn thương ở mạch máu lớn và mạch máu nhỏ, ĐTĐ còn làm gia tăng nhiễm khuẩn tiết niệu không triệu chứng (asymptomatic bacteriuria) và nhiễm khuẩn tiết niệu (urinary tract infections) cũng như viêm đường sinh dục không lây qua quan hệ tình dục như viêm âm hộ-âm đạo, viêm quy đầu[1].
Nhiễm khuẩn tiết niệu không triệu chứng được định nghĩa là khi 2 mẫu nước tiểu liên tiếp được lấy từ một người bệnh có cùng chủng loại vi khuẩn với số lượng ≥ 105 cfu/ml mà không có triệu chứng hay dấu hiệu của nhiễm khuẩn tiết niệu. Escherichia coli (E.coli) và Klebsiella pneumonia (K. pneumonia) là những vi khuẩn thường gặp nhất. Nhiễm khuẩn tiết niệu không triệu chứng là yếu tố nguy cơ chính gây nhiễm khuẩn tiết niệu. Biến chứng của nhiễm khuẩn tiết niệu cũng hay gặp hơn trên người bệnh ĐTĐ, mà phổ biến hơn cả là viêm thận –bể thận.
Thuốc ức chế kênh đồng vận chuyển Natri – Glucose (SGLT2) là nhóm thuốc uống hạ đường huyết mới, độc lập với insulin, đã được FDA phê duyệt từ năm 2013, có tác dụng ức chế tái hấp thu đường tại ống lượn gần ở thận. Do đó, làm tăng thải đường qua nước tiểu giúp làm giảm đường trong máu. Bên cạnh tác dụng kiểm soát đường huyết, việc đào thải đường qua nước tiểu đem lại một số lợi ích cộng thêm như giảm cân và hạ huyết áp. Tuy nhiên nhóm thuốc này có khả năng tăng nguy cơ viêm đường sinh dục và tiết niệu do tạo môi trường thuận lợi cho vi khuẩn phát triển.
Mục đích của bài báo này nhằm trình bày mối liên quan giữa nhiễm khuẩn tiết niệu và bệnh ĐTĐ đặc biệt là với sự ra đời nhóm thuốc ức chế SGLT2.
2. Tỷ lệ nhiễm khuẩn tiết niệu và các yếu tố nguy cơ ở người mắc Đái tháo đường
2.1. Nhiễm khuẩn tiết niệu không triệu chứng
Các nghiên cứu đều cho thấy mối liên quan giữa nhiễm khuẩn tiết niệu và ĐTĐ, đặc biệt là ở nữ giới. Kết quả phân tích gộp từ 22 nghiên cứu cho thấy tỷ lệ nhiễm khuẩn tiết niệu không triệu chứng gặp ở 12.2% bệnh nhân ĐTĐ so với 4.5% ở nhóm chứng.Tỷ lệ này cao hơn ở nữ giới của nhóm có ĐTĐ so với nhóm chứng khỏe mạnh (14,2% vs 5,1% OR: 2,6[1,6-4,1]) còn tỷ lệ nhiễm khuẩn tiết niệu không triệu chứng ở nam giới chỉ là (2,3% vs 0,8% OR: 3.7[1,3-10,2])[2].
Bốn nghiên cứu trong phân tích gộp này, khi đánh giá ảnh hưởng của thời gian mắc bệnh với tỷ lệ nhiễm khuẩn tiết niệu không triệu chứng cho thấy tăng nhẹ thời gian mắc ĐTĐ ở nhóm có nhiễm khuẩn tiết niệu không triệu chứng so với nhóm không có viêm (sự khác biệt gộp là 0,17 năm [CI 95%: 0,03-0,31]; p=0,01). Không thấy có sự khác biệt về HbA1c ở nhóm nhiễm khuẩn tiết niệu không triệu chứng với nhóm không viêm gợi ý rằng mức kiểm soát HbA1c không ảnh hưởng tới nhiễm khuẩn tiết niệu không triệu chứng[2].
2.2. Nhiễm khuẩn tiết niệu
Theo dữ liệu nghiên cứu tại Mỹ từ năm 2014 cho thấy chẩn đoán nhiễm khuẩn tiết niệu hay gặp hơn ở người mắc ĐTĐ với tỷ lệ là 9,4% so với 5,7% ở người không mắc ĐTĐ[3].
Nghiên cứu quan sát tại Vương Quốc Anh xác định tỷ lệ nhiễm khuẩntiết niệu ở người mắc ĐTĐ và so sánh nguy cơ đó với nhóm không mắc ĐTĐ. Bệnh nhân được đưa vào nghiên cứu theo dõi trong 1 năm cho đến khi xuất hiện nhiễm khuẩn tiết niệu. Tỷ lệ nhiễm khuẩn tiết niệu là 46.9/1000 người – năm (CI 95%: 45.8-48.1) ở nhóm mắc ĐTĐ so với nhóm không mắc ĐTĐ. Nghiên cứu xác định giới, tuổi và ĐTĐ là yếu tố nguy cơ của nhiễm khuẩn tiết niệu[4].
Nghiên cứu tại Ấn Độ trên 1157 người mắc ĐTĐ týp 2 xác định các yếu tố nguy cơ của nhiễm khuẩn tiết niệu bao gồm: nữ giới, thời gian mắc bệnh cũng như kiểm soát đường huyết kém[5].
3. Cơ chế bệnh sinh của nhiễm khuẩn tiết niệu không triệu chứng và nhiễm khuẩn tiết niệu ở người mắc ĐTĐ týp 2.
3.1. Tăng đường niệu
Kết quả từ 1 nghiên cứu cho thấy ở những mẫu nước tiểu có nồng độ đường từ 100 đến 1000mg/dl (tương đương với mức độ đường niệu từ trung bình đến nặng) kích thích đáng kể sự phát triển của vi khuẩn sau 6h so với mẫu nước tiểu bình thường[6]. Hơn nữa, một nghiên cứu lâm sàng chỉ ra mối liên quan giữa đường niệu và nhiễm khuẩn tiết niệu không triệu chứng là khi nồng độ đường trong nước tiểu là 352.2±458.8mg/dl và 62.4±207.5mg/dl (p<0.05) ở người mắc ĐTĐ có nhiễm khuẩn tiết niệu không triệu chứng và không có nhiễm khuẩn tiết niệu không triệu chứng[7]. Tuy nhiên, điều đó không gặp ở mọi nghiên cứu. Như trong nghiên cứu trên 636 phụ nữ mắc ĐTĐ, không thấy có mối liên quan giữa đường niệu và nhiễm khuẩn tiết niệu không triệu chứng khi 42% phụ nữ không có nhiễm khuẩn tiết niệu không triệu chứng và 38% phụ nữ có nhiễm khuẩn tiết niệu không triệu chứng có đường niệu (p=0.4)[8].
3.2. Sự bám dính của vi khuẩn lên biểu mô đường niệu
Bước quan trọng đầu tiên trong quá trình tương tác giữa vi khuẩn và vật chủ là sự bám dính của chúng vào các bề mặt của vật chủ. Một khi đã bám dính lên bề mặt tế bào vật chủ, vi khuẩn gây bệnh có khả năng khởi động các quá trình hóa sinh đặc hiệu gây bệnh như tăng sinh, bài tiết độc tố, xâm nhập và hoạt hóa các chuỗi tín hiệu của tế bào vật chủ.
Có sự gia tăng khả năng bám dính của vi khuẩn lên tế bào biểu mô thận được quan sát thấy ở người bệnh ĐTĐ. Đặc biệt là E. coli biểu đạt fimbriae týp 1, đóng vai trò quan trọng trong cơ chế bệnh sinh của nhiễm khuẩn tiết niệu. Các fimbriae có bản chất polypeptide là những cấu trúc phụ của E.coli có dạng như sợi lông trên bề mặt vi khuẩn có đỉnh gắn với tế bào biểu mô thận.Sự bám dính của E.coli có fimbriae týp 1 với những tế bào biểu mô thận tăng cao hơn ở những người bệnh kiểm soát đường huyết kém. Sự thay đổi khả năng bám dính này có thể là do sự khác biệt của các thụ thể fimbriae týp1 trên tế bào biểu mô thận ở người mắc và không mắc ĐTĐ[9].
3.3 Rối loạn chức năng miễn dịch
Môi trường đường huyết cao đã làm thay đổi chức năng miễn dịch của người mắc ĐTĐ. Một số chức năng miễn dịch bao gồm chức năng của bạch cầu đa nhân và độ bám dính, quá trình thực bào cũng bị ảnh hưởng. Điều đó góp phần vào cơ chế bệnh sinh của nhiễm khuẩn tiết niệu ở người mắc ĐTĐ[10].
4. Ảnh hưởngcủa thuốc gây tăng đường niệu lên nhiễm khuẩn tiết niệu
Hiện nay, các thuốc trong nhóm ức chế SGLT2 được FDA phê duyệt bao gồm: dapagliflozin, canagliflozin, empagliflozin. Trong số đó, dapagliflozin là thuốc ức chế SGLT-2 đầu tiên vàcó nhiều dữ liệu lâm sàng nhất.
4.1. Dapagliflozin
Dapagliflozin làm tăng đào thải đường qua nước tiểu ở bệnh nhân ĐTĐ phụ thuộc liều dùng. Nồng độ đường niệu quan sát thấy trong suốt 24h ở các mức liều 5mg, 25 mg và 100mg dapagliflozin theo thứ tự lần lượt là 45,2g; 75,3g và 81,3 g/ngày. Sau 2 tuần điều trị với liều 1 lần/ ngày, nồng độ đường trong nước tiểu là 36,6g; 70,1g và 69,9g/ngày[11]. Điều trị thời gian dài với dapagliflozin 10mg khi phối hợp thêm với metformin cho thấy mức bài tiết đường qua nước tiểu tăng và duy trì ổn định tới 102 tuần. Sự thay đổi tỷ số đường/ creatinin niệu trung bình so với ban đầu ở tuần thứ 102 ở nhóm dùng dapagliflozin liều 10mg là 31,8g/g so với -0,21 ở nhóm giả dược[12].
Phân tích gộp từ 12 nghiên cứu lâm sàng, mù đôi có đối chứng với dapagliflozin đã cung cấp thông tin về ảnh hưởng dược lý học gây tăng đường niệu lên tỷ lệ nhiễm khuẩn tiết niệu. Nhiễm khuẩn tiết niệu không triệu chứng không được đưa vào đánh giá trong các nghiên cứu này. Bệnh nhân mắc ĐTĐ týp 2 được điều trị bằng dapagliflozin với liều từ 2.5-10mg/ngày cho tới 24 tuần (3 nghiên cứu với thời gian 12 tuần, 9 nghiên cứu là 24 tuần). Dapagliflozin 10mg được đánh giá trong tất cả các nghiên cứu còn liều 5 mg được đánh giá ở 11 trong 12 nghiên cứu. Ở tuần thứ 24, sự thay đổi đường niệu trung bình so với ban đầu lần lượt là -241, 2150 và 2592 mg/dl ở nhóm giả dược, dapagliflozin 5mg và 10mg (đường niệu tại thời điểm nghiên cứu ở các nhóm là 511, 511 và 450mg/dl)[13].Tất cả các dấu hiệu, triệu chứng cũng như biến cố gợi ý của nhiễm khuẩn tiết niệu đều được thu thập đầy đủ. Các triệu chứng được báo cáo bởi người tham gia nghiên cứu cũng như được hỏi chủ động trong mỗi lần tái khám sẽ được thu thập trong suốt chương trình lâm sàng về Dapagliflozin.
Tỷ lệ nhiễm khuẩn tiết niệu tăng nhẹ ở nhóm sử dụng dapagliflozin so với giả dược. Tần suất gặp nhiễm khuẩn tiết niệu cũng hay gặp ở nữ giới hơn nam giới (Bảng 1).
Bảng 1.Nhiễm khuẩn tiết niệu trên bệnh nhân sử dụng Dapagliflozin (trong thử nghiệm lâm sàng 24 tuần)
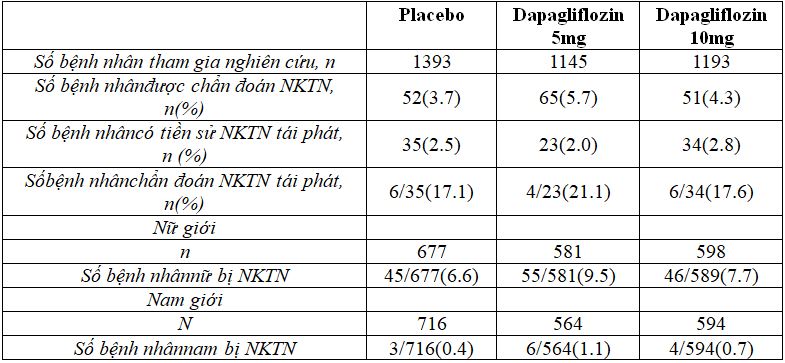
Tiền sử nhiễm khuẩn tiết niệu tái phát tương đối ít gặp (khoảng 2-3%), nhưng nó là yếu tố nguy cơ mạnh mẽ của nhiễm khuẩn tiết niệu. Do đó, nó tăng nguy cơ mắc nhiễm khuẩn tiết niệu ở cả nhóm điều trị và nhóm chứng. Chính vì vậy tỷ lệ nhiễm khuẩn tiết niệu có thể thấp hơn trong chương trình thử nghiệm lâm sàng dapagliflozin. Nhìn chung, nhiễm khuẩn tiết niệu thường xảy ra sớm trong quá trình điều trị, ít khi tái phát. Vi khuẩn gây nhiễm khuẩn tiết niệu là E. coli, Klebsiella sp và Proteussp, cũng giống như trong quần thể dân số chung.
Hầu hết nhiễm khuẩn tiết niệu này đều đáp ứng tốt với điều trị kháng sinh chuẩn (71% và 84% tương ứng ở nhóm dapagliflozin 5 và 10mg còn ở nhóm giả dược là 89%). Viêm bể thận rất hiếm gặp ở tất cả các nhóm (0% và 0,1% tương ứng ở nhóm dapagliflozin 5 và 10mg còn ở nhóm sử dụng giả dược là 0,1%). Điều trị ngắt quãng hoặc ngừng dapagliflozin do nhiễm khuẩn tiết niệu rất hiếm, chỉ xảy ra ở 0,2-0,3% bệnh nhân ở nhóm sử dụng dapagliflozin so với 0,1% ở nhóm sử dụng giả dược.
4.2. Empagliflozin
Một nghiên cứu kéo dài 12 tuần được tiến hành trên 408 bệnh nhân kiểm soát đường huyết kém nhưng chưa từng bị nhiễm khuẩn tiết niệu. Kết quả cho thấy tỷ lệ nhiễm khuẩn tiết niệu ở nhóm điều trị Empagliflozin là 1.6%, còn tỷ lệ là 1,2% và 1,3% ở nhóm dùng giả dược và metformin[14]. Một nghiên cứu 12 tuần với 495 bệnh nhân ĐTĐ týp2 chưa được kiểm soát đường huyết với metformin đơn trị liệu, kết quả cho thấy tỷ lệ nhiễm khuẩn tiết niệu là tương tự nhau ở nhóm phối hợp thêm Empagliflozin (4%) và sitagliptin (4.2%)[15]. Tuy nhiên, tỷ lệ nhiễm khuẩn tiết niệu lại giảm nhẹ ở nhóm dùng giả dược.
4.3. Canagliflozin
Nghiên cứu pha 2 của Canagliflozin đánh giá tỷ lệ nhiễm khuẩn và tần suất các biến cố nặng của nhiễm khuẩn tiết niệu ở bệnh nhân ĐTĐ.Bệnh nhân được thực hiện qui trình lấy mẫu nước tiểu sạch, giữa dòng. Sau đó được phân tích bằng que thử và nuôi cấy tại thời điểm nghiên cứu và ở thời điểm 12 tuần. Tỷ lệ nhiễm khuẩn tiết niệu không triệu chứng tại thời điểm bắt đầu nghiên cứu là 6.4% ở nhóm canagliflozin và 6.5 % ở nhóm giả dược/ sitagliptin (nhóm chứng) và tại thời điểm 12 tuần lần lượt là 7.7% và 6.4% (OR: 1.23 CI95%: 0,45-3,89). Ở nhóm cấy nước tiểu âm tính tại thời điểm nghiên cứu chuyển thành cấy nước tiểu dương tính ở tuần 12, không có sự khác biệt có ý nghĩa quan sát được ở nhóm dùng canagliflozin và nhóm đối chứng (4.8% và 3.7% với p=0,76). Tất cả các trường hợp nhiễm khuẩn tiết niệu đều chỉ ở mức độ nhẹ đến vừa. Không có trường hợp nào phải ngừng thuốc[16].
- Điều trị
Điều trị nhiễm khuẩn tiết niệu ở bệnh nhân ĐTĐtýp2 phụ thuộc vào nhiều yếu tố như: nhiễm khuẩn tiết niệu thấp hay nhiễm khuẩn tiết niệu cao,có bất thường về giải phẫu đường tiết niệu, suy thận hoặc có nhiều bệnh lý nặng đi kèm. Nhìn chung, điều trị nhiễm khuẩn tiết niệu ở người mắc ĐTĐ cũng tương tự như người không mắc ĐTĐ. Lựa chọn kháng sinh nên được thực hiện theo hướng dẫn cũng như cần điều chỉnh các rối loạn chuyển hóa có thể ảnh hưởng tới tình trạng nhiễm trùng[17],[18].
(Lựa chọn ban đầu điều trị theo các loại nhiễm khuẩn tiết niệu được mô tả chi tiết ở bảng 2)
Bảng 2. Lựa chọn kháng sinh điều trị nhiễm khuẩn tiết niệu
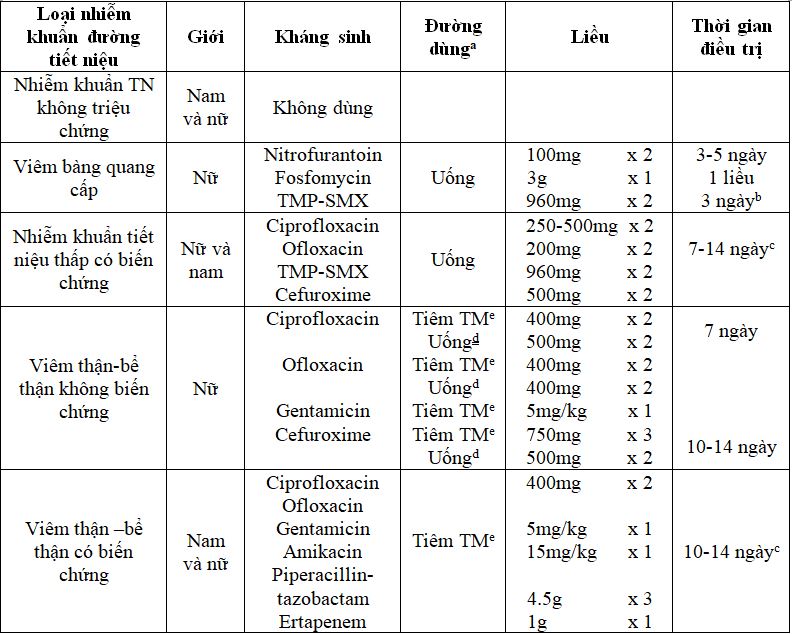
Chú ý:
aNên lựa chọn kháng sinh điều trị theo kết quả kháng sinh đồ
bChỉ sử dụng theo kinh nghiệm khi đề kháng tại chỗ với kháng sinh đó <20%
cThời gian điều trị phụ thuộc vào mức độ triệu chứng và đáp ứng của người bệnh
dChỉ định kháng sinh đường uống cho bệnh nhân có triệu chứng từ nhẹ đến vừa mà có thể dung nạp được với thuốc uống
eĐiều chỉnh sang dạng uống khi tình trạng bệnh nhân cải thiện, triệu chứng lâm sàng ổn định.
Chữ viết tắt: TMP-SMX, trimethoprim-sulfamethoxazole.
6. Kết luận
Người bệnh ĐTĐtýp 2 có xu hướng dễ mắc các bệnh nhiễm khuẩn tiết niệu hơn. Nhiều nghiên cứu cho thấy các yếu tố làm gia tăng nguy cơ mắc nhiễm khuẩn tiết niệu là do sự tăng nồng độ đường niệu giúp vi khuẩn dễ dàng phát triển cũng như tăng khả năng kết dính của vi khuẩn với biểu mô thận. Tuy nhiên, cơ chế chính xác làm tăng nguy cơ nhiễm khuẩn tiết niệu ở người mắc ĐTĐ týp 2 vẫn còn chưa được chứng minh đầy đủ.
Thuốc ức chế SGLT2 dường như đóng vai trò thuận lợi hơn cho sự xuất hiện nhiễm khuẩn tiết niệu nhưng với tỷ lệ thấp. Ngoài ra, không thấy mối liên quan giữa liều dùng SGLT2 với tỷ lệ nhiễm khuẩn tiết niệu. Nhiễm khuẩn tiết niệu cao như viêm bể thận không tăng khi điều trị với thuốc ức chế SGLT2. Những đặc điểm về nhiễm trùng này cũng tương tự như trong quần thể mắc ĐTĐ nói chung đó là đáp ứng với điều trị chuẩn và ít khi tái phát.
Dù tăng nguy cơ trong các dữ liệu nghiên cứu, tầm quan trọng thực sự trong mối liên quan giữa nhiễm khuẩn tiết niệu và thuốc ức chế SGLT2 vẫn còn nhiều điều chưa được sáng tỏ. Do cơ chế hoạt động của thuốc ức chế SGLT2 là làm tăng thải đường niệu nên các dấu hiệu nhiễm khuẩn tiết niệu được giám sát chặt chẽ trong quá trình phát triển lâm sàng của nhóm thuốc này. Kết quả là các vấn đề của nhiễm khuẩn tiết niệu có xu hướng được báo cáo nhiều hơn trong các thử nghiệm lâm sàng của nhóm SGLT2 không chỉ ở nhóm điều trị mà cả ở nhóm chứng. Hơn nữa, thuốc ức chế SGLT2 còn làm tăng các triệu chứng đường tiểu lành tính như tiểu nhiều do tăng bài niệu thẩm thấu. Những vấn đề đó cũng góp thêm vào việc tăng xu hướng nhiễm khuẩn ở người bệnh điều trị nhóm SGLT2.
TÀI LIỆU THAM KHẢO
- Benfield, T., et al. (2007) Influence of diabetes and hyperglycaemia on infectious disease hospitalisation and outcome. Diabetologia 50, 549-554
- Renko, M., et al. (2011) Meta-Analysis of the Significance of Asymptomatic Bacteriuria in Diabetes. Diabetes Care 34, 230-235
- Nitzan, O., et al. (2015) Urinary tract infections in patients with type 2 diabetes mellitus: review of prevalence, diagnosis, and management. Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy 8, 129-136
- Hirji, I., et al. Incidence of urinary tract infection among patients with type 2 diabetes in the UK General Practice Research Database (GPRD). Journal of Diabetes and Its Complications 26, 513-516
- Janifer, J., et al. (2009) Prevalence of lower urinary tract infection in South Indian type 2 diabetic subjects. Indian Journal of Nephrology 19, 107-111
- Geerlings, S.E., et al. (1999) Effect of glucose and pH on uropathogenic and non-uropathogenic Escherichia coli: studies with urine from diabetic and non-diabetic individuals. Journal of medical microbiology 48, 535-539
- Turan, H., et al. (2008) Frequency, risk factors, and responsible pathogenic microorganisms of asymptomatic bacteriuria in patients with type 2 diabetes mellitus. Japanese journal of infectious diseases 61, 236-238
- Geerlings, S.E., et al. (2000) Asymptomatic bacteriuria may be considered a complication in women with diabetes. Diabetes Mellitus Women Asymptomatic Bacteriuria Utrecht Study Group. Diabetes Care 23, 744-749
- Wu, X.R., et al. (1996) In vitro binding of type 1-fimbriated Escherichia coli to uroplakins Ia and Ib: relation to urinary tract infections. Proceedings of the National Academy of Sciences of the United States of America 93, 9630-9635
- Delamaire, M., et al. (1997) Impaired leucocyte functions in diabetic patients. Diabetic medicine : a journal of the British Diabetic Association 14, 29-34
- Komoroski, B., et al. (2009) Dapagliflozin, a novel, selective SGLT2 inhibitor, improved glycemic control over 2 weeks in patients with type 2 diabetes mellitus. Clinical pharmacology and therapeutics 85, 513-519
- Bailey, C.J., et al. (2013) Dapagliflozin add-on to metformin in type 2 diabetes inadequately controlled with metformin: a randomized, double-blind, placebo-controlled 102-week trial. BMC medicine 11, 43
- Johnsson, K.M., et al. (2013) Urinary tract infections in patients with diabetes treated with dapagliflozin. J Diabetes Complications 27, 473-478
- Ferrannini, E., et al. (2013) A Phase IIb, randomized, placebo-controlled study of the SGLT2 inhibitor empagliflozin in patients with type 2 diabetes. Diabetes, obesity & metabolism 15, 721-728
- Rosenstock, J., et al. (2013) Efficacy and safety of empagliflozin, a sodium glucose cotransporter 2 (SGLT2) inhibitor, as add-on to metformin in type 2 diabetes with mild hyperglycaemia. Diabetes, obesity & metabolism 15, 1154-1160
- Nicolle, L.E., et al. (2012) Effect of canagliflozin, a sodium glucose co-transporter 2 (SGLT2) inhibitor, on bacteriuria and urinary tract infection in subjects with type 2 diabetes enrolled in a 12-week, phase 2 study. Current medical research and opinion 28, 1167-1171
- Gupta, K., et al. (2011) International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: A 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America 52, e103-120
- Nicolle, L.E., et al.(2005) Infectious Diseases Society of America guidelines for the diagnosis and treatment of asymptomatic bacteriuria in adults. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America 40, 643-654
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam