CẬP NHẬT CÁC HỆ THỐNG DỮ LIỆU VÀ BÁO CÁO HÌNH ẢNH TUYẾN GIÁP (TI-RADS) TRONG CHẨN ĐOÁN UNG THƯ TUYẾN GIÁP
Nguyễn Bá Sỹ , Ngô Đức Cường
Khoa chẩn đoán hình ảnh – Bệnh viện Nội tiết Trung ương
DOI: 10.47122/vjde.2021.50.1
SUMMARY
Update on different Thyroid Imaging Reporting and Data System (TI-RADS) classifications in diagnosis of thyroid cancer
Thyroid cancer is the most common malignancy of the endocrine system and is increasing globally. However, thyroid cancer has a high success rate of treatment if it is detected at an early stage (small tumor size, the tumor has not invaded the surrounding, has not metastasized…), the prognosis is also better than other cancers. Many thyroid cancer risk assessment systems based on composition, acoustic density, margin, shape, and echocardiography are used. In 2017, the thyroid imaging, report and data system (ACR-TIRADS) of the American College of Radiology is widely used with 5 degrees according to the increasing suspicion of cancer. In the same year, the European Thyroid Society has published a guideline for the use of guidelines on risk stratification for malignancy of thyroid nodules (EU-TIRADS). The Korea Society of Thyroid Radiology and the Korean Thyroid Association has also adjusted and revised the TIRADS (KTIRADS) classification according to 5 grades; accordingly, the malignancy rate was recorded at the following levels: TIRADS 5 > 60%, TIRADS 4 > 15-50%, TIRADS 3 3-15%, TIRADS 2 <3%. To facilitate classification, screening, and follow-up, all thyroid nodules should be scored with the TIRADS, which can optionally be applied with ACR-TIRADS, EU-TIRADS, or K-TIRADS as these systems have similarity in imaging criteria, diagnostic value, and recommendation for indication of FNA.
Keywords: TIRADS, classification, thyroid cancer
TÓM TẮT
Ung thư tuyến giáp là bệnh ác tính thường gặp nhất của hệ nội tiết và đang có xu hướng gia tăng trên toàn cầu. Tuy nhiên, ung thư tuyến giáp có tỷ lệ điều trị thành công cao nếu được phát hiện ở giai đoạn sớm (kính thước khối u nhỏ, khối u chưa xâm lấn xung quanh, chưa di căn…), tiên lượng bệnh cũng tốt hơn các so với các loại ung thư khác. Nhiều hệ thống đánh giá nguy cơ ung thư tuyến giáp dựa trên các đặc điểm thành phần, mật độ âm, bờ, hình dạng, độ hồi âm được sử dụng. Năm 2017, hệ thống báo cáo dữ liệu hình ảnh tuyến giáp (Thyroid Imaging, Report and Data System – ACR-TIRADS) của Hội điện quang các trường đại học Mỹ được sử dụng rộng rãi, với 5 phân độ theo mức nghi ngờ ung thư tăng dần; Cùng năm đó, Hiệp hội tuyến giáp Châu Âu đã ban hành Hướng dẫn về siêu âm phân tầng nguy cơ bệnh ác tính của nhân tuyến giáp ở người lớn (EU-TIRADS) với 5 phân độ. Hội điện quang tuyến giáp Hàn Quốc và Hội tuyến giáp Hàn Quốc cũng đã điều chỉnh, sửa đổi phân độ TIRADS (K-TIRADS) theo 5 phân độ; theo đó, tần xuất ác tính ghi nhận ở các mức độ: TIRADS 5> 60%, TIRADS 4 > 15- 50%, TIRADS 3 3-15%, TIRADS 2 <3%. Để thuận tiện cho việc phân loại, sàng lọc và theo dõi, tất cả các nhân tuyến giáp nên được phân độ TIRADS, có thể tuỳ chọn phân độ theo ACR-TIRADS, EU-TIRADS hoặc KTIRADS vì các hệ thống này có sự tương đồng về tiêu chuẩn hình ảnh, giá trị chẩn đoán và khuyến cáo chỉ định FNA.
Từ khóa: phân độ, TIRADS, ung thư tuyến giáp
Tác giả liên hệ: Nguyễn Bá Sỹ
Email: [email protected]
Ngày nhận bài: 1/11/2021
Ngày phản biện khoa học: 10/11/2021
Ngày duyệt bài: 15/12/2021
1. ĐẶT VẤN ĐỀ
Ung thư tuyến giáp là bệnh ác tính thường gặp nhất của hệ nội tiết và đang có xu hướng gia tăng trên toàn cầu. Theo Hội Quốc tế phòng chống ung thư, ung thư tuyến giáp chiếm hơn 90% trong tổng số ung thư do tuyến nội tiết. Theo số liệu GLOBOCAN năm 2020 của Cơ quan quốc tế nghiên cứu về ung thư (IARC) ung thư tuyến giáp đứng hàng 11 về số ca mắc mới ung thư (586.202 ca), chiếm 3% trong tổng số ca mắc mới của tất cả các loại ung thư, số ca tử vong là 43.646 ca; tỷ lệ mắc mới ở nam là 3,1 và ở nữ là 10,1 trên 100.000 người; nguy cơ mắc ung thư tích lũy giai đoạn 0 – 74 tuổi là 0,33% ở nam và 1,02% ở nữ [1]. Ở Mỹ, ung thư tuyến giáp là ung thư thường gặp nhất ở phụ nữ độ tuổi 20 – 34 tuổi [2].
Trong vài thập niên gần đây tỷ lệ ung thư tuyến giáp có xu hướng tăng lên, tại Mỹ tỷ lệ mắc mới tăng từ 4,9 lên 14,3 trên 100.000 người (tăng 9,4/100.000 người) trong giai đoạn 1975 – 2009, trong đó mức tăng tuyệt đối ở nữ giới (từ 6,5 lên 21,4 = 14,9/100.000 phụ nữ) cao gấp 4 lần so với nam giới (từ 3,1 lên 6,9 = 3,8/100.000 nam giới)[3]. Một điều đáng lưu ý đó là hơn 25% ca mới chẩn đoán ung thư tuyến giáp năm 1988-1989 có kích thước ≤ 1 cm so với 39% ca mới chẩn đoán năm 2008-2009. Điều này là do sự phát triển của các phương tiện chẩn đoán như siêu âm tuyến giáp hoặc chẩn đoán hình ảnh khác và các phương pháp chẩn đoán mới và điều trị [4].
Trong các loại ung thư tuyến giáp, ung thư thể biệt hóa là chủ yếu, chiếm 90% số ca ung thư tuyến giáp. Hầu hết ung thư tuyến giáp không có triệu chứng, chỉ khi kích thước nhân lớn mới có thể nhìn thấy hoặc chèn ép gây khó nuốt, khó thở.. Tuy nhiên, ung thư tuyến giáp có tỷ lệ điều trị thành công cao nếu được phát hiện ở giai đoạn sớm (kính thước khối u nhỏ, khối u chưa xâm lấn xung quanh, chưa di căn…), tiên lượng bệnh cũng tốt hơn các so với các loại ung thư khác. Tỷ lệ sống sót sau 5 năm của các bệnh nhân mắc các thể ung thư tuyến giáp biệt hóa (thể nhú, thể nang, thể tủy – chiếm 99% các trường hợp thư tuyến giáp) là 100% ở giai đoạn sớm (I và II), nhưng giảm nhiều ở giai đoạn III và IV (64 – 70%) [5]. Do vậy, việc phát hiện sớm các nhân giáp ung thư hoặc nguy cơ ung thư cao để kịp thời điều trị là rất quan trọng để cải thiện tiên lượng của người bệnh.
2. NỘI DUNG
2.1. Tổng quan về nhân tuyến giáp và chẩn đoán ung thư tuyến giáp
Tuyến giáp là tuyến nội tiết nằm ở vùng cổ dưới trước bên, phía trước và hai bên khí quản, ngang với đốt sống cổ V, VI, VII và đốt ngực I. Tuyến giáp gồm hai thuỳ, nối với nhau bởi eo giáp, làm tuyến giáp giống hình con bướm. Đôi khi từ eo giáp, phát triển thành một thuỳ (thuỳ tháp) chạy lên phía trên. Mỗi thuỳ bên có hình nón, đỉnh hướng lên trên và ra ngoài, cao 5 cm, chỗ rộng nhất khoảng 3 cm, dày 2 cm. Thuỳ tuyến giáp có 3 mặt, hai bờ, hai cực. Tuyến giáp nặng khoảng 15-25g, lưu lượng máu qua tuyến giáp rất cao. Tuyến giáp di chuyển theo nhịp nuốt, nhờ đó mà ta phân biệt được các khối u của tuyến giáp với các khối u khác ở cổ.
Ung thư tuyến giáp chiếm 3 – 7% trong số các nhân tuyến giáp [6-8]. Mặt khác nhân tuyến giáp lành tính là bệnh rất thường gặp với tỷ lệ 19 – 68% dân số [5, 8, 9]. Việc phân biệt nhân giáp lành tính và ác tính là rất quan trọng trong việc theo dõi, quản lý và điều trị các nhân tuyến giáp.
Khi nhân tuyến giáp được phát hiện hoặc nghi ngờ trên lâm sàng, các thăm dò cận lâm sàng được thực hiện để xác định nhân và bản chất của nhân là cần thiết. Quy trình tóm tắt đánh giá và quản lý nhân tuyến giáp thường quy hiện nay được trình bày ởhình 2 dưới đây [8]. Khám lâm sàng ít có giá trị trong phân biệt nhân tuyến giáp lành tính và ác tính, dễ bỏ sót những tổn thương nhỏ hoặc nằm sâu. Các xét nghiệm đánh giá chức năng tuyến giáp (hormon TSH và hormon tuyến giáp FT4 huyết thanh) và xạ hình giúp xác định nhân giáp tăng hoạt động chức năng (nhân nóng) – có nguy cơ ung thư rất thấp và không cần làm xét nghiệm tế bào nhân tuyến giáp qua chọc hút kim nhỏ (FNAC). Hầu hết các trường hợp nhân giáp có chức năng tuyến giáp bình thường (TSH huyết tương bình thường).
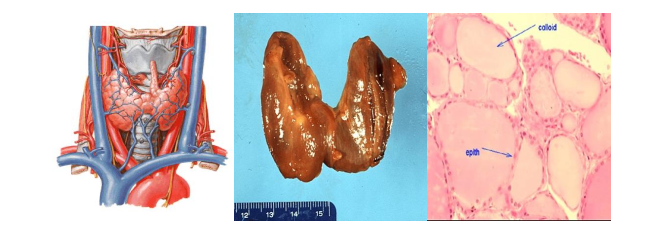
Hình 1. Giải phẫu, đại thể và mô học tuyến giáp bình thường
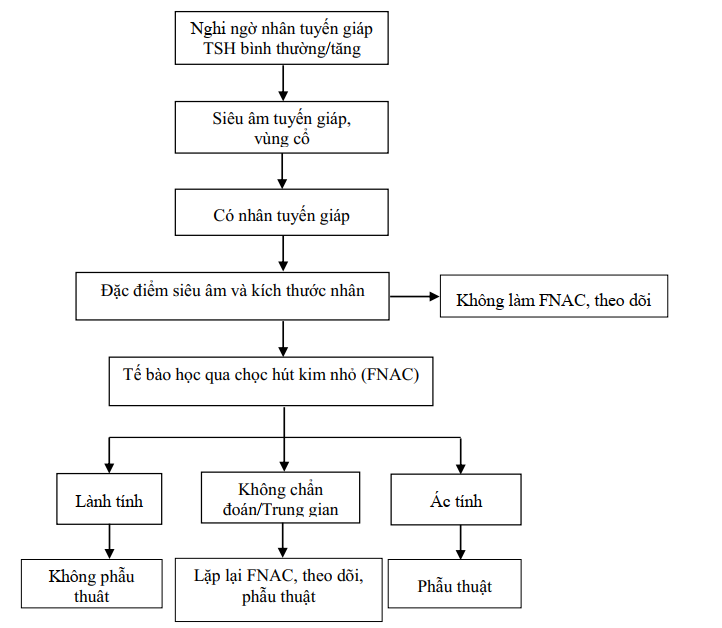
Hình 2. Phác đồ lược giản đánh giá và quản lý nhân tuyến giáp
2.2. Giới thiệu và cập nhật một số hệ thống phân độ TIRADS trên thế giới
Siêu âm tuyến giáp (hai chiều) được chỉ định cho tất cả các trường hợp nghi ngờ có bệnh lý tuyến giáp, bao gồm cả nhân tuyến giáp. Đây là phương pháp không xâm nhập, an toàn, chi phí thấp và có thể thực hiện tại mọi cơ sở y tế, được thống nhất chấp nhận là phương pháp đánh giá ban đầu nhân tuyến giáp [8, 10, 11]. Siêu âm tuyến giáp có độ nhạy rất cao trong phát hiện nhân tuyến giáp và có giá trị sàng lọc ung thư tuyến giáp thông qua đánh giá mức độ nguy cơ ung thư tuyến giáp của nhân giáp. Các đặc điểm hình ảnh siêu âm nhân tuyến giáp được sử dụng để đánh giá nguy cơ ung thư bao gồm: Thành phần, mật độ âm, bờ viền, hình dạng, vôi hóa.
Một số hình ảnh siêu âm đánh giá nhân tuyến giáp dược sử dụng để đánh giá nguy cơ ung thư
Thành phần bên trong
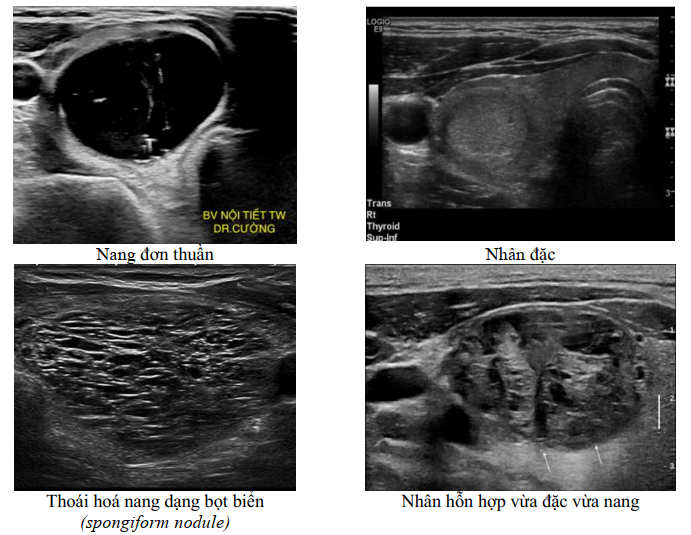
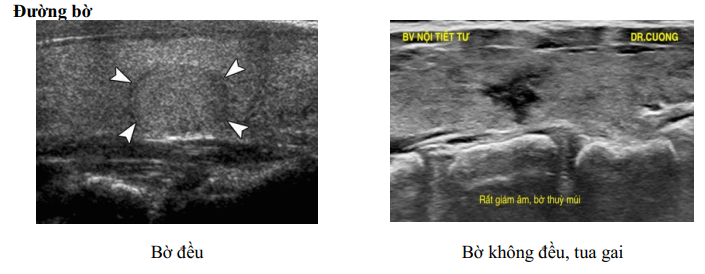
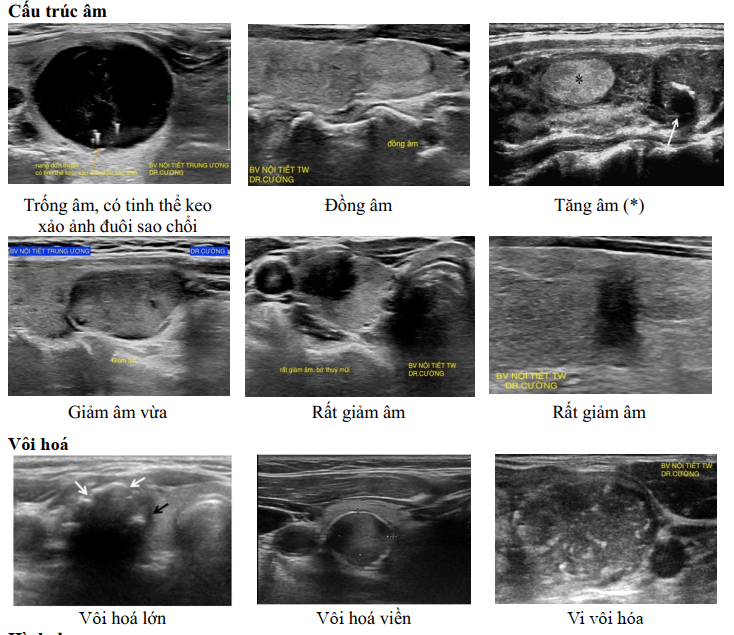
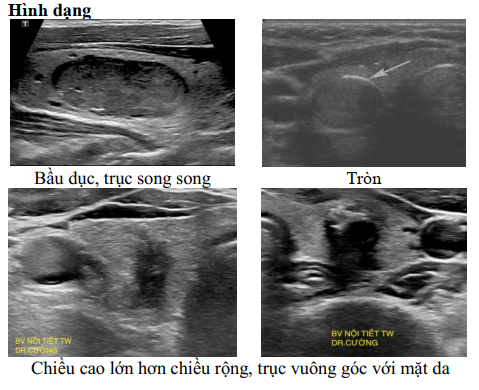

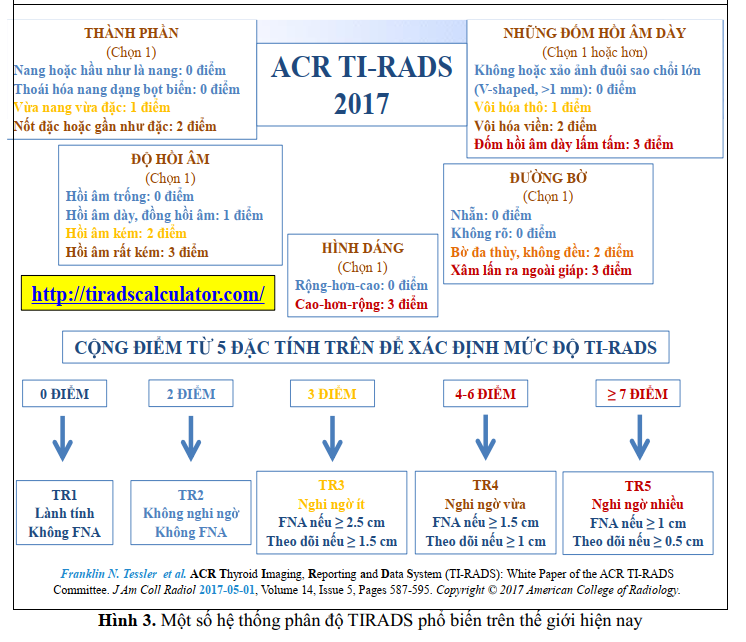
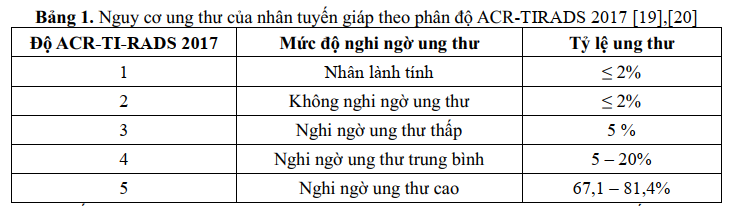
Nhiều hệ thống đánh giá nguy cơ ung thư tuyến giáp dựa trên các đặc điểm này được sử dụng [12],[13],[14],[15],[16], [17], [18] trong đó hệ thống báo cáo dữ liệu hình ảnh tuyến giáp (Thyroid Imaging, Report and Data System – TI-RADS) của Hội điện quang các trường đại học Mỹ (ACR American college of radiology) năm 2017 được sử dụng rộng rãi (Hình 3), với 5 độ theo mức nghi ngờ ung thư tăng dần (Bảng1) [19],[20].
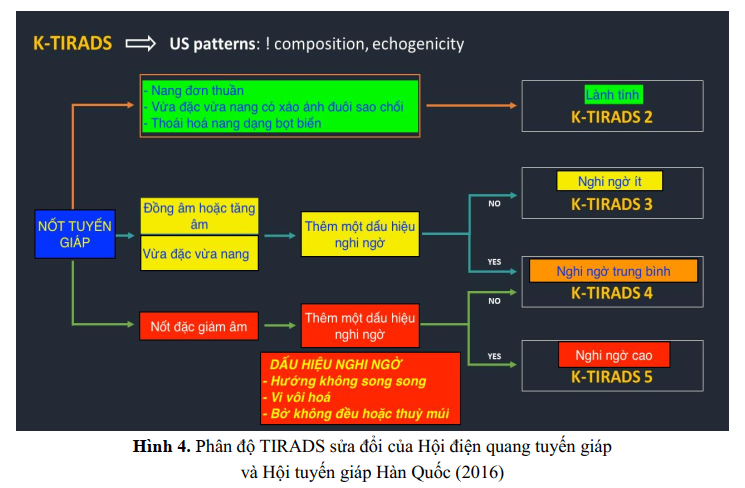
Một số phân độ TIRADS khác cũng được sử dụng rộng rãi, đặc biệt tại Châu Á, Hội điện quang tuyến giáp Hàn Quốc (KSThR) năm 2011 dựa trên công trình của Kwak [21], đã đề xuất phân độ TIRADS gồm các mức 1, 2, 3, 4a, 4b, 4c và 5. Năm 2016, KSThS cùng Hội tuyến giáp Hàn Quốc (KTA) đưa ra phân độ TIRADS sửa đổi, chỉ còn phân độ 1, 2, 3, 4, 5 (Hình 4). Theo đó, tần xuất ác tính ghi nhận ở các mức độ: TIRADS 5> 60%, TIRADS 4 > 15-50%, TIRADS 3 3-15%, TIRADS 2 <3%. [22]
Tại Việt Nam, Bùi Văn Lệnh, Trần Thúy Hồng đã nghiên cứu sử dụng phân độ KSThS 2011 [23], [24]. Tỷ lệ ung thư tuyến giáp theo phân độ TIRADS của KSThR trong các một số nghiên cứu (bảng 3):
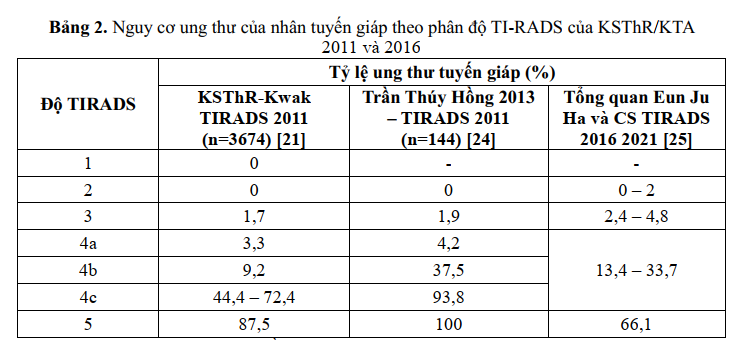
Những nghiên cứu so sánh gần đây cho thấy tiêu chuẩn sinh thiết của TIRADS theo KSThR trên nhân >= 1cm có độ nhạy cao nhất và độ đặc hiệu thấp nhất về chẩn đoán u ác tính nhưng có tỷ lệ sinh thiết không cần thiết cao nhất trong các hệ thống phân tầng nguy cơ dựa vào siêu âm (RSS). Trong khi đó tiêu chuẩn sinh thiết theo ACR-TIRADS có độ nhạy thấp nhất, độ đặc hiệu cao nhất và tỷ lệ sinh thiết không cần thiết thấp nhất [25]. Xét nghiệm tế bào học qua chọc hút kim nhỏ (FNAC) là bước tiếp theo trong chẩn đoán ung thư tuyến giáp, được chỉ định căn cứ vào mức độ nghi ngờ ung thư và kích thước của nhân tuyến giáp. Theo ACR, FNAC được chỉ định như sau [17]: Nhân tuyến giáp kích thước > 10mm nếu nghi ngờ ung thư cao (TI-RADS 5) Nhân tuyến giáp kích thước > 15mm nếu nghi ngờ ung thư trung bình (TI-RADS 4) Nhân tuyến giáp kích thước > 25mm nếu nghi ngờ ung thư thấp (TI-RADS 3) Hướng dẫn của Hội các nhà nội tiết lâm sàng Mỹ/Hội Nội tiết Mỹ/Hội các nhà nội tiết (Ý) khuyến cáo FNAC hoặc theo dõi nhân có kích thước > 0,5mm và nguy cơ cao [18]. Hệ thống báo cáo kết quả tế bào học tuyến giáp Bethesda thường được sử dụng theo đó kết quả FNAC được phân loại vào 1 trong 6 loại dưới đây với nguy cơ ung thư như sau [8],[26]:
I: Không chẩn đoán được/hoặc thỏa mãn – Nguy cơ ác tính 5 – 10%
II: Lành tính – Nguy cơ ác tính 0 – 3%
III: Bất thường không có ý nghĩa xác định hoặc tổn thương nang không có ý nghĩa xác định – Nguy cơ ác tính 6 – 18%
IV: U thể nang hoặc nghi ngờ u thể nang – Nguy cơ ác tính 10 – 40%
V: Nghi ngờ ác tính – Nguy cơ ác tính 45 – 60%
VI: Ác tính – Nguy cơ ác tính 94 – 96%.
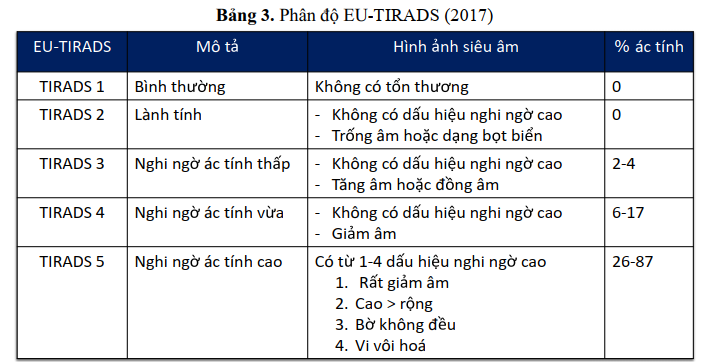
Tại Châu Âu, năm 2017 Hiệp hội tuyến giáp Châu Âu đã ban hành Hướng dẫn về siêu âm phân tầng nguy cơ bệnh ác tính của nhân tuyến giáp ở người lớn (EU-TIRADS) như trong bảng 4[27].
Trong đó với phân độ EU-TIRADS cần lưu ý một số đặc điểm của hình ảnh siêu âm như: Giảm âm: Giảm âm hơn mô tuyến giáp xung quanh.
Rất giảm âm: Giảm âm hơn cơ vùng cổ
Vi vôi hoá: Đốm tăng âm, không có bóng cản, Xảo ảnh lấp lánh sau nốt vôi hóa trên doppler màu(+/-)
Khuyến cáo FNA: T3 >= 2cm, T4 >= 1.5cm, T5 >= 1cm
So sánh các hệ thống phân độ TIRADS Hiện nay hầu hết các hệ thống phân độ TIRADS mới đều dễ áp dụng vì bỏ đi các phân độ dưới type và có khuyến cáo FNA. Một nghiên cứu so sánh giữa ACR TIRADS, hướng dẫn của ATA- 2015 và EUTIRADS cho thấy độ chính xác trong phát hiện các nhân lành tính cao nhất ở phân độ ACR-TIRADS ( 59,93%), ATA 2015 là 55,20% và 51,25% với EU-TIRADS. Tỉ lệ độ nhạy, độ đặc hiệu tương ứng của các hướng dẫn này như sau; ATA-2015 (82,22, 53,47), ACR-TIRADS (48,89, 60,63) và EUTIRADS (86,67, 48,99).[28] Nghiên cứu vai trò của các hệ thống phân độ 4 TIRADS: ACR TIRADS, ATA 2015, EU-TIRAS và KTIRADS trong các nhân tuyến giáp với tế bào học không chẩn đoán/không đặt yêu cầu cho thấy các hệ thống này có thể là công cụ hữu ích để hướng hẫn quản lý nhân giáp với tế bào học không chẩn đoán/ không đạt yêu cầu.[29] Độ nhạy độ đặc hiệu gộp chung các nhân nghi ngờ cho cao (4 hoặc 5) của ACRTIRADS là 0.84 và 0.64. Khi áp dụng ACRTRADS cho trẻ em, tỉ lệ bỏ sót u ác tính gộp chung (21,7%) và tỉ lệ sinh thiết không cần thiết là (62,7%). [30] Tuy nhiên hệ thống ATA, K-TRADS và ACR-TRADS không có giá trị trong việc phân tầng ở nhưng bện nhân có nhân giáp Bethesda loại IV, do vậy các bác sĩ lâm sàng nên thận trọng khi tham khảo siêu âm để đưa ra quyết định điều trị cho những bệnh nhân có nhân tuyến giáp Bethesda IV.[31]
Dấu hiệu khác đánh giá nguy cơ ung thư tuyến giáp
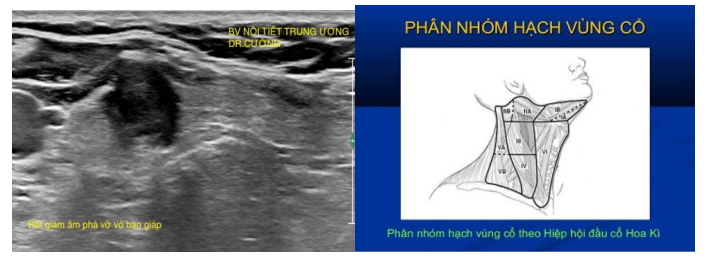
• Dấu hiệu xâm lấn ngoài bao giáp: Là dấu hiệu rất chắc chắn của tổn thương ác tính và có liên quan đến thời gian sống của bệnh nhân tuy nhiên chưa được đưa vào phân độ TIRADS. [32]
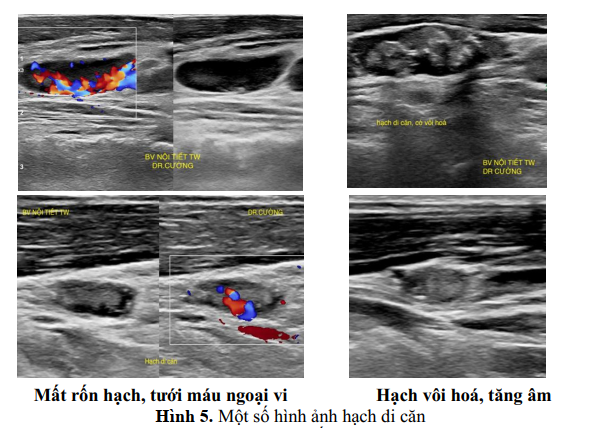
• Hạch cổ di căn của ung thư tuyến giáp
Một số dấu hiệu gợi ý như: hình tròn, tăng âm, có vi vôi hoá hoặc vôi hoá thô, hoại tử kén hoá trong hạch, tưới máu ở ngoại vi. Vị trí hạch thường gặp ở cùng bên với nhân tuyến giáp ác tính và hay gặp chủ yếu hạch nhóm III, IV, VI.[33]
Vai trò của siêu âm doppler và siêu âm đàn hồi mô trong khảo sát nhân tuyến giáp
Siêu âm tuyến giáp không xác định được nhân tuyến giáp là lành tính hay ác tính mà chỉ đánh giá được mức độ nguy cơ ác tính của nhân tuyến giáp để giúp bác sỹ đưa ra quyết định có làm FNAC hay không. Việc đánh giá mức độ nguy cơ ác tính của nhân tuyến giáp được dựa trên những đặc điểm hình ảnh siêu âm tuyến giáp do bác sỹ chẩn đoán hình ảnh (CĐHA) nhận định. Do vậy việc đánh giá nguy cơ ác tính của nhân giáp mang tính chủ quan, phụ thuộc rất nhiều vào trình độ và kinh nghiệm của bác sỹ CĐHA. Mặc dù vậy, siêu âm doppler và siêu âm đàn hồi mô vẫn đóng vai trò nhất định trong khảo sát nhân tuyến giáp.
Nghiên cứu của Hee Jung Moon và cộng sự (2010) cho kết quả trên 1.083 nhân tuyến giáp có 814 nhân lành tính và 269 nốt ác tính. Tưới máu trong nhân thường thấy ở nhân lành tính và không tưới máu trong nhân lại thường thấy ở nhân ác tính. Theo đó, tưới máu trong nốt thấy ở 31% nhân lành tính so với 17% ở nhân ác tính. Không tưới máu trong nhân thấy ở 60% nhân ác tính so với 43% ở nhân lành tính.[34] Nghiên cứu của Grace C. H. Yang và cộng sự (2017) cho thấy phần lớn nhân ác tính thấy trên siêu âm không có tưới máu trong nhân, và hầu hết nhân giàu tưới máu là nhân lành tính, hoặc biến thể của ung thư nhú tuyến giáp (papillary carcinoma), hoặc ung thư dạng nang tuyến giáp (follicular carcinomas).[35] Trong một số nghiên cứu mới nhất, khảo sát tưới máu trong nhân tuyến giáp không có ý nghĩa tiên lượng nguy cơ ác tính, siêu âm doppler không đóng góp thêm giá trị so với siêu âm B-mode trong việc đánh giá nhân ác tính.Vai trò của siêu âm doppler chỉ còn giá trị trong đánh giá tưới máu của hạch di căn vùng cổ.[36] Về siêu âm đàn hồi mô, các kết quả nghiên cứu của Cantisani và cộng sự (2015a, 2015b), Cosgrove và cộng sự (2013 cho thấy tỷ lệ đồng thuận liên quan đến việc siêu âm đàn hồi có thể dùng kết hợp với siêu âm B- mode để tăng độ chuyên biệt lên tới 86% với hai tỷ số được sử dụng là:
– Tỷ số căng nhu mô/nhân (parenchyma-to-nodule strain ratio – PNSR): độ cứng trung bình trong nhu mô chia cho độ cứng trung bình trong nhân.
– Tỷ số căng cơ/nhân (muscle-to-nodule strain ratio – MNSR): độ cứng trung bình trong nhu mô chia cho độ cứng trung bình trong nhân.
– Tỷ số căng cơ/nhân (muscle-to-nodule strain ratio – MNSR): độ cứng trung bình của cơ vùng cổ kế cận chia cho độ cứng trung bình của nhân.[37]
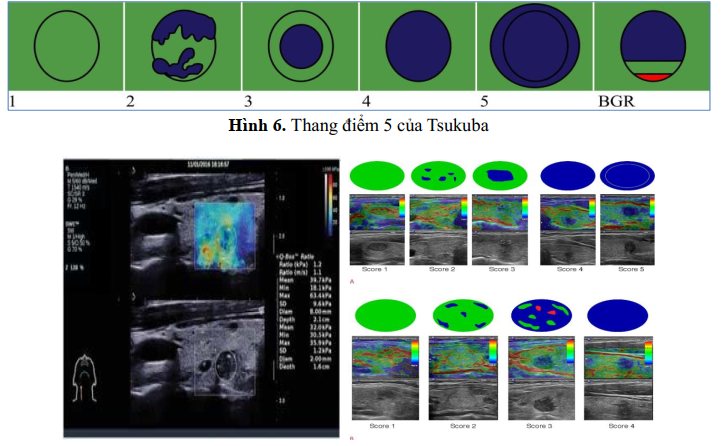
Ngoài ra, siêu âm tuyến giáp có thể sử dụng thang điểm 5 của Tsukuba dùng cho tuyến vú với tỷ lệ đồng thuận là 86%, trong đó điểm 4 và 5 có giá trị tiên đoán cao nhất (Hình 6). Các nghiên cứu gần đây cho thấy siêu âm đàn hồi biến dạng mô hoặc siêu âm đàn hồi sóng biến dạng có giá trị bổ trợ rất tốt cho siêu âm B-mode trong việc chẩn đoán nhân giáp ác tính.[38, 39][40]
3. KẾT LUẬN
Tất cả các nhân tuyến giáp nên được phân độ TIRADS, có thể tuỳ chọn phân độ theo ACR-TIRADS, EU-TIRADS hoặc KTIRADS. Siêu âm dopper không còn ý nghĩa tiên lượng nguy cơ ác tính và không đóng góp thêm vai trò gì cho siêu âm 2D. Siêu âm doppler chỉ còn giá trị trong việc đánh giá tưới máu hạch di căn. Siêu âm đàn hồi mô có giá trị bổ trợ rất tốt cho siêu âm 2D và nên tiến hành FNA các nhân có siêu âm đàn hồi mô dương tính.
TÀI LIỆU THAM KHẢO
1. Sung, H., Ferlay J, Siegel RL et al, .Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA CANCER J CLIN;, 2021. 71: 209 – 249.
2. Siegel, R., Miller KD, Jemal A, . Cancer statistics. CA Cancer J. Clin.;, 2019. 69 (1): 7-34.
3. Davies, L., GilbertWelch H, . Current Thyroid Cancer Trends in the United States. JAMA Otolaryngol Head Neck Surg.;, 2014. 140(4): 317-322.
4. Haugen, B., Alexander EK, Bible KC, et al,, . 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiated Thyroid Cancer. Thyroid;, 2016. 26(1): 2.
5. Ha, E., Baek JH, Na DG, . Risk stratification of thyroid nodules on ultrasonography: current status and perspectives. thyroid;, 2017. 27: 1463 – 1468.
6. Laszlo, H., . Clinical practice. The thyroid nodule. New England J. Med.;, 2004. 351(17): 1764–1771 .
7. Gharib, H.e.a., . American association of clinical endocrinologists, associazione medici endocrinologi, and europeanthyroid association medical guidelines for clinical practice for the diagnosis and management of thyroid nodules. Endocrine Pract.;, 2010. 16 (2010) 1–43 Suppl 1.
8. Haugen, B., . 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: what is new and what has changed? Cancer;, 2017. 123: 372 – 381.
9. Shin, J., Baek JH, Chung J, Ha EJ, Kim JH, Lee YH, et al, . Ultrasonography diagnosis and imaging-based management of thyroid nodules: revised Korean Society of Thyroid Radiology consensus statement and recommendations. Korean J Radiol;, 2016. 17: 370 – 395.
10. Song, G., Xue F, Zhang C, . A model using texture features to differentiate the nature of thyroid nodules on sonography. J. Ultrasound Med;, 2015. 34 (10): 1753– 1760 .
11. Acharya, U., et al, . A review on ultrasound-based thyroid cancer tissue characterization and automated classification. , Technol. Cancer Res. Treat.;, 2014. 13 (4): 289–301.
12. Russ, G., Bonnema SJ, Erdogan MF, Durante C, Ngu R, Leenhardt L, . European Thyroid Association guidelines for ultrasound malignancy risk stratification of thyroid nodules in adults: the EU-TIRADS. Eur Thyroid J;, 2017. 6: 225–237.
13. Nguyen, X., Choudhury KR, Eastwood JD, et al . Incidental thyroid nodules on CT: evaluation of 2 risk-categorization methods for workup of nodules. AJNR Am J Neuroradiol;, 2013. 34: 1812 – 1817.
14. Li, Q., Lin X, Shao Y, Xiang F, Samir AE, . Imaging and screening of thyroid cancer. Radiol Clin North Am;, 2016. 55: 1261-1271.
15. Tamhane, S., Gharib H, . Thyroid nodule update on diagnosis and management. Clin Diabetes Endocrinol;, 2016. 2: 17.
16. Durante, C., Grani G, Lamartina L, Filetti S, Mandel SJ, Cooper DS, . The diagnosis and management of thyroid nodules: a review. JAMA;, 2018. 319: 914–924.
17. Tessler, F., Middleton WD, Grant EG, Hoang JK, Berland LL, Teefey SA, et al, . ACR thyroid imaging, reporting and data system (TIRADS): white paper of the ACR TI-RADS Committee. J Am Coll Radiol;, 2017. 14: 587 – 595.
18. AACE/ACE/AME, T.F.o.T.N., . American Association Of Clinical Endocrinologists, American College Of Endocrinology, and Associazione Medici Endocrinologi Medical Guidelines For Clinical Practice For The Diagnosis And Management Of Thyroid Nodules – 2016 Update. Endocr Pract.;, 2016. 22(Suppl 1).
19. Xu, T., Wu Y, W RX, et al, . Validation and comparison of three newly-released Thyroid Imaging Reporting and Data Systems for cancer risk determination. Endocrine, Published online; https://doi.org/10.1007/s12020-018-1817- 8;, 2018.
20. Zheng, Y., Xu S, Kang H, Zhan W, . A Single-Center Retrospective Validation Study of the American College of Radiology Thyroid Imaging Reporting and Data System. Ultrasound Q;, 2018. 34(2): 77 – 83.
21. Kwak, J., Han KH, Yoon JH et al, .Thyroid Imaging Reporting and Data System for US Features of Nodules : A Step in Establishing Better Stratification of Cancer Risk. Radiology;, 2011. : 260 (3): 892 -899.
22. Shin, J.H., et al., Ultrasonography Diagnosis and Imaging-Based Management of Thyroid Nodules: Revised Korean Society of Thyroid Radiology Consensus Statement and Recommendations. Korean journal of radiology, 2016. 17(3): p. 370-395.
23. Bùi Văn Lệnh, Lê Tuấn Linh, Tran Thuy Hong. Cập nhật chẩn đoán hình ảnh phân loại bướu nhân tuyến giáp lành tính và ác tính. Điện quang Việt Nam:, 2015. 58 – 63.
24. Hồng, T.T., . Đặc điểm hình ảnh và giá trị của siêu âm trong chẩn đoán các tổn thương khu trú tuyến giáp. Luận văn thạc sỹ chuyên ngành chẩn đoán hình ảnh;, 2013. Trường Đại học Y Hà Nội.
25. Ha, E., Na DG, Baekc JH, . Korean Thyroid Imaging Reporting and Data System: Current Status, Challenges, and Future Perspectives. Korean J Radiol.:, 2021. 22(9):1569-1578. 26.
26. Cibas, E., and Ali SZ, . The 2017 Bethesda System for Reporting Thyroid Cytopathology. Thyroid;, 2017. 27(11): 1341 – 1346.
27. Russ, G., et al., European Thyroid Association Guidelines for Ultrasound Malignancy Risk Stratification of Thyroid Nodules in Adults: The EU-TIRADS. Eur Thyroid J, 2017. 6(5): p. 225-237.
28. Koc, A.M., et al., Comparison of diagnostic accuracy of ACR-TIRADS, American Thyroid Association (ATA), and EU-TIRADS guidelines in detecting thyroid malignancy. European journal of radiology, 2020. 133: p. 109390-109390.
29. Lee, Y.-B., et al., Comparison of Four Ultrasonography-Based Risk Stratification Systems in Thyroid Nodules with Nondiagnostic/Unsatisfactory Cytology: A Real-World Study. Cancers, 2021. 13(8): p. 1948.
30. Kim, P.H., et al., Diagnostic performance of adult-based ATA and ACR-TIRADS ultrasound risk stratification systems in pediatric thyroid nodules: a systematic review and meta-analysis. Eur Radiol, 2021.
31(10): p. 7450-7463. 31. Yang, W., et al., Can the American Thyroid Association, K-Tirads, and AcrTirads Ultrasound Classification Systems Be Used to Predict Malignancy in Bethesda Category IV Nodules? Endocr Pract, 2020. 26(9): p. 945-952.
32. Youngwirth, L.M., et al., Extrathyroidal Extension Is Associated with Compromised Survival in Patients with Thyroid Cancer. Thyroid, 2016. 27(5): p. 626-631.
33. Leenhardt, L., et al., 2013 European thyroid association guidelines for cervical ultrasound scan and ultrasound-guided techniques in the postoperative management of patients with thyroid cancer. European thyroid journal, 2013. 2(3): p. 147-159.
34. Moon, H.J., et al., Can vascularity at power Doppler US help predict thyroid malignancy? Radiology, 2010. 255(1): p. 260-9.
35. Yang, G.C.H. and K.O. Fried, Most Thyroid Cancers Detected by Sonography Lack Intranodular Vascularity on Color Doppler Imaging: Review of the Literature and Sonographic-Pathologic Correlations for 698 Thyroid Neoplasms. J Ultrasound Med, 2017. 36(1): p. 89-94.
36. Shin, J.H., et al., Ultrasonography Diagnosis and Imaging-Based Management of Thyroid Nodules: Revised Korean Society of Thyroid Radiology Consensus Statement and Recommendations. Korean J Radiol, 2016. 17(3): p. 370-95.
37. Ciledag, N., et al., The utility of ultrasound elastography and MicroPure imaging in the differentiation of benign and malignant thyroid nodules. AJR Am J Roentgenol, 2012. 198(3): p. W244-9.
 Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam
Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam Hội Nội Tiết – Đái Tháo Đường Miền Trung Việt Nam